Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Serie de Ejercicios
Cargado por
Chanocua Gutierrez Metztli0 calificaciones0% encontró este documento útil (0 votos)
16 vistas2 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
16 vistas2 páginasSerie de Ejercicios
Cargado por
Chanocua Gutierrez MetztliCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
SERIE DE EJERCICIOS
MODELOS FISICOQUIMICOS EN
BIOLOGIA
1. En un rifle de aire comprimido se logran encerrar 150 cm3 de aire que se
encontraban a presión normal y que ahora pasan a ocupar un volumen a
25cm3 ¿Qué presión ejerce el aire?
2. Una masa gaseosa ocupa un volumen de 250cm3 cuando su temperatura es
de -5ºC y la presión 740mmHg. ¿Qué presión ejercerá esa masa gaseosa si,
manteniendo constante el volumen, la temperatura se eleva a 27ºC?
3. Manteniendo constante la presión, se ha duplicado el volumen del gas. ¿Qué
le habrá pasado a su temperatura?
4. Una máquina térmica que presenta una eficiencia del 30%, realiza un trabajo
de 200 J. durante cada ciclo.
Determina:
a) ¿Qué cantidad de calor absorbe durante el ciclo?
b) ¿Qué cantidad de calor libera?
5. Un gas ideal diatómico (cv=5/2 R) se encuentra inicialmente a una
temperatura T1=27ºC, una presión p1=105 Pa y ocupa un volumen V1=0.4
m3. El gas se expande adiabáticamente hasta ocupar un volumen V2=1,2
m3. Posteriormente se comprime isotérmicamente hasta que su volumen es
otra vez V1 y por último vuelve a su estado inicial mediante una
transformación isócora. Todas las transformaciones son reversibles.
a) Dibuja el ciclo en un diagrama p-V. Calcula el número de moles del gas
y la presión y la temperatura después de la expansión adiabática.
b) Calcula la variación de energía interna, el trabajo y el calor en cada
transformación.
SERIE DE EJERCICIOS
MODELOS FISICOQUIMICOS EN
BIOLOGIA
1. En la reacción
N2 (g) + 3 H2 (g) → 2 NH3 (g)
en un momento dado el hidrógeno está reaccionando a la velocidad de 0.090
mol.L-1.s-1:
a) Calcula la velocidad a la que está reaccionando el nitrógeno.
b) Determina con qué velocidad se forma el amoníaco en ese momento.
2. En la reacción:
La ecuación de la velocidad es v = k·[NO]2 · [H2].
a) Indique el orden de reacción con respecto a cada uno de los reactivos.
b) ¿Cuál es el orden total de la reacción?
c) Deduzca las unidades de la constante de velocidad.
3. La presión de vapor del etanol es de 135.3 mmHg a 40oC y 542.5 mmHg a
70oC. Calcular el calor molar de vaporización y la presión del etanol a 50 oC.
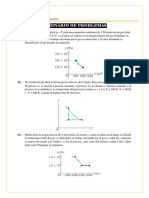
4. Se ha estudiado la presión de vapor del etanol en función de la temperatura
obteniéndose los siguientes datos:
T (oC) 0 10 20 30 50 70 80
P (mmHg) 12.2 23.6 43.9 78.8 222.2 542.5 812.6
Calcular gráficamente ∆Hvap y la temperatura de ebullición a 760mmHg.
5. Sabiendo que el punto de ebullición de un hidrocarburo es de 100 oC a una
presión de 1 atm y que el calor de vaporización para dicho hidrocarburo es de
7800 cal/mol, determine su presión de vapor a 95oC.
También podría gustarte
- Problemario QiDocumento25 páginasProblemario QiIrving Sanchez0% (1)
- Guía Ejercicios TDDocumento6 páginasGuía Ejercicios TDKatheryn MondragónAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Problemario ProbalidadDocumento25 páginasProblemario ProbalidadErixel Jijon0% (2)
- TermoQca Taller No. 4 2018-1Documento1 páginaTermoQca Taller No. 4 2018-1Mauricio Taborda MontañoAún no hay calificaciones
- Flujo de fluidos e intercambio de calorDe EverandFlujo de fluidos e intercambio de calorCalificación: 1 de 5 estrellas1/5 (1)
- Guía 1 PDFDocumento3 páginasGuía 1 PDFDaniel Andres Roa UmañaAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Guía de Ejercicios Unidad 3 PTM0 Ciclo 01-2024Documento2 páginasGuía de Ejercicios Unidad 3 PTM0 Ciclo 01-2024Oscar 548Aún no hay calificaciones
- Formalismo y métodos de la termodinámica. Volumen 1De EverandFormalismo y métodos de la termodinámica. Volumen 1Aún no hay calificaciones
- Guía Fisicoquímica IDocumento3 páginasGuía Fisicoquímica ITania GachusAún no hay calificaciones
- Preparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaDe EverandPreparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaCalificación: 3 de 5 estrellas3/5 (2)
- Xdoc - MX Termodinamica Guzlop EditorasDocumento10 páginasXdoc - MX Termodinamica Guzlop Editorasnewton bardajesAún no hay calificaciones
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Problemas Tema 2Documento2 páginasProblemas Tema 2José Rafael GuillénAún no hay calificaciones
- Trabajo - Termodinamica PDFDocumento2 páginasTrabajo - Termodinamica PDFExamenesPorWhatsappAún no hay calificaciones
- 02 - Gases y TransformacionesDocumento2 páginas02 - Gases y TransformacionesfacundoAún no hay calificaciones
- Unidad 2 - Termodinámica - EjerciciosDocumento10 páginasUnidad 2 - Termodinámica - Ejerciciosʙʀᴀɴᴅᴏɴ ᴀᴅᴜᴠɪʀɪAún no hay calificaciones
- FseyndrxuDocumento4 páginasFseyndrxuMiguel SaavedraAún no hay calificaciones
- VII Practica Dirigida TERMODINAMICADocumento2 páginasVII Practica Dirigida TERMODINAMICAOmar Quispe100% (1)
- NNNMDocumento13 páginasNNNMredyz huamanAún no hay calificaciones
- Taller 2 (Primeraley y Gases Ideales)Documento3 páginasTaller 2 (Primeraley y Gases Ideales)Jessika Julieth Siachoque SuarezAún no hay calificaciones
- FQ1 - Relación General de Problemas - 2014!09!09Documento25 páginasFQ1 - Relación General de Problemas - 2014!09!09scrjonAún no hay calificaciones
- Guía de Problemas Repaso y Unidad 1 CORREGIDODocumento5 páginasGuía de Problemas Repaso y Unidad 1 CORREGIDOGladys GimenezAún no hay calificaciones
- Practica # 3Documento11 páginasPractica # 3Roger MendezAún no hay calificaciones
- Ecuación de Estado y Primera Ley de La TermodinámicaDocumento8 páginasEcuación de Estado y Primera Ley de La TermodinámicaIng Manuel QuintAún no hay calificaciones
- Guia 1 Primera Ley GasesDocumento7 páginasGuia 1 Primera Ley GasesGeraldineAún no hay calificaciones
- Ejercicios de TermodinámicaDocumento2 páginasEjercicios de TermodinámicaJenner Alexander Naquiche Horna0% (2)
- Guía de Ejercicios N°4Documento4 páginasGuía de Ejercicios N°4gonzamboAún no hay calificaciones
- Ejercicios Termodinamica BasicaDocumento13 páginasEjercicios Termodinamica BasicaNicolas Vasquez36% (11)
- QGII PC2017qgiiDocumento15 páginasQGII PC2017qgiiGianpierre Rojas AgapitoAún no hay calificaciones
- TermoDocumento3 páginasTermoRodrigo Garcia0% (1)
- Problemas AsigDocumento5 páginasProblemas Asigjulian morenoAún no hay calificaciones
- Guía de Ejercicios Tema 3Documento4 páginasGuía de Ejercicios Tema 3Kleidder ZacariasAún no hay calificaciones
- Term Odin A MicaDocumento23 páginasTerm Odin A MicaDiego NavarroAún no hay calificaciones
- Termodinamica 3 ParcialDocumento8 páginasTermodinamica 3 ParcialLAún no hay calificaciones
- Serie de Primera Ley en Sistemas Cerrados y Termoquimica 1Documento2 páginasSerie de Primera Ley en Sistemas Cerrados y Termoquimica 1Mafer RangelAún no hay calificaciones
- Taller 3 (Segunda Ley de La Termodinamica)Documento3 páginasTaller 3 (Segunda Ley de La Termodinamica)Jessika Julieth Siachoque SuarezAún no hay calificaciones
- Taller 3 - TermodinámicaDocumento4 páginasTaller 3 - TermodinámicavanegasmarinAún no hay calificaciones
- Problemas de Física 1 Semana 6Documento3 páginasProblemas de Física 1 Semana 6ALONSO CONDORI CORNEJOAún no hay calificaciones
- Guía TermodinámicaDocumento8 páginasGuía TermodinámicayoshiwisAún no hay calificaciones
- 4.1 Practica Dirigida TERMODINAMICA (S-Virtual)Documento1 página4.1 Practica Dirigida TERMODINAMICA (S-Virtual)CÓRDOVA RODRÍGUEZ JUAN AUGUSTOAún no hay calificaciones
- Guía 2 TermodinámicaDocumento3 páginasGuía 2 TermodinámicaJosé Barrera CovarrubiasAún no hay calificaciones
- Termoquimica y Primera Ley de La TermodinamicaDocumento4 páginasTermoquimica y Primera Ley de La TermodinamicaMariel :vAún no hay calificaciones
- Ejercicios de TermodinámicaDocumento8 páginasEjercicios de TermodinámicaCristina AlvarezAún no hay calificaciones
- Problemas Propuestos para El Segundo ExamenDocumento5 páginasProblemas Propuestos para El Segundo ExamenVictor V IeAún no hay calificaciones
- CineticaDocumento4 páginasCineticaLupita Alavez100% (1)
- 08-Tema IVDocumento6 páginas08-Tema IVDani MestreAún no hay calificaciones
- CAP - 4 1era Ley de La TermodinamicaDocumento4 páginasCAP - 4 1era Ley de La TermodinamicaSteven B-Roen100% (1)
- TAREA CAP 20 Tarea 2da Ley de La TermodinámicaDocumento5 páginasTAREA CAP 20 Tarea 2da Ley de La TermodinámicaDanielAún no hay calificaciones
- Práctica de Termodinámica.Documento8 páginasPráctica de Termodinámica.ariadna mora sandiAún no hay calificaciones
- Hoja de Problemas #04Documento4 páginasHoja de Problemas #04Paul Quiroz AliagaAún no hay calificaciones
- 9 TermodinamicaDocumento14 páginas9 TermodinamicaStephy ValenciaAún no hay calificaciones
- Taller 8. 1 LeyDocumento4 páginasTaller 8. 1 LeyJEAN CAMILO PORRAS RICOAún no hay calificaciones
- Taller de Termodinamica Samuel Ortega y Gabriel MirandaDocumento16 páginasTaller de Termodinamica Samuel Ortega y Gabriel MirandaGabriel MirandaAún no hay calificaciones
- Factores de Conversion de UnidadesDocumento6 páginasFactores de Conversion de UnidadesMel LunaAún no hay calificaciones
- 006629420Documento4 páginas006629420Jesús JacksonAún no hay calificaciones
- Intercambiadores de CalorDocumento6 páginasIntercambiadores de CalorLauraGaleanoAún no hay calificaciones
- Hornos Solares RotativosDocumento9 páginasHornos Solares RotativosDaniel Carlos Vidal DíazAún no hay calificaciones
- Fis 08Documento9 páginasFis 08Misho Felino GarciaAún no hay calificaciones
- Muro TrombeDocumento18 páginasMuro TrombeJoseph Acosta ChaponanAún no hay calificaciones
- Intercambiador de CalorDocumento32 páginasIntercambiador de CalorFernando CaveroAún no hay calificaciones
- Calor de VaporizacionDocumento4 páginasCalor de VaporizacionAngel CruzAún no hay calificaciones
- Sesión N°4 - Ct2º Calor y TemperaturaDocumento5 páginasSesión N°4 - Ct2º Calor y TemperaturaIsa GRAún no hay calificaciones
- Pia Termodinamica de Gases y VaporesDocumento7 páginasPia Termodinamica de Gases y VaporesJorge AlbertoAún no hay calificaciones
- Ceramic ADocumento262 páginasCeramic AingrossAún no hay calificaciones
- Cuestionario 2PDocumento11 páginasCuestionario 2PDarwin Stalin Alcaciega PilcoAún no hay calificaciones
- Pre 4Documento6 páginasPre 4Dulce ContrerasAún no hay calificaciones
- Trabajo de FísicaDocumento2 páginasTrabajo de FísicaDairy Chaparro VillamizarAún no hay calificaciones
- Yecid Gonzalez - Cinecia y EnergíaDocumento5 páginasYecid Gonzalez - Cinecia y EnergíayecidAún no hay calificaciones
- Refrigerante R290Documento6 páginasRefrigerante R290LUIS BELTRANAún no hay calificaciones
- Combustion in SituDocumento19 páginasCombustion in SituIbeth ..Aún no hay calificaciones
- NTP - 302 Reactividad Quimica PDFDocumento10 páginasNTP - 302 Reactividad Quimica PDFmayli niviaAún no hay calificaciones
- Practica 4. Calor Latente de Vaporización y FusiónDocumento2 páginasPractica 4. Calor Latente de Vaporización y FusiónDiego Tuiran RuizAún no hay calificaciones
- Mapa Conceptual Solidos y LiquidosDocumento1 páginaMapa Conceptual Solidos y LiquidosORIANA RAMIREZAún no hay calificaciones
- 1-CyCC-17825-SEP-Tema 2.2Documento16 páginas1-CyCC-17825-SEP-Tema 2.2Magdalena Hernández AguilarAún no hay calificaciones
- UTES 30789a.v1Documento12 páginasUTES 30789a.v1Elton Lomboni100% (2)
- Ramon Fuentes, Física en Procesos Industriales 6Documento4 páginasRamon Fuentes, Física en Procesos Industriales 6Pablo GonzalesAún no hay calificaciones
- Riesgos Asociados Al Ambiente de Trabajo y A Las Condiciones de SeguridadDocumento17 páginasRiesgos Asociados Al Ambiente de Trabajo y A Las Condiciones de SeguridadTony Blas CristobalAún no hay calificaciones
- La Electricidad y La Electrónica en La IngenieríaDocumento15 páginasLa Electricidad y La Electrónica en La IngenieríaGIANELLA ALESSANDRA RONCAL MAROCHO100% (1)
- Exposición 1. Proceso de Colada ContinuaDocumento39 páginasExposición 1. Proceso de Colada ContinuaCatalina Madriz Masís0% (1)
- La Luz en La Obra de César ManriqueDocumento38 páginasLa Luz en La Obra de César ManriqueLaura PiñeroAún no hay calificaciones
- Informe de CalorímetriaDocumento15 páginasInforme de CalorímetriaChelsea Sánchez100% (1)
- Comprendemos Los Problemas Que Generan Las Heladas y El Friaje en Nuestro PaísDocumento4 páginasComprendemos Los Problemas Que Generan Las Heladas y El Friaje en Nuestro PaísMatias CM50% (2)
- Ciclo Diésel y Ciclo OttoDocumento5 páginasCiclo Diésel y Ciclo OttoJhon Frederyck Daza OlayaAún no hay calificaciones
- Sistemas para El Calentamiento y Enfriamiento de Productos AlimentariosDocumento7 páginasSistemas para El Calentamiento y Enfriamiento de Productos AlimentariosCamilita Mishelle MierAún no hay calificaciones
- Calderas ResumenDocumento14 páginasCalderas ResumenMauricio FernándezAún no hay calificaciones
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (201)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Trucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasDe EverandTrucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizDe EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizCalificación: 5 de 5 estrellas5/5 (7)
- Proyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadDe EverandProyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadCalificación: 5 de 5 estrellas5/5 (1)
- Manual técnico para la interpretación de análisis de suelos y fertilización de cultivosDe EverandManual técnico para la interpretación de análisis de suelos y fertilización de cultivosCalificación: 4 de 5 estrellas4/5 (1)
- Guía de cálculo y diseño de conductos para ventilación y climatizaciónDe EverandGuía de cálculo y diseño de conductos para ventilación y climatizaciónCalificación: 5 de 5 estrellas5/5 (1)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Prescripción de ejercico físico para la saludDe EverandPrescripción de ejercico físico para la saludCalificación: 5 de 5 estrellas5/5 (1)
- La causa raiz de los accidentes: Historias de accidentes en la industriaDe EverandLa causa raiz de los accidentes: Historias de accidentes en la industriaCalificación: 5 de 5 estrellas5/5 (1)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)