Documentos de Académico
Documentos de Profesional
Documentos de Cultura
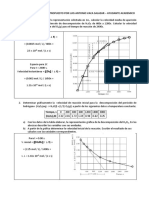
Ejercicios TERMOQUÍMICA
Cargado por
gabrieleo nuñez armasDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Ejercicios TERMOQUÍMICA
Cargado por
gabrieleo nuñez armasCopyright:
Formatos disponibles
TERMOQUÍMICA-2020-1
1. ¿Qué combustible produce, a 25oC, más energía por kilogramo, alcohol (C2H5OH(l)) o propano
(C3H8(g))? Justifique con reacciones químicas y cálculos
Datos de peso molecular (uma): C2H5OH = 46 C3H8 = 44
Datos de entalpía de formación a 25 oC (kJ/mol)
C2H5OH(l) = -277,7 C3H8(g) = -103,8 CO2(g) = -393,5 H2O(l ) = -285,8
2. La reacción de combustión completa del ácido acético gaseoso, en condiciones estándard, es:
CH3COOH (g) + 2O2 (g) ↔ 2CO2 (g) + 2H2O (l) ∆H = -875,1 KJ/mol
a) Calcular la entalpía molar estándar de formación del ácido acético, empleando
como datos (2p) (∆H0f)CO2(g) = -394 KJ/mol y (∆H0f)H2O(l) = -285 KJ/mol
b) A partir de 1000mL de una solución de ácido acético al 70%p/v ¿cuántos kJ se desprenderían?
PM= 60.
3. El sulfuro de cinc al tratarlo con oxígeno reacciona según:
2 ZnS(s) + 3 O2(g) 2 ZnO(s) + 2 SO2(g)
Si las entalpías de formación de las diferentes especies expresadas en kJ/mol son:
(ZnS) = -184,1; (SO2) = -70,9; (ZnO) = -349,3
a) ¿Cuál será el calor, a presión constante de una atmósfera, que se desprenderá cuando
reaccionen 17 gramos de sulfuro de cinc con exceso de oxígeno?
b) ¿Cuántos litros de SO2, medidos a 25 ºC y una atmósfera, se obtendrán?
Datos: R= 0,082 atm L K-1 mol-1. Masas atómicas: O = 16; S = 32; Zn = 65,4.
4. La reacción entre la hidracina (N2H4) y el peróxido de hidrógeno (H2O2) se utiliza para la
propulsión de cohetes:
N2H4(l) + 2 H2O2(l) N2(g) + 4 H2O(l) ΔH = -710 kJ
Las entalpías de formación de H2O2(l) y del H2O(l) son -187,8 kJ/mol y -285,5 kJ/mol,
respectivamente.
a) Calcule la entalpía de formación de la hidracina.
b) ¿Qué volumen de nitrógeno, medido a 10 ºC y 50 mm de mercurio, se producirá cuando
reaccionen 64 g de hidracina?
Datos: R = 0,082 atm·L·K‾1·mol‾1. Masas atómicas: H = 1; N = 14; O
5. Uno de los alimentos más consumido es la sacarosa C 12H22O11. Cuando reacciona con el oxígeno
se transforma en dióxido de carbono y agua desprendiendo 348,9 kJ/mol, a la presión de una
atmósfera. El torrente sanguíneo absorbe, por término medio 26 moles de O 2 en 24 horas. Con
esta cantidad de oxígeno:
a) ¿Cuántos gramos de sacarosa se pueden quemar al día?
b) ¿Cuántos kJ se producirán en la combustión?
Masas atómicas: H = 1; C = 12; O = 16
6. Dadas las ecuaciones termoquímicas siguientes:
C (s) + O2 (g) ® CO2 (g) ∆Hº = −393’5 kJ
H2 (g) + O2 (g) ® H2O(l) ∆Hº = −285’8 kJ
CH3COOH (l) + 2O2 (g) ® 2CO2 (g) + 2H2O (l) ∆Hº = −870’3 kJ
Calcule:
a) La entalpía estándar de formación del ácido acético.
b) La cantidad de calor, a presión constante, desprendido en la combustión de 1 kg de
este ácido.
Masas atómicas: C = 12; O =16; H = 1.
También podría gustarte
- Desinfectantes SANOSILDocumento2 páginasDesinfectantes SANOSILLilian PamelaAún no hay calificaciones
- ColorimetriaDocumento9 páginasColorimetriaKelly BartonAún no hay calificaciones
- Informe 2. de Analitica Instrumental 1Documento20 páginasInforme 2. de Analitica Instrumental 1Lina Mendoza Baldeon78% (9)
- Usos de Agua Oxigenada en La AgriculturaDocumento11 páginasUsos de Agua Oxigenada en La AgriculturaJoElizabeth Santana Naranjo100% (1)
- QuimicaDocumento19 páginasQuimicaJosue Antoni Encinas MolloAún no hay calificaciones
- Blanqueo ATCP 2015Documento200 páginasBlanqueo ATCP 2015Catherinne Edilia Navarrete Astorga100% (2)
- Cultivo de Bacterias AnaerobiasDocumento10 páginasCultivo de Bacterias Anaerobiasf8a0cAún no hay calificaciones
- Procesos de Oxidación Avanzada (POAs)Documento8 páginasProcesos de Oxidación Avanzada (POAs)Jaxin ValdovinosAún no hay calificaciones
- Taller de DisolucionesDocumento3 páginasTaller de DisolucionesAndrea GomezAún no hay calificaciones
- Practica de Accion EnzimaticaDocumento8 páginasPractica de Accion EnzimaticajorgeAún no hay calificaciones
- Prueba de La CatalasaDocumento4 páginasPrueba de La CatalasaJoel H. Perez100% (2)
- 1749 Digest DahlDocumento6 páginas1749 Digest DahlLuis RodriguezAún no hay calificaciones
- Bromacion de CiclohexanoDocumento7 páginasBromacion de CiclohexanoConstanzaPérezMoralesAún no hay calificaciones
- CONTROL 3.eval Quim 2º Bac 2011Documento5 páginasCONTROL 3.eval Quim 2º Bac 2011carmenjimenez2543Aún no hay calificaciones
- Defectos en Productos Cárnicos Procesados EscaldadosDocumento2 páginasDefectos en Productos Cárnicos Procesados Escaldadoskevin dicelis torresAún no hay calificaciones
- CPSAA - Plan para La Vigilancia, Prevención y Control de Covid-19 en El TrabajoDocumento86 páginasCPSAA - Plan para La Vigilancia, Prevención y Control de Covid-19 en El TrabajoYanina S JCAún no hay calificaciones
- Informe 1 QuimicaDocumento5 páginasInforme 1 QuimicaPablo Joaquín Argoti SilvaAún no hay calificaciones
- Informe de EnzimasDocumento14 páginasInforme de EnzimasDanna Lopez100% (1)
- Informe EnzimasDocumento10 páginasInforme EnzimasMildred OrtegateAún no hay calificaciones
- Open Lab Pasta de ElefanteDocumento3 páginasOpen Lab Pasta de ElefanteMemo CuellarAún no hay calificaciones
- Cinetica Quimica Resueltos PDFDocumento4 páginasCinetica Quimica Resueltos PDFJorge Pibaque100% (1)
- Demostración de La Naturaleza Proteica de La Enzima Catalasa en Vegetales 1Documento7 páginasDemostración de La Naturaleza Proteica de La Enzima Catalasa en Vegetales 1luis PomaAún no hay calificaciones
- Propuesta de Proyecto QuimicaDocumento8 páginasPropuesta de Proyecto QuimicaDarleenAún no hay calificaciones
- Agentes Oxidantes y ReductoresDocumento15 páginasAgentes Oxidantes y ReductoresJose CamposAún no hay calificaciones
- Practica Bioquímica CatalasaDocumento9 páginasPractica Bioquímica CatalasaPedro ManceraAún no hay calificaciones
- 07 TPN7Documento15 páginas07 TPN7celeste diviAún no hay calificaciones
- Bioquimica EspirulinaDocumento241 páginasBioquimica EspirulinaMarianela Balderrama PeñarandaAún no hay calificaciones
- Las EnzimasDocumento7 páginasLas Enzimaserika lesmesAún no hay calificaciones
- Manual de EsterilizaciónDocumento24 páginasManual de EsterilizaciónJessy AlfaroAún no hay calificaciones
- Index 5Documento11 páginasIndex 5Claudia GonzalesAún no hay calificaciones