Documentos de Académico
Documentos de Profesional
Documentos de Cultura
U3 Eje 4.2 Act. 3
Cargado por
Calderas Rivera Jenifer ZamaraTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
U3 Eje 4.2 Act. 3
Cargado por
Calderas Rivera Jenifer ZamaraCopyright:
Formatos disponibles
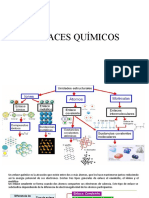
La regla de octeto
La regla de octeto, enunciado en 1916 por Walter kossel, dice que la tendencia de los iones de los
elementos del sistema periódico es completar sus últimos niveles de energía con una cantidad de 8
iones que tiene carga negativa, es decir electrones, de tal forma que adquiere una configuración
muy estable.
La estructura de Lewis
La estructura de Lewis, también llamada diagrama de punto y raya diagonal, modelo de Lewis,
diagrama de valencia o regla de octeto, es una representación gráfica que muestra los pares de
electrones en guiones o puntos de enlaces entre los átomos de una molécula y los pares de
electrones solitarios que puedan existir.
¿Que son los electrones de valencia?
Los electrones de valencia son los electrones que se encuentran en el nivel principal más alto del
átomo, siendo estos los responsables de la interacción entre átomos de distintas especies o entre los
átomos de una misma. Los electrones en los niveles de energía externos son aquellos que serán
utilizados en la formación de compuestos y a los cuales se les denomina como electrones de valencia.
Estos electrones, conocidos como "electrones de valencia", son los que presentan la facilidad de formar
enlaces.
¿Qué es un enlace?
Cosa que relaciona o une dos o más cosas o elementos.
¿Qué es un enlace químico?
Un enlace químico es el proceso químico responsable de las interacciones atractivas entre átomos y
moléculas, y que confiere estabilidad a los compuestos químicos diatónicos y poli atómicos. La
explicación de tales fuerzas atractivas es un área compleja que está descrita por las leyes de la
química cuántica.
Una definición más sencilla es que un enlace químico es la fuerza existente entre los átomos una
vez que se ha formado un sistema estable
Enlace iónico
Un enlace iónico o electro Valente es el resultado de la presencia de atracción electrostática entre
los iones de distinto signo respecto a las valencias de los elementos y el número de electrones que
deben perder o ganar para completar las capas, es decir, uno fuertemente electropositivo y otro
fuertemente electronegativo. Eso se da cuando en el enlace, uno de los átomos capta electrones del
otro.
Para que un enlace iónico se genere es necesario que la diferencia (delta) de electronegatividades
sea mayor que 1,7 o igual.
Enlace covalente
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el
"octeto estable¨, y comparten electrones del último nivel. La diferencia de electronegatividad entre
los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica.
Para que un enlace covalente se genere es necesario que la diferencia de electronegatividad entre
átomos sea menor a 1,7
Enlace covalente polar
En general, cuando se unen dos átomos no metálicos diferentes, los electrones se comparten en
forma desigual. Un enlace covalente en el que los electrones se comparten desigualmente se
denomina enlace covalente polar.
Enlace covalente no polar
Se forma entre átomos iguales y la diferencia de electronegatividad debe ser cero o muy pequeña (menor
que 0,8). En este enlace, los electrones son atraídos por ambos núcleos con la misma intensidad,
generando moléculas cuya nube electrónica es uniforme.
Enlace metálico
Un enlace metálico es un enlace químico que mantiene unidos los átomos (Unión entre núcleos
atómicos y los electrones de valencia, que se juntan alrededor de estos como una nube) de
los metales entre sí.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas.
Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento
compacto de esferas. (Hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el
cuerpo.
En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos
También podría gustarte
- Símbolo y Estructura de LewisDocumento11 páginasSímbolo y Estructura de LewisHuchin Amores Leticia100% (1)
- Enlace Quimico ModuloDocumento3 páginasEnlace Quimico ModuloJairo Nelson QuiñonezAún no hay calificaciones
- Taller QuimicaDocumento18 páginasTaller Quimicaisako hatakeAún no hay calificaciones
- Qué EsDocumento2 páginasQué Esfabianaguilar1219Aún no hay calificaciones
- Enlaces Químicos GlosarioDocumento2 páginasEnlaces Químicos GlosariojaviAún no hay calificaciones
- Papa MineriaDocumento5 páginasPapa MineriaSasha CastañedaAún no hay calificaciones
- Enlaces químicos: tipos, representación y regla del octetoDocumento8 páginasEnlaces químicos: tipos, representación y regla del octetoCRISTOFER EMILIANO CALVILLO GARCIAAún no hay calificaciones
- Unidad 3. Enlace QuímicoDocumento117 páginasUnidad 3. Enlace QuímicoXhuxhii D GivesAún no hay calificaciones
- Unidad 2 Compuestos 2doDocumento9 páginasUnidad 2 Compuestos 2doJuan Carlos LucianoAún no hay calificaciones
- Investigacion Previa.5Documento16 páginasInvestigacion Previa.5Gina Cabrera EspinosaAún no hay calificaciones
- Enlaces Quimicos DE BIOQUIMICADocumento8 páginasEnlaces Quimicos DE BIOQUIMICADMCTAún no hay calificaciones
- Enlaces Químicos: Tipos, Características y Estructura de LewisDocumento5 páginasEnlaces Químicos: Tipos, Características y Estructura de LewisLina Rosa MorenoAún no hay calificaciones
- Clasificacion de Los Enlaces QuimicosDocumento6 páginasClasificacion de Los Enlaces QuimicosJeremy AlvarezAún no hay calificaciones
- Enlaces QuímicosDocumento13 páginasEnlaces QuímicosJhoel René Mamani HuancaAún no hay calificaciones
- Es La Fuerza Existente Dos o Más Átomos Que Los Mantienen Unidos en Las MoléculasDocumento2 páginasEs La Fuerza Existente Dos o Más Átomos Que Los Mantienen Unidos en Las MoléculasUriel A DavalosAún no hay calificaciones
- enlacesquimicosDocumento4 páginasenlacesquimicosHolaAún no hay calificaciones
- Enlaces químicos y fuerzas intermolecularesDocumento28 páginasEnlaces químicos y fuerzas intermolecularesEDUCAMOS BarillasAún no hay calificaciones
- Quimica ExpoDocumento18 páginasQuimica ExpoJorge Alexander Aguilar CastilloAún no hay calificaciones
- Enlace CovalenteDocumento3 páginasEnlace CovalenteNoyola IsabelAún no hay calificaciones
- Enlace Químico y sus ClasesDocumento6 páginasEnlace Químico y sus ClasesEnrique FrikaDas Las JusTas0% (2)
- Enlace Ionico Se Da Entre Un Metal I Un No MetalDocumento3 páginasEnlace Ionico Se Da Entre Un Metal I Un No MetalLuizitho Benitez0% (2)
- Enlaces Químicos ExpoDocumento15 páginasEnlaces Químicos Expogabby_01100% (1)
- Trabajo de Quimica, Enlace QuimicoDocumento11 páginasTrabajo de Quimica, Enlace QuimicoAna MartinezAún no hay calificaciones
- naturaleza del enlace quimicoDocumento5 páginasnaturaleza del enlace quimicohermelys lunaAún no hay calificaciones
- Quimica D1Documento2 páginasQuimica D1Fabricio ValdezAún no hay calificaciones
- ElectronegatividadDocumento5 páginasElectronegatividadYeritzon VeraAún no hay calificaciones
- 1b-Clases de Enlaces Quimicos - 1a - 3 - 2024Documento19 páginas1b-Clases de Enlaces Quimicos - 1a - 3 - 2024vilma tuctaguanoAún no hay calificaciones
- Resumen de Enlace Químico 1Documento9 páginasResumen de Enlace Químico 1SRL FotografíaAún no hay calificaciones
- Unión AtómicaDocumento1 páginaUnión AtómicaCristhian VargasAún no hay calificaciones
- Prueba de EnsayoDocumento2 páginasPrueba de EnsayoOLIVER JESUS MAZABA RIVASAún no hay calificaciones
- Comprendiendo Los Enlaces QuímicosDocumento5 páginasComprendiendo Los Enlaces QuímicosMía MariñezAún no hay calificaciones
- Trabajo Fisica y Quimica IntermolecularDocumento27 páginasTrabajo Fisica y Quimica IntermolecularFernando M. TorresAún no hay calificaciones
- Lectura EnlacesDocumento4 páginasLectura EnlacesMario OG100% (1)
- Enlaces iónico y covalenteDocumento13 páginasEnlaces iónico y covalenteDavid Conza TorresAún no hay calificaciones
- Enlace QuimicoDocumento14 páginasEnlace QuimicoYesenia SCAún no hay calificaciones
- Enlaces QuimicosDocumento50 páginasEnlaces QuimicosMario BlasAún no hay calificaciones
- Que Se Entiende Por Enlace QuimicoDocumento4 páginasQue Se Entiende Por Enlace Quimicojavier271295100% (1)
- Tipos de enlaces químicos: metálico, iónico, covalente polar y no polarDocumento4 páginasTipos de enlaces químicos: metálico, iónico, covalente polar y no polarDesInc Colectivo de DiseñoAún no hay calificaciones
- Definiciones de términos químicosDocumento7 páginasDefiniciones de términos químicosbrenda lopezAún no hay calificaciones
- Enlaces Quimicos y El Estado Solido CristalinoDocumento42 páginasEnlaces Quimicos y El Estado Solido CristalinoYeshua Del Valle ZapataAún no hay calificaciones
- Elance y Valencia y CovalenteDocumento6 páginasElance y Valencia y CovalenteAriel CQAún no hay calificaciones
- EnlaceDocumento11 páginasEnlaceSTEPHANIE HERNANDEZ GARCIAAún no hay calificaciones
- Enlace CovalenteDocumento7 páginasEnlace CovalenteObed GarciaAún no hay calificaciones
- Enlaces QuímicosDocumento25 páginasEnlaces QuímicosJ Alberto GarcésAún no hay calificaciones
- resumen enlacesDocumento1 páginaresumen enlacesRomina Ameluz GarciaAún no hay calificaciones
- Cueva Perez Informe 3 Química GeneralDocumento17 páginasCueva Perez Informe 3 Química GeneralEduardo Cueva PérezAún no hay calificaciones
- Qué Es Un Enlace QuímicoDocumento3 páginasQué Es Un Enlace QuímicoNatalia campo ramirezAún no hay calificaciones
- Enlaces QuimicoDocumento22 páginasEnlaces Quimicomandrake1233Aún no hay calificaciones
- Enlace QuimicoDocumento6 páginasEnlace QuimicoGustavo Moya AtahuichiAún no hay calificaciones
- Enlace QuimicoDocumento19 páginasEnlace QuimicoRenzo Augusto Mamani CherresAún no hay calificaciones
- Enlace CovalenteDocumento2 páginasEnlace CovalenteSantiago GarridoAún no hay calificaciones
- AtomoDocumento18 páginasAtomoPABLO DIAZ ENRIQUEZAún no hay calificaciones
- Enlace Quimico Ionico, Covalente y MetalicoDocumento35 páginasEnlace Quimico Ionico, Covalente y MetalicoMagdalena AvilaAún no hay calificaciones
- QuimicaaaaaDocumento17 páginasQuimicaaaaajjsoiAún no hay calificaciones
- ENLACE QUIMICOsDocumento35 páginasENLACE QUIMICOsCarmen Maria SolisAún no hay calificaciones
- Uniones QuimicasDocumento11 páginasUniones QuimicasRosario Lopez MirandaAún no hay calificaciones
- Unidad 2Documento21 páginasUnidad 2Pedro Wongster0% (1)
- Enlaces Quimicos - Guzman Morales Deysi EmelyDocumento4 páginasEnlaces Quimicos - Guzman Morales Deysi Emelyemely guzmanAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- UntitledDocumento1 páginaUntitledCalderas Rivera Jenifer ZamaraAún no hay calificaciones
- Solicitud de crédito de $240,000 MXN para negocio de tortilleríaDocumento1 páginaSolicitud de crédito de $240,000 MXN para negocio de tortilleríaCalderas Rivera Jenifer ZamaraAún no hay calificaciones
- U3 Eje 5 Act. 6Documento16 páginasU3 Eje 5 Act. 6Calderas Rivera Jenifer ZamaraAún no hay calificaciones
- Linea Del Tempo de Modelos AtomicosDocumento7 páginasLinea Del Tempo de Modelos AtomicosCalderas Rivera Jenifer ZamaraAún no hay calificaciones
- Distintas Maneras de AprenderDocumento2 páginasDistintas Maneras de AprenderCalderas Rivera Jenifer ZamaraAún no hay calificaciones
- Solicitud de crédito de $240,000 MXN para negocio de tortilleríaDocumento1 páginaSolicitud de crédito de $240,000 MXN para negocio de tortilleríaCalderas Rivera Jenifer ZamaraAún no hay calificaciones
- Cuestionario. - Carga FormalDocumento8 páginasCuestionario. - Carga FormalMaría GuadalupeAún no hay calificaciones
- Modelo Lewis2Documento5 páginasModelo Lewis2David MtaAún no hay calificaciones
- Q02 Sistemaperiódico PRINTDocumento20 páginasQ02 Sistemaperiódico PRINTIvan G LemosAún no hay calificaciones
- Ejercicios de Enlaces IonicosDocumento3 páginasEjercicios de Enlaces IonicosJulio jose More RebolledoAún no hay calificaciones
- Repartido Geometría MolecularDocumento3 páginasRepartido Geometría MolecularStephanie BalcedoAún no hay calificaciones
- 2do Bimestre - Parte 1Documento18 páginas2do Bimestre - Parte 1Enrique Baca D.Aún no hay calificaciones
- Modulo1 Enlace Quimico UnalDocumento54 páginasModulo1 Enlace Quimico UnalKatherine DominguezAún no hay calificaciones
- Enlace CovalenteDocumento3 páginasEnlace CovalenteNoyola IsabelAún no hay calificaciones
- Ensayo de La Estructura de LewisDocumento6 páginasEnsayo de La Estructura de Lewisjorge masacheAún no hay calificaciones
- Estructura de LewisDocumento4 páginasEstructura de LewisCataleya MoreAún no hay calificaciones
- ElectronegatividadDocumento2 páginasElectronegatividadMelissa HuertaAún no hay calificaciones
- Materiales EstructuraDocumento7 páginasMateriales EstructuraKevin AguirreAún no hay calificaciones
- Preguntas - Coordinacion 2014Documento4 páginasPreguntas - Coordinacion 2014Luciana RodriguezAún no hay calificaciones
- Hibridacion de CarbonoDocumento30 páginasHibridacion de CarbonoEliana MejiaAún no hay calificaciones
- Problemas Tema 8Documento2 páginasProblemas Tema 8Dani HernándezAún no hay calificaciones
- Enlaces QuimicosDocumento5 páginasEnlaces QuimicosBárbara MHAún no hay calificaciones
- Química 1. Schunke Uniones Quimicas 4toDocumento8 páginasQuímica 1. Schunke Uniones Quimicas 4toAlejandro Nicolas SchunkeAún no hay calificaciones
- Serie 3 CompletaDocumento27 páginasSerie 3 CompletaArzola Bortolini Regina LilianaAún no hay calificaciones
- Estructura Molecular: Enlace Químico, Geometría y Teorías de EnlaceDocumento14 páginasEstructura Molecular: Enlace Químico, Geometría y Teorías de EnlaceJavier LosadaAún no hay calificaciones
- HibridacionDocumento9 páginasHibridacionADRIANA PAOLA MACEA HOYOSAún no hay calificaciones
- Enlaces Químicos (Artículo) - Khan AcademyDocumento14 páginasEnlaces Químicos (Artículo) - Khan AcademysilvermistAún no hay calificaciones
- Guía 4 de Química Grado 10°Documento5 páginasGuía 4 de Química Grado 10°Nini Johana OspinaAún no hay calificaciones
- Problemas Captitulo 9-ChangDocumento10 páginasProblemas Captitulo 9-ChangRocio Mercedes GonzálezAún no hay calificaciones
- Aplicaciones Regla Del OctetoDocumento2 páginasAplicaciones Regla Del OctetoAlberto Hernandez PalmaAún no hay calificaciones
- Enlaces químicos UPC ChiapasDocumento15 páginasEnlaces químicos UPC ChiapasMoisesito EspinozaAún no hay calificaciones
- Práct. 04 - QuímicaDocumento13 páginasPráct. 04 - QuímicaRodrigo Artemio Quispe Castro100% (1)
- 02 - Enlace Covalente3Documento32 páginas02 - Enlace Covalente3Juana Quesada MorenoAún no hay calificaciones
- TABLA PERIODICA ExpoDocumento21 páginasTABLA PERIODICA ExpoAmérika Lin AmazonasAún no hay calificaciones
- Enlace y Geometría MolecularDocumento91 páginasEnlace y Geometría MolecularmsryAún no hay calificaciones
- Reglas de ResonanciaDocumento4 páginasReglas de ResonanciaLuz Fuentes ArayaAún no hay calificaciones