Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Mapa - Gases Ideales
Cargado por
Daniela Avila AcostaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Mapa - Gases Ideales
Cargado por
Daniela Avila AcostaCopyright:
Formatos disponibles
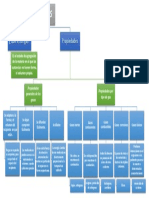
PV=nRT Es la relación entre cantidad de vapor de agua
contenida en el aire (humedad absoluta) y la
máxima cantidad que el aire sería capaz de
contener a esa temperatura (humedad
absoluta de saturación)
Ecuación de los gases HR= Pv/Pvs * 100%
ideales Está compuesto por fermiones, que son otro tipo de
partículas elementales. Ejemplo: los electrones, que
Humedad relativa
son una de las partículas que constituyen los
átomos. Son un tipo de fermion.
La fracción molar es una unidad
Valores de la constante
química que se usa para expresar la
concentración de un soluto en una
Gas ideal cuántico de
disolución.
Fermi
Fracció Mol
Está compuesto por bosones, que son un tipo de
partículas elementales. Ejemplo: Los fotobes que son
partículas que portan radiación electromagnética
como la luz visible, son un tipo de boson.
Un mol de una sustancia es igual a
6.022 × 10²³ unidades de esa sustancia
(tal como átomos, moléculas, o iones)
Gases ideales Tipos de gases Gas ideal cuántico de
Mol ideales Bose
y humedad
relativa
Gas ideal termodinámico clásico o gas ideal cuántico,
dependiendo del enfoque físico aplicado en su
estudio.
Propiedades Gas ideal de Maxwell-
Boltzmann
•Poseen siempre un mismo número de moléculas
• No tienen fuerza de atracción o repulsión entre Ley de los gases ideales
sus moléculas
• No pueden experimentar transición de fase (gas-
liquido, gas-solido)
• Las moléculas de gas ideal ocupan siempre el
mismo volumen a las mismas condiciones de
presión y temperatura.
Ley de Boyle Ley de Charles Ley de Gay Lussac Ley de Avogadro Ley combinada de
Volúmenes iguales de todos los gases
los gases
Si el volumen de un gas no cambia mientras medidos a las mismas condiciones de
El volumen de la masa fija de un gas es lo calentamos, la presión del gas aumenta en temperatura y presión, contienen el mismo
El volumen es directamente proporcional a la
directamente proporcional a la temperatura la misma proporción en que se incrementa la número de moléculas.
presión del gas a temperatura constante.
Kelvin. temperatura.
Dependencia del V de una masa del gas
respectó a la P y T.
V1*n2=V2*n1, 1 Mol posee 6,02*1023
moléculas bajo condiciones normales.
V1*P1=V2*P2 V1*T2=V2*T1 P1*T2=P2*T1
También podría gustarte
- QuímicaDocumento5 páginasQuímicas7m46m6vdkAún no hay calificaciones
- FermiónDocumento2 páginasFermiónricva_rjAún no hay calificaciones
- Mapa MentalDocumento1 páginaMapa MentalElizabeth TorresAún no hay calificaciones
- Compuestos OrganicosDocumento1 páginaCompuestos OrganicosMonSorinAún no hay calificaciones
- Taller - Masa AtómicaDocumento2 páginasTaller - Masa AtómicaDaniela0601100% (1)
- Taller - Masa AtómicaDocumento2 páginasTaller - Masa AtómicaJAIME SANABRIA CAMACHOAún no hay calificaciones
- PresentaciónDocumento6 páginasPresentaciónRamses HernándezAún no hay calificaciones
- FermiónDocumento2 páginasFermiónFederico PrietoAún no hay calificaciones
- Quimica Unidad5Documento41 páginasQuimica Unidad5Laura Flor García EPAún no hay calificaciones
- Actividad MateriaDocumento1 páginaActividad Materiarous tomas solanoAún no hay calificaciones
- FermiónDocumento2 páginasFermiónlipgarAún no hay calificaciones
- Arias Caceres Byron Sebastian - Tarea Semana #2Documento9 páginasArias Caceres Byron Sebastian - Tarea Semana #2Sebastian AriasAún no hay calificaciones
- Los Gases - Mapa Conceptual Fisica IiDocumento1 páginaLos Gases - Mapa Conceptual Fisica IiJuan PeñaAún no hay calificaciones
- FermiónDocumento4 páginasFermiónyonnsalAún no hay calificaciones
- Tarea 3.3 Mozo.DDocumento11 páginasTarea 3.3 Mozo.DDayana MozoAún no hay calificaciones
- Actividad 2 Mapa Mental Gases Ideales Jesus ComasDocumento1 páginaActividad 2 Mapa Mental Gases Ideales Jesus ComasJesús Miguel Comas AlvaradoAún no hay calificaciones
- Clasificación de La MateriaDocumento1 páginaClasificación de La MateriaAlexander ConcepcionAún no hay calificaciones
- Presentación 1Documento1 páginaPresentación 1deurimarAún no hay calificaciones
- Poster Higgs 2014Documento1 páginaPoster Higgs 2014Helena Torres Acosta100% (1)
- Haga Un Mapa Conceptual de Química Orgánica de Las Páginas 144 Al 153 Del Libro Virtual de Ciencia Y TecnologíaDocumento3 páginasHaga Un Mapa Conceptual de Química Orgánica de Las Páginas 144 Al 153 Del Libro Virtual de Ciencia Y Tecnologíayeremi fabricio lluen medinaAún no hay calificaciones
- Diagrama en BlancoDocumento1 páginaDiagrama en BlancoJOSE LUIS DEL CASTILLO MARTINEZAún no hay calificaciones
- HistorietaDocumento1 páginaHistorietaDainer BravoAún no hay calificaciones
- Anexo 1 - Tarea 1 (1) 5 Evolucion Teoria AtomicaestructuraDocumento15 páginasAnexo 1 - Tarea 1 (1) 5 Evolucion Teoria Atomicaestructurajorge andres gonzalezAún no hay calificaciones
- Anexo 1 - Tarea 1 (1) 5 Evolucion Teoria AtomicaestructuraDocumento19 páginasAnexo 1 - Tarea 1 (1) 5 Evolucion Teoria Atomicaestructurajorge andres gonzalezAún no hay calificaciones
- UD 3 Enlace IonicoDocumento10 páginasUD 3 Enlace IonicoparatonteriasycosasAún no hay calificaciones
- UNIDAD 3 A - Material de Estudio - QuímicaDocumento12 páginasUNIDAD 3 A - Material de Estudio - QuímicaEmanuel CorradiAún no hay calificaciones
- Esquema de La MateriaDocumento2 páginasEsquema de La MateriaVeronica DenisAún no hay calificaciones
- INFOGRAFIA DE ESTEQUIOMETRIA - CopDocumento1 páginaINFOGRAFIA DE ESTEQUIOMETRIA - CopjoseAún no hay calificaciones
- Tarea 2 - Grupo 401582 - 74Documento29 páginasTarea 2 - Grupo 401582 - 74Daniel CelinAún no hay calificaciones
- Cuadro Comparativo Propiedades FisicasDocumento2 páginasCuadro Comparativo Propiedades FisicasKen Lee Turizo PirelaAún no hay calificaciones
- Minimalist Story Mind MapDocumento1 páginaMinimalist Story Mind MapBrenda Paola Sanchez RodriguezAún no hay calificaciones
- Anexo 1 - Luisa HDocumento15 páginasAnexo 1 - Luisa Hadriana GuerraAún no hay calificaciones
- INFOGRAFÍADocumento1 páginaINFOGRAFÍANaileti100% (2)
- Enlace QuimicoDocumento1 páginaEnlace QuimicoJONATHAN SEBASTIAN MENDIETA RAMIREZAún no hay calificaciones
- Mapa Conceptual Atomo de CarbonoDocumento1 páginaMapa Conceptual Atomo de Carbono2328190Aún no hay calificaciones
- Tarea 3.3 Mozo.DDocumento11 páginasTarea 3.3 Mozo.DDayana MozoAún no hay calificaciones
- Capitulo 1 Ciencia de Tecnologia de Los MaterialesDocumento14 páginasCapitulo 1 Ciencia de Tecnologia de Los MaterialesReyser TarquiAún no hay calificaciones
- IV Bimestre-QUÍMICA-3RO-SECUNDARIADocumento76 páginasIV Bimestre-QUÍMICA-3RO-SECUNDARIAMetade Marvel A ChAún no hay calificaciones
- Actividad Tema 2Documento4 páginasActividad Tema 2Luis AlejandroAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa Conceptualjose ochoa67% (3)
- Infografia PDFDocumento1 páginaInfografia PDFEdwin GonzalezAún no hay calificaciones
- Oxidos E HidrurosDocumento3 páginasOxidos E HidrurosMarco Cabrera QuijanoAún no hay calificaciones
- Tabla Quimica 2023Documento3 páginasTabla Quimica 2023Nerea Macias DominguezAún no hay calificaciones
- 3 - Teoria Atomica Mapa ConceptualDocumento1 página3 - Teoria Atomica Mapa ConceptualKaren Ontiveros43% (7)
- Mapa Conceptual Propiedades de Los GasesDocumento1 páginaMapa Conceptual Propiedades de Los Gaseslupitha9269% (13)
- Cuadro ComparativoDocumento8 páginasCuadro ComparativoLauygui PcAún no hay calificaciones
- Quimica .DrawioDocumento16 páginasQuimica .DrawioLizeth MarpadAún no hay calificaciones
- MezclasDocumento1 páginaMezclasDaniel Cruz BecerrilAún no hay calificaciones
- Glosario QuimicaDocumento4 páginasGlosario QuimicaYessica RangelAún no hay calificaciones
- Mapa Conceptual de Los Modelos Atomicos 3Documento1 páginaMapa Conceptual de Los Modelos Atomicos 3Soledad MateoAún no hay calificaciones
- Modelo AtomicoDocumento1 páginaModelo AtomicoFacundo TrocheAún no hay calificaciones
- Tarea 1 Jaime PinzonDocumento20 páginasTarea 1 Jaime PinzonjhonAún no hay calificaciones
- Cuadro Reflixivo Sobre El Modelo Atomico 207Documento4 páginasCuadro Reflixivo Sobre El Modelo Atomico 207Elizabeth Santana AbreuAún no hay calificaciones
- Actividades Tema - fq3 - t6 - A01-A16 PDFDocumento5 páginasActividades Tema - fq3 - t6 - A01-A16 PDFinfoparaclaseAún no hay calificaciones
- Laboratorio n5 de QuimicaDocumento7 páginasLaboratorio n5 de QuimicaEduardoAún no hay calificaciones
- Plan de Quìmica 4to AñoDocumento7 páginasPlan de Quìmica 4to AñoYelitza Veliz De AlvaradoAún no hay calificaciones
- Anexo 1 - Tarea 2 - EstructuraDocumento28 páginasAnexo 1 - Tarea 2 - EstructuraLauren Vanessa Guzman RomeroAún no hay calificaciones
- Cuadro Comparativo de Las Etapas de La FisicaDocumento4 páginasCuadro Comparativo de Las Etapas de La Fisica22690188Aún no hay calificaciones
- Universidad de CordobaDocumento5 páginasUniversidad de CordobaOrtega Martinez Johanitha100% (1)
- Formalismo de LagrangeDocumento12 páginasFormalismo de LagrangeCristin LeeAún no hay calificaciones
- Diagramas de Flujo de Flotación PDFDocumento12 páginasDiagramas de Flujo de Flotación PDFDanny joaquinAún no hay calificaciones
- Prac Capacidad CalorificaDocumento7 páginasPrac Capacidad CalorificaCarlos Erick De JesusAún no hay calificaciones
- Resolucion de Problemas de Tranferencia de MasaDocumento7 páginasResolucion de Problemas de Tranferencia de MasaJesus Gelder Zarate Castro67% (6)
- Punto de BurbujaDocumento19 páginasPunto de BurbujaAndy BeristainAún no hay calificaciones
- PAPER CIRCUITOS TRIFÁSICOS DESBALANCEADOS Practica 3Documento7 páginasPAPER CIRCUITOS TRIFÁSICOS DESBALANCEADOS Practica 3Bryan Steven RuizAún no hay calificaciones
- Experiencia 40 Polaridad Del TransformadorDocumento3 páginasExperiencia 40 Polaridad Del TransformadorYereliz GuevaraAún no hay calificaciones
- 6to Anio CIENCIAS NATURALESDocumento22 páginas6to Anio CIENCIAS NATURALESmercyyadira67% (3)
- FQ4 Jes Concep FisicaDocumento14 páginasFQ4 Jes Concep Fisicaisabel montillaAún no hay calificaciones
- Práctica de KinesisDocumento5 páginasPráctica de Kinesispantersxx5Aún no hay calificaciones
- Lab 02-Densidad de Carga y Campo EléctricoDocumento7 páginasLab 02-Densidad de Carga y Campo EléctricoSergio Luis Paiva FrassinettiAún no hay calificaciones
- Modulo de Elasticidad de Un Concreto ArmadoDocumento29 páginasModulo de Elasticidad de Un Concreto ArmadoMirko Lagos MelendezAún no hay calificaciones
- Notación de CeldaDocumento5 páginasNotación de CeldaAldo Benjamin Becerra GaytanAún no hay calificaciones
- Apunte de Movimiento Circular (NUEVO!)Documento9 páginasApunte de Movimiento Circular (NUEVO!)Micaela ArequipaAún no hay calificaciones
- Unidad2 PDFDocumento25 páginasUnidad2 PDFDesirée González CardosoAún no hay calificaciones
- Ecuación-De-la-Continuidad y Cantidad de Movimiento - Grupo03Documento30 páginasEcuación-De-la-Continuidad y Cantidad de Movimiento - Grupo03Eduardo Fuentes QuevedoAún no hay calificaciones
- Física Universitaria Con Física Moderna 2 - Young, H. D., & Freedman, R. A. 14 Ed., 2018-Capitulo 29Documento35 páginasFísica Universitaria Con Física Moderna 2 - Young, H. D., & Freedman, R. A. 14 Ed., 2018-Capitulo 29JF ProAún no hay calificaciones
- Motor Asincrono Ensayo en VacioDocumento10 páginasMotor Asincrono Ensayo en VacioEstiven MariscalAún no hay calificaciones
- 1.3 Sesion 2Documento5 páginas1.3 Sesion 2grregergAún no hay calificaciones
- Variacion Directa PDFDocumento19 páginasVariacion Directa PDFAlfonso MartinezAún no hay calificaciones
- Tema 8. Sistemas TrifasicosDocumento51 páginasTema 8. Sistemas TrifasicosJodyAún no hay calificaciones
- Informe 1 ElectronicaDocumento11 páginasInforme 1 ElectronicaAlexander G. ParedesAún no hay calificaciones
- Problema Termodinámico (Sistema Cerrado)Documento4 páginasProblema Termodinámico (Sistema Cerrado)JOSUE GONZALES BARJAAún no hay calificaciones
- Semana #12: Tema: Dinámica CircularDocumento3 páginasSemana #12: Tema: Dinámica Circularerick muñico alejoAún no hay calificaciones
- CienciasDocumento266 páginasCienciasLeopoldo Avila100% (1)
- Problemas de Fisica FniDocumento297 páginasProblemas de Fisica FniHerlan FloresAún no hay calificaciones
- Ejercicios-Factores-Conversion Con SoluciónDocumento6 páginasEjercicios-Factores-Conversion Con SoluciónJuanAún no hay calificaciones
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (202)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizDe EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizCalificación: 5 de 5 estrellas5/5 (7)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Magia con Bicarbonato de Sodio: Decenas de Remedios y Usos Caseros que te Ahorrarán Dinero y Tiempo Utilizando el Bicarbonato de SodioDe EverandMagia con Bicarbonato de Sodio: Decenas de Remedios y Usos Caseros que te Ahorrarán Dinero y Tiempo Utilizando el Bicarbonato de SodioCalificación: 4.5 de 5 estrellas4.5/5 (7)
- SNC - Soporte neurocrítico: De la urgencia a la terapia intensivaDe EverandSNC - Soporte neurocrítico: De la urgencia a la terapia intensivaAún no hay calificaciones
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Proyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadDe EverandProyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadCalificación: 5 de 5 estrellas5/5 (1)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Ikigai: Los secretos orientales para la longevidad explicados con el cine y la cultura popDe EverandIkigai: Los secretos orientales para la longevidad explicados con el cine y la cultura popCalificación: 4 de 5 estrellas4/5 (5)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones