Documentos de Académico
Documentos de Profesional
Documentos de Cultura
16 - Esquema - Enlaces Quimico
Cargado por
Mishell Lizbeth0 calificaciones0% encontró este documento útil (0 votos)
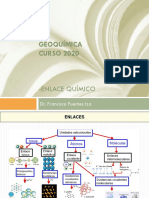
11 vistas1 páginaEste documento describe tres tipos principales de enlaces químicos: enlaces iónicos, covalentes y metálicos. Los enlaces iónicos se producen entre un metal y un no metal, formando cationes y aniones. Los enlaces covalentes se producen cuando dos no metales comparten electrones o entre un no metal y el hidrógeno. Los enlaces metálicos se forman entre dos metales y conducen la electricidad.
Descripción original:
Título original
16_ESQUEMA_ENLACES QUIMICO
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento describe tres tipos principales de enlaces químicos: enlaces iónicos, covalentes y metálicos. Los enlaces iónicos se producen entre un metal y un no metal, formando cationes y aniones. Los enlaces covalentes se producen cuando dos no metales comparten electrones o entre un no metal y el hidrógeno. Los enlaces metálicos se forman entre dos metales y conducen la electricidad.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
11 vistas1 página16 - Esquema - Enlaces Quimico
Cargado por
Mishell LizbethEste documento describe tres tipos principales de enlaces químicos: enlaces iónicos, covalentes y metálicos. Los enlaces iónicos se producen entre un metal y un no metal, formando cationes y aniones. Los enlaces covalentes se producen cuando dos no metales comparten electrones o entre un no metal y el hidrógeno. Los enlaces metálicos se forman entre dos metales y conducen la electricidad.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
❖ CONDUCE ELECTRICIDAD EN ESTADO
DISUELTO. METAL + NO METAL = CATION + ANION
❖ SE PRODUCE EN METALES (PIERDE E¯) Y CRISTAL
+1
ENLACE IÓNICO NO METALES (CAPTURA E¯) EJEMPLO: 𝑁𝑎 +Cl⁻¹ =NaCl →SAL COMUN
❖ ALTO PUNTO DE EBULLICIÓN Y FUSIÓN.
QUIMICOS
QUIMICOS ❖ SOLIDOS CRISTALINOS
ENLACES
ENLACES
❖ COMPARTEN DE DOS O MAS ELECTRONES
▪ GRAN DUREZA Y P.F ALTO.
DE VALENCIA ▪ MALOS CONDUCTORES.
❖ SE PRODUCEN ENTRE DOS NO METALES ✓ SOLIDOS ▪ INSOLUBLES EN TODO TIPO
(CON ELECTRONEGATIVIDAD SIMILAR) Y COVALENTES DE DISOLVENTE.
ENLACE COVALENTE ENTRE NO METALES Y EL HIDROGENO.
▪ SON BLANDOS
( DE LEWIS) ❖ PROPIEDADES DE LOS COMPUESTOS ▪ SOLUBLES EN DISOLVENTES
COVALENTES. ✓ SUST. MOLECULAR MOLECULARES
▪ SUSTANCIA POLARES SON SOLUBLES
❖ NO FORMA IONES. EN DISOLVENTES POLARES
❖ SON DÚCTILES Y MALEABLES
❖ SON CONDUCTORES, CONDUCEN CALOR RED CRISTALINA DEL
❖ SE FORMAN ENTRO DOS METALES COBRE: IONES Cu²⁺
ENLACE METÁLICO ❖ ALTO PUNTO DE FUSIÓN Y EBULLICIÓN
❖ SOLIDOS CRISTALINOS
❖ TIENEN BRILLO CARACTERÍSTICO
También podría gustarte
- Geoquimica Clase 3Documento43 páginasGeoquimica Clase 3Centro de Estudiantes De GeologíaAún no hay calificaciones
- Cuadro Resumen de Los Tipos de EnlaceDocumento1 páginaCuadro Resumen de Los Tipos de EnlacesaraAún no hay calificaciones
- Wuolah Free UD3ESTADO SOLIDO 6 Gulag FreeDocumento1 páginaWuolah Free UD3ESTADO SOLIDO 6 Gulag FreeLucía RondaAún no hay calificaciones
- 1a. Parte IonicoDocumento22 páginas1a. Parte IonicoAgustinaAún no hay calificaciones
- Liquidos y Solidos2014Documento28 páginasLiquidos y Solidos2014JuliAún no hay calificaciones
- Enlaces InfoDocumento1 páginaEnlaces Infocobomavi2006Aún no hay calificaciones
- Cuadros Comparativos QuimicaDocumento2 páginasCuadros Comparativos QuimicaSheccid MirielAún no hay calificaciones
- Plantilla de Cuadro Comparativo 9Documento1 páginaPlantilla de Cuadro Comparativo 9familiaunidas491Aún no hay calificaciones
- Enlaces - Resumen (1) Fisica y QuimicaDocumento1 páginaEnlaces - Resumen (1) Fisica y Quimicanakamuramizuki324Aún no hay calificaciones
- Tema 3 Sólidos, Líquidos y GasesDocumento50 páginasTema 3 Sólidos, Líquidos y GasesanaAún no hay calificaciones
- Resumen Enlaces QuímicosDocumento1 páginaResumen Enlaces QuímicosValya AlonsoAún no hay calificaciones
- Metales No Metales Metaloides Gases Nobles Halógenos: FísicaDocumento1 páginaMetales No Metales Metaloides Gases Nobles Halógenos: FísicaPatricia LopezAún no hay calificaciones
- Mapa Mental LabotorioDocumento2 páginasMapa Mental LabotorioRomina GarduñoAún no hay calificaciones
- Resumen Primer Parcial Ciencia de MaterialesDocumento9 páginasResumen Primer Parcial Ciencia de Materialesmaurot82100% (1)
- Estado Sólido Resumen (Jonathan Ismael Pungacho Enriquez)Documento2 páginasEstado Sólido Resumen (Jonathan Ismael Pungacho Enriquez)Ismael Pungacho100% (1)
- 2º Bachillerato Minerales I 2018Documento178 páginas2º Bachillerato Minerales I 2018daniruizcas100% (1)
- Afiche de Los Metales y de Los No MetalesDocumento1 páginaAfiche de Los Metales y de Los No MetalesVanessa Mercegue100% (1)
- Tabla de Clasificacion Según EnlacesDocumento1 páginaTabla de Clasificacion Según EnlacesDaniel ParejaAún no hay calificaciones
- Diferencias Entre Metales y No MetalesDocumento1 páginaDiferencias Entre Metales y No Metalesalfonso serrano santa mariaAún no hay calificaciones
- Vasconez - GR8 - 2022 - Resumen SolidosDocumento2 páginasVasconez - GR8 - 2022 - Resumen SolidosNicolas Vasconez TorresAún no hay calificaciones
- EnlacesDocumento17 páginasEnlacesDario MartínAún no hay calificaciones
- Tablas Comparativas QuimicaDocumento3 páginasTablas Comparativas QuimicaANDREA SANCHEZ MENDEZ100% (1)
- Estado Sólido Anual Eureka 2022Documento11 páginasEstado Sólido Anual Eureka 2022cotrina4a.arAún no hay calificaciones
- Uniones Covalente, Ionica, MetalicaDocumento1 páginaUniones Covalente, Ionica, Metalicaandrea carreñoAún no hay calificaciones
- Cuadro Comparativo, de Los Compuestos Con Enlace Iónico, Metálico y CovalenteDocumento5 páginasCuadro Comparativo, de Los Compuestos Con Enlace Iónico, Metálico y CovalenteMar MuAún no hay calificaciones
- Esquema Enlace QuímicoDocumento3 páginasEsquema Enlace Químicoclashroyalecr220Aún no hay calificaciones
- CARACTERÍSTICAS DE LOS SÓLIDOS CRISTALINOS-tablaDocumento2 páginasCARACTERÍSTICAS DE LOS SÓLIDOS CRISTALINOS-tablaerikita75290% (1)
- Tipos de EnlaceDocumento5 páginasTipos de EnlaceEmmanuel Vargas RuizAún no hay calificaciones
- UC1 - 1. Enlace Iónico: Chang 11 Ed. Cap 9.1-9.3 Brown 12 Ed. Cap 8.1-8.2Documento33 páginasUC1 - 1. Enlace Iónico: Chang 11 Ed. Cap 9.1-9.3 Brown 12 Ed. Cap 8.1-8.2LUCIANA BETZABE ANCHATU�A MORALESAún no hay calificaciones
- La Tabla Periodica Actual IiDocumento12 páginasLa Tabla Periodica Actual IiFranck DeshaimAún no hay calificaciones
- 06 Enlaces y Cristales Clase 08 2009 1 PDFDocumento7 páginas06 Enlaces y Cristales Clase 08 2009 1 PDFKerlihinModestpCamposanoQuispeAún no hay calificaciones
- Metalurgia y Cerámicas de Uso OdontológicoDocumento7 páginasMetalurgia y Cerámicas de Uso Odontológicoconsuelogallardo.jAún no hay calificaciones
- Estado Solido CficDocumento16 páginasEstado Solido CficJose Antonio BenavidesAún no hay calificaciones
- Trabajo de Seminario de TesisDocumento18 páginasTrabajo de Seminario de TesisErick Tu reyAún no hay calificaciones
- Propiedades de Enlaces Químicos Cuadro ComparativoDocumento2 páginasPropiedades de Enlaces Químicos Cuadro ComparativoĄlexio VelázquęzAún no hay calificaciones
- Cuadro ComparativoDocumento3 páginasCuadro Comparativopeccian100% (1)
- Infografia Enlaces QuimicosDocumento1 páginaInfografia Enlaces QuimicosARELLANES MARTÍNEZ JOSE MANUELAún no hay calificaciones
- Propiedades de Los Compuestos Iónicos y CovalentesDocumento5 páginasPropiedades de Los Compuestos Iónicos y CovalentesMAXIMILIANO CASTILLERO REYESAún no hay calificaciones
- Estado Sólido - Tabla ResumenDocumento1 páginaEstado Sólido - Tabla ResumenivezuAún no hay calificaciones
- Presentacion Sobre Los Tipos de Enlaces Quimicos.Documento10 páginasPresentacion Sobre Los Tipos de Enlaces Quimicos.Alessandro Llorente OjedaAún no hay calificaciones
- Comportamiento Del Estado SólidoDocumento10 páginasComportamiento Del Estado SólidoIan BermúdezAún no hay calificaciones
- Expo Quimica 1Documento15 páginasExpo Quimica 1SaraiAún no hay calificaciones
- Metalurgia: Catalina Suarez Vasuquez 2022Documento35 páginasMetalurgia: Catalina Suarez Vasuquez 2022CATALINA SUAREZ VASQUEZAún no hay calificaciones
- Compuestos IonicosDocumento14 páginasCompuestos Ionicoszahira moralesAún no hay calificaciones
- Tabla Propiedades de Los EnlacesDocumento1 páginaTabla Propiedades de Los EnlacesScarlett Jimenez GomezAún no hay calificaciones
- .Practica 1MB1Documento4 páginas.Practica 1MB1rehira kohakuAún no hay calificaciones
- Copia de Práctico Sobre SólidosDocumento8 páginasCopia de Práctico Sobre SólidosRomina LopezAún no hay calificaciones
- Propiedades de Las Sustancias Según Su EnlaceDocumento1 páginaPropiedades de Las Sustancias Según Su EnlaceMateo Sebastián OviedoAún no hay calificaciones
- Enlaces QuimicosDocumento4 páginasEnlaces QuimicosLeonel HernándezAún no hay calificaciones
- Enlaces y PropiedadesDocumento1 páginaEnlaces y PropiedadesEmilio SimónAún no hay calificaciones
- Átomos y MoléculasDocumento22 páginasÁtomos y MoléculasCeciAcevedoAún no hay calificaciones
- Cuadro Tipo de Enlace SandraDocumento1 páginaCuadro Tipo de Enlace Sandrasandra JimenezAún no hay calificaciones
- Capítulo 4Documento2 páginasCapítulo 4Carlos Jiménez RomeroAún no hay calificaciones
- Enlace QuímicoDocumento35 páginasEnlace QuímicoLuz Anel SarayaAún no hay calificaciones
- Propiedades PeriódicasDocumento31 páginasPropiedades Periódicascienciaspdg23Aún no hay calificaciones
- Fuerzas Interm + SólidosDocumento17 páginasFuerzas Interm + SólidosjorgeAún no hay calificaciones
- PRACTICA No 7Documento5 páginasPRACTICA No 7Francisco MuratallaAún no hay calificaciones
- Tipo de SolidoDocumento1 páginaTipo de SolidotugaturritalindaAún no hay calificaciones
- Quimica de Los MetalesDocumento9 páginasQuimica de Los Metalesisaul ocampoAún no hay calificaciones