Documentos de Académico
Documentos de Profesional
Documentos de Cultura
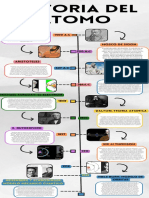
Modelos Atomicos
Cargado por
Juan PortacioDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Modelos Atomicos
Cargado por
Juan PortacioCopyright:
Formatos disponibles
¿Qué son los modelos atómicos?
Se conoce como modelos atómicos a las distintas representaciones gráficas de
la estructura y funcionamiento de los átomos. Los modelos atómicos han sido
desarrollados a lo largo de la historia de la humanidad a partir de las ideas que en
cada época se manejaban respecto a la composición de la materia.
Los primeros modelos atómicos datan de la antigüedad clásica, cuando los
filósofos y naturalistas se aventuraron a pensar y a deducir la composición de las
cosas que existen, es decir, de la materia.
Modelo Atómico de Demócrito.
Los prominentes físicos Dalton, Bohr, Einstein y Rutherford no fueron los primeros en
hablar del átomo, de hecho, la misma palabra “átomo” fue creada por el filósofo Griego
Leucipo de Mileto y su discípulo Demócrito 450 años antes de Cristo.
Estos filósofos griegos hicieron una brillante contribución a la ciencia moderna sembrando
la semilla de la teoría atómica. Según Demócrito, el universo y todo lo que nos rodea está
compuesto de átomos con las siguientes características.
Principios fundamentales del Modelo atómico de Demócrito.
1. Estos átomos son físicamente indivisibles.
2. Entre cada átomo hay un espacio vacío.
3. Los átomos son indestructibles.
4. Los átomos están continuamente en movimiento.
5. Hay muchos tipos de átomos.
Como consecuencia de estas afirmaciones, los filósofos creían que la solidez de un
material dependía del tipo de átomo del que estaba hecho y de la unión entre dichos
átomos. Por lo que suponían que los átomos del agua eran diferentes a los de una roca
por citar un ejemplo.
Para explicar su modelo, Demócrito comenzaba con una piedra, la cual explicaba que si se
cortaba a la mitad obtendría dos pedazos de la misma piedra y si se repitiera la operación
continuamente, se llegaría a una pieza dentro de la piedra que ya no pudiera ser cortada.
Una pieza indivisible, el “átomo”.
Como se puede apreciar el modelo era totalmente mecánico y solamente consideraba la
unión entre átomos. Sin embargo, este modelo fue una genialidad para la época y tuvieron
que pasar 2,200 años para que surgiera el siguiente modelo atómico que hiciera
resonancia en la comunidad científica.
A Demócrito se le considera el padre del átomo y pese a ser un modelo muy primitivo
comparado con lo que conocemos actualmente, fue una aportación sorprendentemente
apegada a la que actualmente consideramos correcta. Particularmente si consideramos
que viene de filósofos que no tenían forma de hacer experimentos como los científicos
modernos.
Modelo Atómico de Dalton.
JOHN DALTON. 6 de septiembre de 1766 – 27 de julio de 1844
También conocido como el modelo de la bola de billar. Desarrollado en 1804.
Después del Atomismo y las corrientes filosóficas Griegas, pasaron más de 2 mil años para
que otra teoría atómica trascendiera en el mundo científico y ésta salió de los estudios de
John Dalton, un físico, químico y meteorólogo inglés que propuso inicialmente la teoría
atómica moderna y que también es conocido por sus estudios sobre la incapacidad para
distinguir colores por el ojo humano, condición conocida como Daltonismo.
La idea del átomo como lo presentó el filósofo griego Demócrito no tuvo gran aceptación e
incluso a muchos científicos a lo largo de los siglos les pareció hasta ridícula. Sin embargo,
en 1804, John Dalton, basado en las ideas de los Atomistas, según algunos historiadores,
presentó un modelo atómico que finalmente tuvo resonancia en los físicos de la época
Para empezar, Dalton era un científico y su modelo fue el resultado de las conclusiones de
varios experimentos que realizó con gases. Con base en los resultados de sus
investigaciones, Dalton pudo demostrar que los átomos realmente existen, algo que
Demócrito solo había inferido, creando una de las teorías más importantes en la historia
de la física moderna.
Principios básicos del modelo atómico de Dalton.
1. Toda la materia está hecha de átomos.
Absolutamente todo lo que conocemos está hecho de átomos tanto en la tierra
como en el universo conocido. Cada uno de los elementos está hecho de átomos.
2. Los átomos son indivisibles e indestructibles.
Dalton pensaba que los átomos eran las partículas más pequeñas de la materia y
eran químicamente indestructibles.
3. Todos los átomos de un elemento dado son idénticos.
Para un elemento determinado, todos sus átomos tienen la misma masa y las
mismas características.
4. Los átomos de diferentes elementos varían en masa y propiedades.
Cada elemento tiene átomos de características y masa diferentes.
5. Los compuestos están formados por una combinación de dos o más tipos
diferentes de átomos.
Un compuesto determinado siempre tiene los mismos tipos de átomos
combinados y en las mismas proporciones.
6. Una reacción química es una reorganización de átomos.
Las reacciones químicas son el resultado de una separación, unión o
reorganización de átomos. Sin embargo, los átomos de un elemento nunca
cambian a átomos de otro elemento como resultado de una reacción química.
. Modelo de Thomson
El modelo de Thomson es un modelo del átomo propuesto en el año
1904 por Joseph John Thomson. Este nuevo modelo atómico fue una
evolución del modelo atómico de Dalton.
Esta nueva teoría atómica de Thomson intentó explicar dos propiedades
entonces conocidas de los átomos:
• Los electrones son partículas cargadas negativamente.
• Los átomos no tienen carga eléctrica neutra .
¿Por qué también se conoce como el modelo del átomo de
pudin?
El modelo de Thomson se ha comparado (pero no él mismo) con un
postre británico: el pudín de pasas, de ahí el nombre de este modelo.
El modelo del pudín de pasas tiene electrones rodeados por un volumen
de carga positiva, muy parecido a "pasas" cargadas negativamente
incrustadas en un "pudin" cargado positivamente.
Características del modelo atómico de Thomson
Las principales características del modelo atómico de Thomson se
resumen en estos 4 puntos:
• Thomson descubrió los electrones a través de sus experimentos
con tubos de rayos catódicos.
• En su modelo el átomo está formado por electrones de carga
negativa incrustados en una esfera de carga positiva como en
un "pudin de pasas".
• Los electrones están repartidos de manera uniforme por todo el
átomo.
• El átomo es neutro de manera que las cargas negativas de los
electrones se compensan con la carga positiva.
¿En qué consiste el modelo atómico de Thomson?
Según el modelo atómico de Thomson, el átomo consiste en elect rones
colocados en una "sopa" cargada positivamente, que compensa las
cargas eléctricamente negativas de los electrones.
Según este modelo, los electrones podrían girar libremente en una gota
o nube de una sustancia tan cargada positivamente. Sus órbitas s e
estabilizaron dentro del átomo por el hecho de que cuando
un electrón se aleja del centro de una nube cargada pos itivamente,
experimenta un aumento en la fuerza de atracción hacia el centro de la
nube.
Esta fuerza de atracción lo devuelve de nuevo al centro. La fuerza de
atracción al centro de una nube esférica cargada uniformemente es
directamente proporcional a la distancia a su centro.
En el modelo de Thomson, los electrones pueden rotar libremente en
órbitas de anillos, que se estabilizan mediante interacciones ent re
electrones. Los espectros de línea se explicaban por la diferencia de
energías cuando se movían a lo largo de diferentes órbitas de anillos.
El modelo de Thomson se convirtió en un precursor del posterior modelo
atómico de Bohr, que representa el átomo como una semejanza del
sistema solar.
Modelo atómico de Ernest Rutherford, el modelo planetario
El modelo atómico de Rutherford o modelo atómico planetario es un
modelo del átomo propuesto por Ernest Rutherford.
En 1909 se realizó el experimento de Geiger y Marsden, también
conocido como el experimento de Rutherford, ya que fue dirigido por el
propio Rutherford. Los resultados del experimento se publicaron en un
análisis de 1911 por Rutherford. La dispersión de Rutherford observada
en el experimento sugirió que los primeros modelos
atómicos "panettone" y "saturniano" eran incorrectos.
El nuevo modelo propuesto por Rutherford tenía características que se
han mantenido incluso en modelos posteriores, como:
• La concentración de la mayoría de la materia en un volumen
pequeño en comparación con el tamaño atómico, es decir, un
núcleo atómico
• La presencia de electrones que giran alrededor del núcleo
atómico.
Rutherford no dijo nada sobre el posible movimiento de los electrones,
también porque sabía que su revolución alrededor del núcleo central
provocaría la emisión de ondas electroma gnéticas.
Sin embargo, a partir de su descripción, comenzó a representar el átomo
con el núcleo en el centro y los electrones en órbita alrededor de él,
como los planetas del sistema solar alrededor del Sol. Debido a esta
representación en particular se le conoció como modelo planetario.
¿Cuáles son los puntos fundamentales del modelo de
Rutherford?
• El átomo es en su mayoría un espacio vacío. Rutherford negó
el modelo atómico de Thomson al confirmar la existencia del
núcleo atómico, ya postulado por Nagaoka. Sin embargo,
Rutherford señaló que el núcleo del átomo es muy pequeño en
comparación con el propio átomo.
• En el núcleo del átomo se concentraba la masa y la carga
positiva del átomo. Esta característica equilib raba la carga
eléctrica de los electrones haciéndolo eléctricamente neutro.
Rutherford introdujo el concepto de peso atómico, que
anteriormente se había omitido. La carga nuclear fue
identificada como responsable de la dispersión de partículas
alfa.
• Los electrones con carga negativa presentes alrededor del átomo
no afectan la dispersión de las partículas alfa.
¿Cómo fue el experimento de Ernest Rutherford?
En 1911 Rutherford propuso su modelo de estructura atómica para
explicar los resultados del experimento anterior de Geiger y Marsden,
que indicaba la presencia de una concentración de carga positiva en el
centro del átomo: el núcleo atómico.
Sin embargo, en su trabajo, Rutherford propuso hacer pasar una
partícula α de alta velocidad a través de un átomo de una lámina de oro
que tiene una carga central positiva estando rodeado por una carga de
igual magnitud de electrones.
A partir de consideraciones energéticas, Rutherfo rd dedujo que el radio
de la carga central de los átomos de un serie de láminas delgadas de
oro, que fueron el objetivo de la radiación en el experimento de Geiger y
Marsden, debe haber sido menor que 3,4 x 10 -14 m. Por otro lado, el
radio atómico del oro era se sabe que es del orden de 10 −10 m .
Rutherford concluyó que, por lo tanto, la carga debe concentrarse en un
volumen muy pequeño en relación con el tamaño atómico. En 1913
Henry Moseley demostró que la carga nuclear era muy similar al número
atómico y más tarde Antonius van den Broek sugiri ó que el número
atómico correspondía a la carga nuclear.
Rutherford no atribuyó ninguna estructura a las órbitas de los
electrones, sin embargo, mencionó el modelo atómico de Hantarō
Nagaoka, en el que los electrones estaban dispuestos en anillos, lo que
demuestra que no serían estables.
Modelo atómico de Bohr
El modelo de Bohr establece que los átomos tienen diferentes
configuraciones electrónicas en que los electrones se mueven en órbitas
circulares alrededor del núcleo.
El modelo de Bohr se parece al modelo planetario de Copérnico, los
planetas describiendo órbitas circulares alrededor del Sol. En este caso,
los electrones solo pueden orbitar por determinadas órbitas permitidas.
Los radios de las órbitas no pueden tener cualquier valor.
Después de las aportaciones científicas de John Dalton,
Joseph Thomson y el modelo de Rutherford, Niels Henrik Bohr propuso el
modelo atómico de Bohr en 1911.
En otros modelos de átomos anteriores al modelo de Bohr, se afirmó que
en el núcleo del átomo había protones cargados (+) y que circulaban
electrones en órbitas circulares alrededor del núcleo. Bohr estudió el
movimiento de los electrones que orbitan alrededor del núcleo en
la teoría atómica.
Erwin Schrödinger descubrió la ecuación fundamental de la mecánica
cuántica a partir del del modelo atómico de Bohr junto con la dualidad
onda-corpúsculo.
Los supuestos de la teoría de Bohr
En 1913, Niels Bohr propuso la teoría de Bohr utilizando las líneas
espectrales del átomo de hidrógeno y la teoría cuántica de Planck. A la
luz de esta información, los postulados de Bohr se pueden resumir de la
siguiente manera:
• Los electrones de un átomo se mueven en órbitas a cierta
distancia del núcleo. Cada estado estable tiene una energía
constante.
• A cualquier nivel energético estable, el electrón se mueve en
una órbita circular. Estas órbitas se denominan niveles de
energía o capas.
• Mientras el electrón está en uno de sus estados estacionarios, el
átomo no emite luz ( radiación). Sin embargo, cuando pasa de
un nivel de energía alto a un nivel de energía más bajo, emite
un cuantos de luz igual a la diferencia de energí a entre los
niveles.
• Los niveles estables en los que es posible el movimiento de
electrones se designan con letras de la K a la Q.
Cada órbita tiene electrones con distintos niveles de energía obtenida
que después se tiene que liberar y por esa razón el el ectrón va saltando
de una órbita a otra hasta llegar a una que tenga el espacio y nivel
adecuado.
Según el modelo atómico de Bohr, el electrón en movimiento circular al nivel de energía más cercano al
núcleo es estable, no emite luz. Si se le da suficiente energía al electrón, el electrón saltará a un nivel de
energía más alto que el nivel de energía en el que se encuentra.
En este estado el átomo es inestable. Para estabilizarse, el electrón
vuelve a su antiguo nivel energético, lanzando un Fotón (partícula de
rayo / onda) con una energía igual al nivel de energía que recibió.
¿Qué errores tenía el modelo atómico de Bohr?
• Dado que los electrones son muy rápidos, deben considerarse
no solo en la física clásica sino también en la teoría de la
relatividad.
• El modelo atómico de Bohr sólo puede explicar los espectros de
átomos de un solo electrón (hidrógeno). No puede explicar los
espectros de átomos de varios electrones.
• La dualidad onda-partícula (hipótesis de Broglie) no se tuvo en
cuenta en el modelo atómico de Bohr .
• Según el principio de incertidumbre de Werner Heisenberg, la
ubicación y la velocidad del electrón en el átomo no se pueden
determinar simultáneamente con absoluta certeza. Por tanto, el
concepto de "órbita" es erróneo.
• No menciona los mencionados
Modelo atómico de Sommerfeld
El modelo atómico de Sommerfeld es una extensión del modelo atómico
de Bohr. El nuevo modelo fue desarrollado por el físico alemán Arnold
Sommerfeld y su asistente Peter Debye en 1916. El modelo se llevó a
cabo con la ayuda de la ayuda de la teoría de la relatividad de Albert
Einstein. Sommerfeld descubrió que en los electrones de
ciertos átomos alcanzaban velocidades cercanas a la velocidad de la luz.
Las modificaciones básicas del modelo de Sommerfeld respecto al
de Bohr son:
• Los electrones se mueven alrededor del núcleo del átomo, en
órbitas circulares o elípticas.
• A partir del segundo nivel energético existen uno o más
subniveles en el mismo nivel.
• El electrón es una corriente eléctrica minúscula.
El modelo actual del átomo, conocido como modelo orbital atómico, no
podría haberse formulado sin los modelos anteriores derivados de las
hipótesis de Bohr.
¿Cuáles eran las limita ciones del modelo atómico de Bohr?
El modelo atómico de Bohr no tenía fisuras cuando se trataba del átomo
de hidrógeno. Por otro lado, cuando se trataba de átomos de
otros elementos químicos los electrones de un mismo nivel energético
tenían distinta energía.
Para el átomo de hidrógeno y el ion He+ , esto no afecta el espectro,
porque ambos tipos de capas son energéticamente iguales. Sin embargo,
para los átomos de varios electrones, aumenta el número de posibles
niveles de energía. En el espectro, esto se manifiesta en un mayor
número de líneas espectrales.
¿Cuál fue la solución de Sommerfeld a las limitaciones
del modelo de Bohr?
Respecto a estas fisuras, Sommerfeld postuló que dentro de un mismo
nivel energético existían subniveles, con energías un poco diferentes.
Además, a partir de los cálculos teóricos, Sommerfeld había encontrado
que en ciertos átomos las velocidades de los electrones alcanzaban una
fracción apreciable de la velocidad de la luz. Sommerfeld también realizó
estos cálculos para electrones relativistas.
El modelo atómico de Sommerfeld introdujo dos modificaciones básicas:
• Velocidades relativistas.
• En los átomos, los electrones se mueven en órbitas circulares y
elípticas a diferencia del modelo de Niels Bohr en que los
electrones sólo giraban en órbitas circulares.
• La excentricidad de la órbita dio lugar a un nuevo número cuántico
que determina la forma de los orbitales: el número cuántico
azimutal.
• Durante la elaboración, un número cuántico principal n = n ' + k.
El número cuántico secundario n' determina el momento angular
(radial) y la excentricid ad de la elipse. Para n ' = 0 surgen órbitas
circulares. El número cuántico lateral k describe el momento
angular que puede tomar el electrón de hidrógeno
También podría gustarte
- Apuntes Quimica Imanol Leyte Padilla 1EV2Documento21 páginasApuntes Quimica Imanol Leyte Padilla 1EV2Imanol Leyte PadillaAún no hay calificaciones
- Modelo AtómicoDocumento4 páginasModelo AtómicoCIBER CHARLYAún no hay calificaciones
- Modelos AtomicosDocumento10 páginasModelos AtomicosSebastian ValderramaAún no hay calificaciones
- Proyecto 2Documento10 páginasProyecto 2Maryale VazquezAún no hay calificaciones
- Modelos AtomicosDocumento4 páginasModelos AtomicosCitlali MezaAún no hay calificaciones
- Modelos AtomicosDocumento17 páginasModelos AtomicosRubenAún no hay calificaciones
- Átomos y estructura atómica: modelos históricosDocumento101 páginasÁtomos y estructura atómica: modelos históricosJorge ChasiAún no hay calificaciones
- Teoría AtómicasDocumento5 páginasTeoría AtómicasLeilany MoránAún no hay calificaciones
- Teoria Atomica ModernaDocumento4 páginasTeoria Atomica ModernaCristian OviedoAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosSaranndonga100% (1)
- Modelos AtomicosDocumento10 páginasModelos AtomicosErnesto RamosAún no hay calificaciones
- ATOMOSDocumento10 páginasATOMOSPamela PalominoAún no hay calificaciones
- Universidad Central Del EcuadoDocumento8 páginasUniversidad Central Del EcuadoSamanta MeloAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosSaranndongaAún no hay calificaciones
- Modelos AtómicosDocumento14 páginasModelos Atómicossseb@ss95% (44)
- Emiliano Zapata TolucaDocumento7 páginasEmiliano Zapata TolucaAlexis Alvarez ReyesAún no hay calificaciones
- Teoria Del Modelo Atomico - Udem Sem1Documento8 páginasTeoria Del Modelo Atomico - Udem Sem1sandyAún no hay calificaciones
- Modelos AtomicosDocumento10 páginasModelos AtomicosAyelen Domínguez GómezAún no hay calificaciones
- Teoría atómica de DaltonDocumento5 páginasTeoría atómica de DaltonJuan FuentesAún no hay calificaciones
- AtomoDocumento22 páginasAtomoraig1583Aún no hay calificaciones
- ÁtomosDocumento10 páginasÁtomosYabil LopezAún no hay calificaciones
- InformeDocumento13 páginasInformeBryan FloresAún no hay calificaciones
- Taller N°1 - Qui 10° - Per 1 - Teoría Atómica-12Documento5 páginasTaller N°1 - Qui 10° - Per 1 - Teoría Atómica-12richarAún no hay calificaciones
- Evolución de Los Modelos AtómicosDocumento13 páginasEvolución de Los Modelos AtómicosPatty MonteroAún no hay calificaciones
- Atomismo: Modelo Atómico de Dalton. También Conocido Como El Modelo de La Bola de Billar. Desarrollado en 1804Documento13 páginasAtomismo: Modelo Atómico de Dalton. También Conocido Como El Modelo de La Bola de Billar. Desarrollado en 1804Excel Marroquin G.Aún no hay calificaciones
- Modelos atómicos historiaDocumento4 páginasModelos atómicos historiaCRIKER CRIKERAún no hay calificaciones
- AtomoDocumento4 páginasAtomoLos EsfuerzosAún no hay calificaciones
- La Evolucion de Los Modelos AtomicosDocumento13 páginasLa Evolucion de Los Modelos AtomicosFELIX RAUL ECHEVERRIA CUBASAún no hay calificaciones
- Modelos AtómicosDocumento12 páginasModelos Atómicosセーフラグナ デイビッドAún no hay calificaciones
- Modelo AtómicoDocumento7 páginasModelo AtómicoLópez Pérez DanielAún no hay calificaciones
- Modelos AtomicosDocumento28 páginasModelos AtomicosGuillermo PintoAún no hay calificaciones
- Teoría Atómica de Demócrito y LeucipoDocumento7 páginasTeoría Atómica de Demócrito y Leucipotorreseider518Aún no hay calificaciones
- Química Tema 9Documento3 páginasQuímica Tema 9Ligia AguirreAún no hay calificaciones
- Modelos AtomicosDocumento15 páginasModelos AtomicosAlejandraAún no hay calificaciones
- Teorias Atomicas QuimicaDocumento4 páginasTeorias Atomicas QuimicaJORDI CHICAIZAAún no hay calificaciones
- CUADERNILLO 3 Año 2023Documento79 páginasCUADERNILLO 3 Año 2023Ariel OrellanoAún no hay calificaciones
- Modelos Atómicos en Cuadros Comparativos-QUIMICADocumento4 páginasModelos Atómicos en Cuadros Comparativos-QUIMICAEric SuarezAún no hay calificaciones
- Proyecto Modelo Atómico RutherfordDocumento11 páginasProyecto Modelo Atómico RutherfordAlexander Jhoel Cristiam Pari MaqueAún no hay calificaciones
- MODELOS ATÓMICOS y Sus CreadoresDocumento9 páginasMODELOS ATÓMICOS y Sus CreadoresFer BolibarAún no hay calificaciones
- MATERIAL AULICO PROFESORADO DE BIOLOGIA (Recuperado Automáticamente)Documento42 páginasMATERIAL AULICO PROFESORADO DE BIOLOGIA (Recuperado Automáticamente)jose luis blancoAún no hay calificaciones
- Modelos Atómicos - Metales - No Metales - Metaloides y Elementos Quimicos y Configuracion Electronica PDFDocumento27 páginasModelos Atómicos - Metales - No Metales - Metaloides y Elementos Quimicos y Configuracion Electronica PDFshadiaAún no hay calificaciones
- Modelos AtomicosDocumento10 páginasModelos AtomicosJuan martin CastroAún no hay calificaciones
- AtomoDocumento22 páginasAtomoAdelis MarquezAún no hay calificaciones
- Historia de Modelos AtómicosDocumento7 páginasHistoria de Modelos AtómicosAndrea Jezabel López GonzálezAún no hay calificaciones
- Historia Modelo AtomicoDocumento3 páginasHistoria Modelo Atomicopocholo9415Aún no hay calificaciones
- Modelos AtómicosDocumento7 páginasModelos AtómicoslokloAún no hay calificaciones
- Modelos AtomicosDocumento5 páginasModelos AtomicosAnonymous z8qm8DYCUvAún no hay calificaciones
- Modelo Atomico de Jhon DaltonDocumento3 páginasModelo Atomico de Jhon DaltonAdhesiveSki8518 ChikitoAún no hay calificaciones
- Fundamentos básicos de la química: átomos, moléculas, iones y modelos atómicosDocumento12 páginasFundamentos básicos de la química: átomos, moléculas, iones y modelos atómicosAndy SantanaAún no hay calificaciones
- Modelos atómicos a través de la historiaDocumento8 páginasModelos atómicos a través de la historiaMax Perez LealAún no hay calificaciones
- Segundo Parcial Ondas y ParticulasDocumento21 páginasSegundo Parcial Ondas y ParticulasJuan Jose Villamizar LAún no hay calificaciones
- La aventura de la física de partículas: Un viaje de un siglo para construir el modelo estándarDe EverandLa aventura de la física de partículas: Un viaje de un siglo para construir el modelo estándarAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Del mundo cuántico al universo en expansiónDe EverandDel mundo cuántico al universo en expansiónCalificación: 5 de 5 estrellas5/5 (1)
- La Síntesis Química de Los Elementos PesadosDocumento12 páginasLa Síntesis Química de Los Elementos PesadosJorge Ramirez RaherAún no hay calificaciones
- Qui MicaDocumento23 páginasQui Micaalli21122000Aún no hay calificaciones
- Tarea Que Responder PDFDocumento2 páginasTarea Que Responder PDFDANIEL OSORIO RODRIGUEZ0% (1)
- Tema 1 - TAREA1Documento3 páginasTema 1 - TAREA1คุณ ของคุณบน คุณAún no hay calificaciones
- Modelos AtómicosDocumento1 páginaModelos AtómicosFernando EspinosaAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosVelasquez Ramirez CassandraAún no hay calificaciones
- Linea Del Tiempo Del Atomo. Brayan ImbacuanDocumento1 páginaLinea Del Tiempo Del Atomo. Brayan ImbacuanlaurenthAún no hay calificaciones
- Biología y clasificación de animalesDocumento14 páginasBiología y clasificación de animalesoscar leeAún no hay calificaciones
- Geologia Sirve - 2019 EmiDocumento560 páginasGeologia Sirve - 2019 EmiAnonymous nyxNr3fkAún no hay calificaciones
- Línea Del TiempoDocumento14 páginasLínea Del TiempoMery NuñezAún no hay calificaciones
- Diccionario Sobre Tecnologia Nuclear PDFDocumento307 páginasDiccionario Sobre Tecnologia Nuclear PDFRaul Lopez LopezAún no hay calificaciones
- Actividad de Modelos Atomicos Examen y RespuestasDocumento2 páginasActividad de Modelos Atomicos Examen y Respuestasanon_454966502100% (1)
- Examenes Parciales Sem1Documento9 páginasExamenes Parciales Sem1jesus velasco ortegaAún no hay calificaciones
- Teoria Del Thomson Vercion Acual - Buscar Con GoogleDocumento1 páginaTeoria Del Thomson Vercion Acual - Buscar Con Googlerenisanchezcastro123Aún no hay calificaciones
- Física NuclearDocumento3 páginasFísica NuclearJuan Antonio Cabrera MartínezAún no hay calificaciones
- Mapa Conceptual de Los Modelos Atomicos 3Documento1 páginaMapa Conceptual de Los Modelos Atomicos 3Soledad MateoAún no hay calificaciones
- FISICA I 1ºpdf PDFDocumento145 páginasFISICA I 1ºpdf PDFCristel AragónAún no hay calificaciones
- Los Enlaces CovalentesDocumento7 páginasLos Enlaces CovalentesJuan Diego ClavijoAún no hay calificaciones
- Modelo AtomicoDocumento3 páginasModelo AtomicoMarcelo Sebastián BarrientosAún no hay calificaciones
- MODELOS ATOMICOS PresentaciónDocumento15 páginasMODELOS ATOMICOS PresentaciónAnalia g. MartinezAún no hay calificaciones
- 1 Conceptos BásicosDocumento2 páginas1 Conceptos BásicosLeticia Reyes FlorentinoAún no hay calificaciones
- El ÁtomoDocumento33 páginasEl ÁtomoCinthyaMárquezRojasAún no hay calificaciones
- Minerales PPT-2Documento39 páginasMinerales PPT-2SHANTAL SANCHEZAún no hay calificaciones
- Física Cuántica y Nuclear 2Documento16 páginasFísica Cuántica y Nuclear 2angelpaz985Aún no hay calificaciones
- 1b I.I Quimica Cuadro Sinoptico Tun May Jarhet RolandoDocumento2 páginas1b I.I Quimica Cuadro Sinoptico Tun May Jarhet RolandoJarhet Tun MayAún no hay calificaciones
- Curso Basico de BioprogramacionDocumento146 páginasCurso Basico de BioprogramacionmariadellAún no hay calificaciones
- Unidad 3 Estratigrafia y Tiempo GeologicoDocumento38 páginasUnidad 3 Estratigrafia y Tiempo GeologicoJose Luis PachecoAún no hay calificaciones
- Estructura AtomicaDocumento12 páginasEstructura AtomicaAna luciaAún no hay calificaciones
- Modelo Atómico de RutherfordDocumento4 páginasModelo Atómico de RutherfordannieAún no hay calificaciones
- Propiedades de la materiaDocumento30 páginasPropiedades de la materiaMorris MiurAún no hay calificaciones