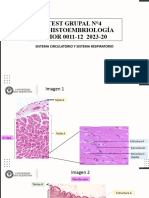
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Taller de Ejercicios PH Ácidos y Bases
Cargado por
gustavo vargas diazTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Taller de Ejercicios PH Ácidos y Bases
Cargado por
gustavo vargas diazCopyright:
Formatos disponibles
Taller de ejercicios
Cálculo pH ácidos y bases fuertes y débiles
1. Calcular el pH de una disolució n de HNO3 0,03 mol/L. R.- pH 1,52
2. Calcular el pH de una disolució n de Ca(OH)2 0,08 mol/L. R.- pH 13,2
3. ¿Cuá l es la concentració n de H+ de una disolució n de pH=4? R.- 1 x 10 -4 M
4. Una muestra de agua lluvia tiene un pH= 4,35. ¿Cuá nto vale [H3O+]? R.- 4,46 x 10 -5
5. Una muestra de KOH de uso doméstico tiene un pH=11,28. ¿Cuá nto vale [OH-]?
R.- 1,9 x 10-3 M
6. Calcular el pH de una solució n 0,01 M de NaOH (hidró xido de sodio). R.- pH 12
7.- El pH de una disolució n acuosa es 12,6. Calcule la [H+], [OH–] y el pOH
R.- H+ 2,5 x 10 -13 M , pOH 1,4 , OH- 0,04 M
8.- Un estudiante preparó una disolució n 0,10 M de á cido fó rmico (HCOOH) y midió su
pH a 25ºC, el pH resultante es 2,38. Calcule Ka y pKa para el á cido a esa temperatura.
R.- Ka 1,73 x 10 -4 , pKa 3,76
9.- Para una disolució n HF(ac) 0,15 M. ¿Cuá nto valen las concentraciones molares de las especies
presentes en la disolució n y el pH? Ka=6,6x10-4
R.- pH= -log 9,9 x 10-3 = 2,00
10.- Para una disolució n de piridina(ac) 0,0015 M. ¿Calcule las concentraciones molares de las
especies presentes en la disolució n y pH? [Piridina: Kb=1,5x10-9]
C5H5N C5H6N + OH-
R.- pOH = -log 1,5 x 10 -6 = 5,82
pH = 14,00 – 5,82 = 8,18
También podría gustarte
- Bioquímica GeneralDocumento24 páginasBioquímica Generalgustavo vargas diazAún no hay calificaciones
- Embriología Del Pollo Asociado A FertilizaciónDocumento20 páginasEmbriología Del Pollo Asociado A Fertilizacióngustavo vargas diazAún no hay calificaciones
- Tema 1 y 2Documento13 páginasTema 1 y 2gustavo vargas diazAún no hay calificaciones
- Trabajo Previo Lab 6 DBIO1076Documento2 páginasTrabajo Previo Lab 6 DBIO1076gustavo vargas diazAún no hay calificaciones
- Test4 F9Documento4 páginasTest4 F9gustavo vargas diazAún no hay calificaciones
- Clase 27 - PsicologiÌ A GeneralDocumento15 páginasClase 27 - PsicologiÌ A Generalgustavo vargas diazAún no hay calificaciones
- Clase 12 Neurovascularización y Topografía de MMII - DMOR0003 - 2022.20Documento31 páginasClase 12 Neurovascularización y Topografía de MMII - DMOR0003 - 2022.20gustavo vargas diazAún no hay calificaciones
- 9.guía Tap 9 (Dbio1076) - 202210Documento7 páginas9.guía Tap 9 (Dbio1076) - 202210gustavo vargas diazAún no hay calificaciones
- Certamen III. ESAPDocumento12 páginasCertamen III. ESAPgustavo vargas diazAún no hay calificaciones
- Guía 8 QuímicaDocumento6 páginasGuía 8 Químicagustavo vargas diazAún no hay calificaciones
- Informe Laboratorio 4 DBIO 1076 202220 DefinitivoDocumento8 páginasInforme Laboratorio 4 DBIO 1076 202220 Definitivogustavo vargas diazAún no hay calificaciones
- Control N2 HistoembriologíaDocumento21 páginasControl N2 Histoembriologíagustavo vargas diazAún no hay calificaciones
- Resumen Solemne N1Documento28 páginasResumen Solemne N1gustavo vargas diazAún no hay calificaciones
- Guia 1 Preparación.Documento5 páginasGuia 1 Preparación.gustavo vargas diazAún no hay calificaciones
- Guia Problemas Dqui 1034 - Unidad IaDocumento9 páginasGuia Problemas Dqui 1034 - Unidad Iagustavo vargas diazAún no hay calificaciones
- PsicologíaDocumento32 páginasPsicologíagustavo vargas diazAún no hay calificaciones
- Tema 1 - Clases 1 A 4Documento92 páginasTema 1 - Clases 1 A 4gustavo vargas diazAún no hay calificaciones
- Presentación - Laboratorio DQUI 1034Documento31 páginasPresentación - Laboratorio DQUI 1034gustavo vargas diazAún no hay calificaciones
- Trabajo Previo Lab 1 DBIO 1076 202220Documento2 páginasTrabajo Previo Lab 1 DBIO 1076 202220gustavo vargas diazAún no hay calificaciones
- Utopia Sexual Neutral Incluye A La Mujer y A La Postura Sexual Neutral, Ademas de Visibilizar El Contexto Social de La MujerDocumento1 páginaUtopia Sexual Neutral Incluye A La Mujer y A La Postura Sexual Neutral, Ademas de Visibilizar El Contexto Social de La Mujergustavo vargas diazAún no hay calificaciones
- DBIO1069 Biología Celular Endosomas y Tráfico Vesicular PDFDocumento18 páginasDBIO1069 Biología Celular Endosomas y Tráfico Vesicular PDFgustavo vargas diazAún no hay calificaciones
- Cartas de Amor Sigmund FreudDocumento86 páginasCartas de Amor Sigmund Freudgustavo vargas diazAún no hay calificaciones
- Solemne 1 Química General y OrgánicaDocumento11 páginasSolemne 1 Química General y Orgánicagustavo vargas diazAún no hay calificaciones
- EriksonDocumento15 páginasEriksonVinicio Sanchez0% (1)
- E1. Ejercita y Repasa 1 (1035) - 202210Documento6 páginasE1. Ejercita y Repasa 1 (1035) - 202210gustavo vargas diazAún no hay calificaciones