Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Estudio Dirigido Química
Cargado por
DAPHNE NICOLLE SALAZAR GALÁN0 calificaciones0% encontró este documento útil (0 votos)
7 vistas2 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
7 vistas2 páginasEstudio Dirigido Química
Cargado por
DAPHNE NICOLLE SALAZAR GALÁNCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
Estudio Dirigido Química
1. Realice un cuadro comparativo entre los aportes de los científicos de la época,
respecto al tema de gases (pag 225)
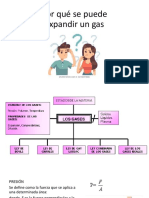
2. Cómo define el estado gaseoso
3. Cómo se pueden representar la diferentes unidades de presión
4. Defina presión, volumen y temperatura
5. Mencione 5 características de los gases a partir de la teoría cinético molecular
6. Cómo es el comportamiento de los gases frente a las variaciones de presión y
temperatura, mencione dos ejemplos
7. Resuelve el ejercicio 2 de la actividad que se encuentra en la página 232 (Del
enunciado que se presenta indica si se trata de Baja densidad, Miscibilidad,
compresibilidad y expansibilidad).
8. Realiza un cuadro comparativo entre Ley de Bouyle-Mariotte, Ley de Charles, Ley
de Amontons, Ley combinada de los gases, Ley de gas ideal o ecuación de estado.
9. Defina ppm
10. Cuáles son los gases que se encuentran en la atmosfera.
11. Diferencia entre efecto invernadero y lluvia ácida
12. Defina termodinámica
13. Qué tipos de sistemas termodinámicos existen
14. Cuáles son las variables termodinámicas
15. Tipos de procesos termodinámicos
16. Diferencia entre Energía, Calor y Trabajo
17. A que se refieren los términos exotérmico y endotérmico
18. Explique a que se refiere la primera, segunda y tercera ley de la termodinámica,
realice un cuadro comparativo.
EJERCICIOS:
1. Calcular el volumen ocupado por una masa de gas en condiciones estándares de
presión y temperatura, si a 750 mmHg de presión ese gas tiene un volumen de 3L.
Se mantiene constante durante todo el proceso.
2. Una cantidad de gas ocupa un volumen de 90 mL a una presión de 0.995
Atmósferas. ¿Qué volumen ocupará a una presión de 1.5 Atmósferas si la
temperatura no cambia?
3. Dispensemos una muestra de gas que a 250 °C presenta una presión de 3 Atm y un
volumen de 17 L ¿Qué volumen ocupará, si a la misma temperatura la presión baja
a 1.2 Atm?
4. Una cierta cantidad de gas ocupa un volumen de 450 mL a presión de 1.5 Atm.
¿ Qué presión ocupará un vlumen de 150 mL a la misma temperatura?
5. Calcular el volumen ocupado por una masa de gas en condiciones estándares de
temperatura y presión si a 35 °C tiene un volumen de 11.3 L. Se mantiene
constante la presión durante todo el proceso.
6. Determinar el volumen que ocupa un gas al disminuir la temperatura, el gas llena
un volumen de 10 L cuando está a 50°C. ¿Qué volumen ocupa a 25°C?
7. Calcular la temperatura en °C de un gas que está en un recipiente de 3 L a 25°C y
750 mmHg, si la presión interna aumenta hasta 850 mmHg. El volumen se
mantiene constante en el proceso.
8. Un gas tiene un volumen de 4 L a 950 mmHg a 32.5°C, calcula el volumen final a
65°C y 1200 mmHg de presión?
9. Si 15 moles de un gas ideal ocupa un volumen de 150 L ¿Cuántos moles de gas
encontramos si su nuevo volumen es de 25 L? si la presión y temperatura son
constantes.
10. Calcular el volumen de un gas O2 si hay 6 Atms de presión con 15 gramos a 100°C
11. Calcular la presión de una gas ideal a 50°C, a 400 mL de volumen y 1.20 moles
12. De la siguiente reacción responda:
2Mg(s) + O2(g) -------------------→ 2 MgO(s) AH(RX) = -1500 KJ Kilojoules
a) Es reacción endotérmica o exotérmica
b) Calcule la cantidad de calor transferida cuando se queman 4.6 g de Mg a
presión constante.
c) Cuántos gramos de MgO se producen durante el cambio de entalpía de -240 KJ
d) Cuántos KJ de calor son absorbidos cuando se descomponen 31.40 g de MgO
en Mg y O2
También podría gustarte
- 2 Ley Combinada de Los GasesDocumento14 páginas2 Ley Combinada de Los GasesVictor Andres Turpo FloresAún no hay calificaciones
- Giua de Gases 2022Documento6 páginasGiua de Gases 2022HUGO IBAÑEZAún no hay calificaciones
- Giua de Gases 2022 AlgoDocumento8 páginasGiua de Gases 2022 AlgoHUGO IBAÑEZAún no hay calificaciones
- Ejercicos GasesDocumento2 páginasEjercicos GasesRandall CorralesAún no hay calificaciones
- Estado GaseosoDocumento33 páginasEstado Gaseosojairaguillon059Aún no hay calificaciones
- Taller Unidad I Gases 2020Documento1 páginaTaller Unidad I Gases 2020Daniela Jefthé Obregón AlcántaraAún no hay calificaciones
- Taller - 2 - Estados de La Materia y GasesDocumento4 páginasTaller - 2 - Estados de La Materia y GasesYETZY FARIASAún no hay calificaciones
- Ley Combinada de Los GasesDocumento12 páginasLey Combinada de Los GasesPaolaCevallos100% (2)
- Serie III de Ejercicios Sobre El Estado Gaseoso SRDocumento6 páginasSerie III de Ejercicios Sobre El Estado Gaseoso SRMarcela SánchezAún no hay calificaciones
- Actividades Unidad 9Documento4 páginasActividades Unidad 9Daniela CasanovaAún no hay calificaciones
- Ejercicios Gases 1Documento3 páginasEjercicios Gases 1aestay100% (2)
- Estado GaseosoDocumento46 páginasEstado GaseosoAlejandra MurilloAún no hay calificaciones
- Problemas Ley de Los GasesDocumento2 páginasProblemas Ley de Los GasesT Thalía León Castillo50% (2)
- Ejercicios Gases IdealesDocumento2 páginasEjercicios Gases IdealesAron Ruelas OtazuAún no hay calificaciones
- Guía de Ejercicios GasesDocumento2 páginasGuía de Ejercicios GasesbelenAún no hay calificaciones
- PROBLEMAS VIDEO CLASE 4Documento12 páginasPROBLEMAS VIDEO CLASE 4Andres GarciaAún no hay calificaciones
- Leyes de Los Gases PDFDocumento6 páginasLeyes de Los Gases PDFJosheloteAún no hay calificaciones
- TERMO Ejercicios (1) 2020 - II PDFDocumento8 páginasTERMO Ejercicios (1) 2020 - II PDFIrene Sánchez Arroyave0% (1)
- Taller Sobre GasesDocumento3 páginasTaller Sobre GasesdayanaAún no hay calificaciones
- GasesDocumento3 páginasGasesLuis F. González AñezAún no hay calificaciones
- Tpn3 GasesDocumento6 páginasTpn3 GasesFeryi RudoAún no hay calificaciones
- Ejercicios (2) GasesDocumento2 páginasEjercicios (2) GasesaliroestayAún no hay calificaciones
- Leyes de Los GasesDocumento13 páginasLeyes de Los GasesMangiro SanoAún no hay calificaciones
- Diapositivas 1 Quimica2017Documento168 páginasDiapositivas 1 Quimica2017Margot Flores Salgado100% (3)
- Gases, Leyes de Los GásesDocumento28 páginasGases, Leyes de Los GásesSamara Moscote siosiAún no hay calificaciones
- Dilatacion de Los GasesDocumento8 páginasDilatacion de Los GasesNathanael GranadosAún no hay calificaciones
- Lcarreno - UNIDAD 5. GasesDocumento49 páginasLcarreno - UNIDAD 5. GasesDaniela camero lunaAún no hay calificaciones
- Gases IdealesPropuestosDocumento12 páginasGases IdealesPropuestosiTzFoxisAún no hay calificaciones
- UntitledDocumento1 páginaUntitledRamadanTAún no hay calificaciones
- Ejercicios gases ley PV=nRTDocumento2 páginasEjercicios gases ley PV=nRTWitty ThundersAún no hay calificaciones
- Problemas de gases ideales y termodinámicaDocumento5 páginasProblemas de gases ideales y termodinámicaLuis Miguel Nina FernandezAún no hay calificaciones
- Taller de Gases IdealesDocumento3 páginasTaller de Gases IdealesL. TAún no hay calificaciones
- Problemas Gases IdealesDocumento6 páginasProblemas Gases IdealesRocío García-Morato0% (1)
- Taller Ley de Los GasesDocumento3 páginasTaller Ley de Los GasesSTICH26Aún no hay calificaciones
- Guia de GasesDocumento7 páginasGuia de GasesrosmaAún no hay calificaciones
- Manula Termodinamica - Cristal Lopez Hernandez U2Documento10 páginasManula Termodinamica - Cristal Lopez Hernandez U2Paola MontufarAún no hay calificaciones
- Natalia Herrera - Ley de Gases - Taller - 11°BDocumento9 páginasNatalia Herrera - Ley de Gases - Taller - 11°BKeythelAún no hay calificaciones
- Gases 11Documento22 páginasGases 11CAMILO GIOVANNY ÑUNGO CRUZAún no hay calificaciones
- Práctica Clase N°3 y N°4 - GasesDocumento6 páginasPráctica Clase N°3 y N°4 - Gasesmaxifacultad20Aún no hay calificaciones
- Gases IdealesDocumento2 páginasGases IdealesEdu NigAún no hay calificaciones
- Serie 7 EMy FDocumento12 páginasSerie 7 EMy FlautarokAún no hay calificaciones
- Seminario Taller Gases IdealesDocumento4 páginasSeminario Taller Gases IdealesAdrian Gianpiero Escurra ChuecaAún no hay calificaciones
- Folleto2-Ley de Los Gases IdealesDocumento14 páginasFolleto2-Ley de Los Gases IdealesNesly LagunaAún no hay calificaciones
- Problemario Segundo Corte-2a 2B-MAYO AGOSTO 2023Documento2 páginasProblemario Segundo Corte-2a 2B-MAYO AGOSTO 2023Gustavo Angel Fierros OrtegaAún no hay calificaciones
- Problemas de Las Leyes de Los GasesDocumento3 páginasProblemas de Las Leyes de Los GasesCOTOBADAAún no hay calificaciones
- Taller de Gases.... 2Documento3 páginasTaller de Gases.... 2luigocuAún no hay calificaciones
- LEYES GASES MANUAL TSQDocumento10 páginasLEYES GASES MANUAL TSQRaphael Gutierrez DelgadoAún no hay calificaciones
- Ejercicios Propuestos Termodinámica 2018Documento2 páginasEjercicios Propuestos Termodinámica 2018YoanPasiònDoloresAún no hay calificaciones
- Tpn3 GasesDocumento7 páginasTpn3 GasesCzr WmAún no hay calificaciones
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Formalismo y métodos de la termodinámica. Volumen 1De EverandFormalismo y métodos de la termodinámica. Volumen 1Aún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Termodinámica y diagramas de equilibrioDe EverandTermodinámica y diagramas de equilibrioAún no hay calificaciones
- Guia de Estudio Dirigido II Biologia 10Documento1 páginaGuia de Estudio Dirigido II Biologia 10DAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Guía de Trabajo No. 2. P4 Medidas de Tendencia CentralDocumento2 páginasGuía de Trabajo No. 2. P4 Medidas de Tendencia CentralDAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Estadística Colegio Macdermont - Quiz No. 1 Medidas de tendencia centralDocumento2 páginasEstadística Colegio Macdermont - Quiz No. 1 Medidas de tendencia centralDAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Guía de Trabajo No. 3. P4 Medidas de Tendencia CentralDocumento2 páginasGuía de Trabajo No. 3. P4 Medidas de Tendencia CentralDAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Hoja de Trabajo 1Documento3 páginasHoja de Trabajo 1DAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Estadística Colegio Macdermont - Quiz No. 1 Medidas de tendencia centralDocumento2 páginasEstadística Colegio Macdermont - Quiz No. 1 Medidas de tendencia centralDAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Guía de Trabajo No. 5. P4 Medidas de PosiciónDocumento3 páginasGuía de Trabajo No. 5. P4 Medidas de PosiciónDAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Guía de Trabajo No. 4. P4 Medidas de PosiciónDocumento4 páginasGuía de Trabajo No. 4. P4 Medidas de PosiciónDAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Hoja de Trabajo 1Documento3 páginasHoja de Trabajo 1DAPHNE NICOLLE SALAZAR GALÁNAún no hay calificaciones
- Informe BiotecnologiaDocumento3 páginasInforme Biotecnologiaselene Morales CárcamoAún no hay calificaciones
- Practica 8 PDFDocumento7 páginasPractica 8 PDFCesar OrozcoAún no hay calificaciones
- Reacciones redox balanceadas en medio ácidoDocumento4 páginasReacciones redox balanceadas en medio ácidoAlexander UracahuaAún no hay calificaciones
- Trabajo de Clase 3Documento17 páginasTrabajo de Clase 3Jose Arnaldo Lupaca QuispeAún no hay calificaciones
- Preguntas QuiemicaDocumento12 páginasPreguntas QuiemicaAlison Castillo SanchezAún no hay calificaciones
- HDS TippsLine Limpia Vidrios V1Documento8 páginasHDS TippsLine Limpia Vidrios V1tatianaAún no hay calificaciones
- TITULACION DE AMINOACIDOS LabDocumento12 páginasTITULACION DE AMINOACIDOS LabDaniela AvendañoAún no hay calificaciones
- 71 RMTA4 EspDocumento2 páginas71 RMTA4 EspRoberto Angel Cabrera OrtizAún no hay calificaciones
- Taller Conceptos Quimica GeneralDocumento12 páginasTaller Conceptos Quimica GeneralSebastian Ospina PerdomoAún no hay calificaciones
- Informe Practica 2. Camara de NeubauerDocumento7 páginasInforme Practica 2. Camara de NeubauerGrace MaiguaAún no hay calificaciones
- Tema 7Documento12 páginasTema 7Fabio CamargoAún no hay calificaciones
- Actprevias P1 BenzoinaDocumento13 páginasActprevias P1 BenzoinaDiego ValenciaAún no hay calificaciones
- Tox21 Data BrowserDocumento1 páginaTox21 Data BrowserNathalia MojicaAún no hay calificaciones
- Prácticos 13,14,15Documento3 páginasPrácticos 13,14,15Silvia100% (1)
- Manual de Tronadura - McKenzieDocumento109 páginasManual de Tronadura - McKenzieJohanna VargasAún no hay calificaciones
- Síntesis Del BioprocesoDocumento6 páginasSíntesis Del BioprocesoNancy Rojas ArteagaAún no hay calificaciones
- Identificacion de Enlaces Saturados e Insaturados de HidrocarburosDocumento10 páginasIdentificacion de Enlaces Saturados e Insaturados de Hidrocarburoscarlos diegoAún no hay calificaciones
- Taller Distribucion Campo ElectricoDocumento2 páginasTaller Distribucion Campo ElectricoDAVID JOSE NOGALES LEONAún no hay calificaciones
- Guia 3 Ero 2Documento80 páginasGuia 3 Ero 2Carmen PerezAún no hay calificaciones
- Tarea 1 Aplicación Procesos y Materiales en La IndustriaDocumento14 páginasTarea 1 Aplicación Procesos y Materiales en La Industriamarcela roseroAún no hay calificaciones
- Manual de QuímicaDocumento78 páginasManual de QuímicaVic Camilo C.BAún no hay calificaciones
- Ejercicio Wankat 6G-6Documento18 páginasEjercicio Wankat 6G-6Daniella PerdomoAún no hay calificaciones
- Aldehidos y CetonasDocumento4 páginasAldehidos y CetonasMariel CossioAún no hay calificaciones
- JULIADocumento23 páginasJULIAEMMANUEL LECHUGA REYESAún no hay calificaciones
- Formato de Practica de ClorfenaminaDocumento3 páginasFormato de Practica de Clorfenaminajanet huanca choqueAún no hay calificaciones
- QUIMICA 3 Semana 4Documento2 páginasQUIMICA 3 Semana 4Azrael Esime - ipnAún no hay calificaciones
- Investigacion FormativaDocumento25 páginasInvestigacion FormativaJavier CalixtoAún no hay calificaciones
- Actividad 3 - Flores Salazar HernánDocumento5 páginasActividad 3 - Flores Salazar Hernánhernan flores salazarAún no hay calificaciones
- Práctica 3. Solubilidad.Documento21 páginasPráctica 3. Solubilidad.PalomaAún no hay calificaciones
- Manual de Instalacion de Filtros de Lecho Profundo 200828Documento11 páginasManual de Instalacion de Filtros de Lecho Profundo 200828jaalmeloAún no hay calificaciones