Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Práctica 6 - Física Fluidos y Termodinámica 2022 - Problemas de La Primera Ley de La Termodinámica
Cargado por
Novio De Xiomara Ponce de León0 calificaciones0% encontró este documento útil (0 votos)
19 vistas2 páginasEste documento presenta 10 problemas de termodinámica y mecánica de fluidos para ser resueltos. Los problemas involucran conceptos como los procesos termodinámicos (isobárico, isotérmico, adiabático), la primera ley de la termodinámica, diagramas pV, trabajo, calor y energía interna para gases ideales en diversos escenarios que incluyen cambios de presión, volumen y temperatura.
Descripción original:
Título original
Práctica 6 - Física Fluidos y Termodinámica 2022 - Problemas de La Primera Ley de La Termodinámica (1)
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento presenta 10 problemas de termodinámica y mecánica de fluidos para ser resueltos. Los problemas involucran conceptos como los procesos termodinámicos (isobárico, isotérmico, adiabático), la primera ley de la termodinámica, diagramas pV, trabajo, calor y energía interna para gases ideales en diversos escenarios que incluyen cambios de presión, volumen y temperatura.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
19 vistas2 páginasPráctica 6 - Física Fluidos y Termodinámica 2022 - Problemas de La Primera Ley de La Termodinámica
Cargado por
Novio De Xiomara Ponce de LeónEste documento presenta 10 problemas de termodinámica y mecánica de fluidos para ser resueltos. Los problemas involucran conceptos como los procesos termodinámicos (isobárico, isotérmico, adiabático), la primera ley de la termodinámica, diagramas pV, trabajo, calor y energía interna para gases ideales en diversos escenarios que incluyen cambios de presión, volumen y temperatura.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
UNIVERSIDAD CATÓLICA DE SANTA MARÍA
FACULTAD DE CIENCIAS E INGENIERÍAS FÍSICAS Y FORMALES
ESCUELA PROFESIONAL DE INGENIERÍA MECÁNICA, MECÁNICA ELÉCTRICA Y
MECATRÓNICA
SEXTA PRÁCTICA DE FÍSICA: FLUIDOS Y TERMODINÁMICA
Problemas de la Primera Ley de la Termodinámica
2022-A 29-06-2022
1. Un cilindro provisto de un émbolo contiene 5,00 moles de gas ideal inicial-mente a 100 °C. Manteniendo
constante la temperatura, el volumen se aumenta hasta que la presión baja al 50,0% de su valor inicial.
(a) Haga la gráfica pV para este proceso. (b) Calcule el trabajo efectuado por el gas.
2. Un gas se somete a dos procesos termodinámicos. En el primero, el volumen se mantiene constante en
0,450 m3 y la presión aumenta de 3,50 ×105 Pa a 6,50 ×105 Pa. En el segundo proceso se mantiene
constante la presión a 6,50 ×105 Pa y el volumen baja a 0,250 m 3. Haga el diagrama pV y determine el
trabajo total hecho por el gas.
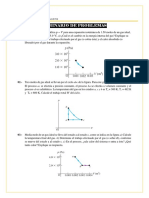
p (Pa)
3. El diagrama pV que muestra la figura P.17.6
p2 b
corresponde al comportamiento de un gas ideal, en
él se detalla una sucesión de tres procesos
termodinámicos, deduzca una expresión
matemática para: (a) el trabajo total hecho por el
gas si procedemos en sentido de las agujas del reloj
p1 a c
empezando en el estado a (b) y el trabajo si lo
hacemos en sentido contrario a ellas. (c)
compárelos, ¿qué conclusión saca? Explique. V (m3)
O V V
4. Cierto gas en un cilindro se mantiene a presión 1 2
5
constante de 1,90 ×10 Pa mientras se enfría y Figura P.17.6
comprime de 1,50 m3 a 1,10 m3. La energía interna
del gas disminuye 1,35 ×105 J. (a) Determine el trabajo efectuado por el gas. (b) ¿Cuánto calor fluye y de
dónde a dónde se realiza?
5. Un sistema termodinámico sigue los procesos mostrados en el
p
diagrama pV de la figura P-17.19. El trabajo desarrollado por el
sistema en la trayectoria abc es de 250 J y por la trayectoria adc
es de 60,0 J. Las energías internas son: U a =80,0 J, U b =130 J,
U c =540 J y U d =280 J. Determine el flujo de calor para cada
proceso isobárico e isócoro. ¿En cuál o cuáles absorbe calor el
sistema? y ¿en cuál o cuáles cede calor?
6. Un depósito provisto de un pistón contiene 2,55 moles de gas
ideal a una presión inicial de 1,75 atm, si no hay fugas y se lo
V
mantiene a temperatura constante de 65,0 °C, mientras se reduce O
su volumen en 65,0% del su volumen inicial. (a) Haga el
diagrama pV para este proceso. (b) ¿Cuánto trabajo realizó el
Figura P-17.19
gas? (c) ¿Cuánto cambió su energía interna? (d) ¿Cuánto calor fluyó del gas hacia el entorno o del
entorno hacia el gas?
7. Un cilindro con pistón contiene 0,550 moles de nitrógeno a 1,90 ×105 Pa y 365 K. Se puede tratar como
gas ideal al nitrógeno. El gas experimenta sucesivamente los siguientes procesos: expansión
isobáricamente al triple de su volumen inicial, compresión isotérmica hasta su volumen inicial y
enfriamiento isocóricamente hasta su presión inicial. (a) Haga el diagrama pV correspondiente a estos
procesos. (b) Determine la temperatura durante la compresión isotérmica. (c) Determine la presión
máxima. (d) Determine el trabajo neto durante todos los procesos.
8. Un cilindro provisto de un pistón contiene 0,680 moles de dióxido de carbono (CO 2) en su fase gaseosa a
25,0 °C. Manteniendo la presión a 1,50 atm el gas tiene comportamiento ideal y se calienta hasta 135 °C.
(a) Haga el diagrama pV correspondiente. (b) determine el trabajo que realiza el gas y sobre qué lo
hace. (c) ¿En cuánto cambió su energía interna? (d) ¿Cuánto calor se agregó al gas? (e) Si la presión fuese
de 1,00 atm ¿cuánto trabajo se realizará?
9. Al argón (Ar) puede tratársele como gas ideal. Entonces, 1,50 moles de este gas baja su temperatura
de 150 °C a 80,0 °C en un proceso adiabático. (a) Haga la gráfica pV correspondiente. (b) Determine el
trabajo realizado por el argón y su cambio de energía interna.
10. Cuatro moles de dióxido de carbono están inicialmente a 1,80 atm y ocupan un volumen de 50,0 L.
Después se comprimen adiabáticamente a 1/4 de ese volumen. Si asume que tiene comportamiento
ideal. (a) ¿Cuánto cambia su energía interna? (b) ¿Cuál es su temperatura final? (c) Haga un comentario
acerca de los resultados anteriores.
También podría gustarte
- Octava Práctica - Problemas de La Primera Ley de La TermodinámicaDocumento2 páginasOctava Práctica - Problemas de La Primera Ley de La TermodinámicaMelisa Thiara Paz LauraAún no hay calificaciones
- Problemas Primera Ley TermodinámicaDocumento5 páginasProblemas Primera Ley TermodinámicajoaquinAún no hay calificaciones
- Práctica de Física Fluidos y Termodinámica - (Temperatura y Calor y Primera Ley de La Termodinámica) - 2021-ADocumento2 páginasPráctica de Física Fluidos y Termodinámica - (Temperatura y Calor y Primera Ley de La Termodinámica) - 2021-Acesar zapata zuñigaAún no hay calificaciones
- p7 Procesos TermodinamicosDocumento12 páginasp7 Procesos TermodinamicosRoberto Pu83% (23)
- Taller Cuatro Fisica IIDocumento3 páginasTaller Cuatro Fisica IINelson MuñozAún no hay calificaciones
- 1 Ley TermoDocumento2 páginas1 Ley TermoDiego Garzon GilAún no hay calificaciones
- Trabajo - Termodinamica PDFDocumento2 páginasTrabajo - Termodinamica PDFExamenesPorWhatsappAún no hay calificaciones
- Taller 2 (Primeraley y Gases Ideales)Documento3 páginasTaller 2 (Primeraley y Gases Ideales)Jessika Julieth Siachoque SuarezAún no hay calificaciones
- Problemas Propuestos Primera LeyDocumento3 páginasProblemas Propuestos Primera LeyJunior PeñaAún no hay calificaciones
- Ejercicios W y Q. Primera Ley 2020-IDocumento7 páginasEjercicios W y Q. Primera Ley 2020-IOleggValVilAún no hay calificaciones
- Problemas Capitulo 9 PDFDocumento1 páginaProblemas Capitulo 9 PDFEnmanuel BedregalAún no hay calificaciones
- BleyDocumento3 páginasBleyPaolita Quiroz ZambranoAún no hay calificaciones
- CAP - 4 1era Ley de La TermodinamicaDocumento4 páginasCAP - 4 1era Ley de La TermodinamicaSteven B-Roen100% (1)
- p7 Procesos TermodinamicosDocumento12 páginasp7 Procesos TermodinamicosJean Marco Morales AlcántaraAún no hay calificaciones
- 03 Ejercicios de Sistemas Termodinámicos. Primera Ley de La Termodinámica y Tipos de Procesos TermodinámicosDocumento6 páginas03 Ejercicios de Sistemas Termodinámicos. Primera Ley de La Termodinámica y Tipos de Procesos TermodinámicosLuis Fernando Jeri Guillén40% (5)
- Taller 6 Termodinamica - 2020Documento4 páginasTaller 6 Termodinamica - 2020Harry Zty Medina0% (1)
- Ejercicios de TermoDocumento4 páginasEjercicios de TermoMinato44100% (1)
- Primera Ley de La TermodinamicaDocumento4 páginasPrimera Ley de La Termodinamicadenistj76Aún no hay calificaciones
- SixthClasswork FluTermo 20182Documento2 páginasSixthClasswork FluTermo 20182fabio hurtado puentesAún no hay calificaciones
- 3 TermodinamicaDocumento6 páginas3 TermodinamicaJordi López ClaràAún no hay calificaciones
- Guia 10Documento5 páginasGuia 10gomalapidolucianoAún no hay calificaciones
- Biofisica Del Transporte Corte 2Documento2 páginasBiofisica Del Transporte Corte 2Nataly BonillaAún no hay calificaciones
- Taller Primera LeyDocumento4 páginasTaller Primera LeyScribdLibros11Aún no hay calificaciones
- Problemas de Física 1 Semana 6Documento3 páginasProblemas de Física 1 Semana 6ALONSO CONDORI CORNEJOAún no hay calificaciones
- Deber 9Documento6 páginasDeber 9ronaldoAún no hay calificaciones
- T7 Sem14 Ses3 PracticaDocumento4 páginasT7 Sem14 Ses3 PracticaJean PierreAún no hay calificaciones
- Term Odin A MicaDocumento23 páginasTerm Odin A MicaDiego NavarroAún no hay calificaciones
- Procesos TermodinámicosDocumento4 páginasProcesos TermodinámicosFernandoAún no hay calificaciones
- Serie de Problemas #1 Termodinamica IIDocumento4 páginasSerie de Problemas #1 Termodinamica IIFrank C. Flores100% (1)
- NNNMDocumento13 páginasNNNMredyz huamanAún no hay calificaciones
- Guias FQI 2019 6 A 9 v2Documento12 páginasGuias FQI 2019 6 A 9 v2Christian Iván Silva GarcíaAún no hay calificaciones
- Taller FisicoDocumento4 páginasTaller FisicoAndres MorenoAún no hay calificaciones
- Ejercicios Capitulo 1 y 2Documento4 páginasEjercicios Capitulo 1 y 2jhanrataAún no hay calificaciones
- Term OdinDocumento2 páginasTerm OdinMinato44Aún no hay calificaciones
- TermoDocumento13 páginasTermoEsTefanii R'cAún no hay calificaciones
- Práctica #07 1° y 2° LeyDocumento3 páginasPráctica #07 1° y 2° LeyLuis Robles0% (1)
- Principios de La TermodinamicaDocumento3 páginasPrincipios de La Termodinamica1991aolAún no hay calificaciones
- Tarea FisicaDocumento6 páginasTarea Fisicacesar zapata zuñigaAún no hay calificaciones
- Deber 6Documento4 páginasDeber 6jhonAún no hay calificaciones
- Taller de Procesos Termodinámicos 201820Documento4 páginasTaller de Procesos Termodinámicos 201820Jairo Mesa ChaparroAún no hay calificaciones
- Taller FQ1Documento5 páginasTaller FQ1johanna escorcia diazAún no hay calificaciones
- Primera Ley de La Termodinámica - Procesos TermodináicosDocumento4 páginasPrimera Ley de La Termodinámica - Procesos TermodináicosPablo Gómez EcheverriAún no hay calificaciones
- 9 HGDocumento25 páginas9 HGCarlos Angel Vilcapaza Caceres100% (1)
- 2012 - Repartido - 09 - Rev1 PDFDocumento3 páginas2012 - Repartido - 09 - Rev1 PDFOswaldo Fierro ValleAún no hay calificaciones
- Taller Primer Quiz FISICA ONDASDocumento3 páginasTaller Primer Quiz FISICA ONDASJuan Carlos Riveros MedinaAún no hay calificaciones
- Xdoc - MX Termodinamica Guzlop EditorasDocumento10 páginasXdoc - MX Termodinamica Guzlop Editorasnewton bardajesAún no hay calificaciones
- Hoja de Problemas #04Documento4 páginasHoja de Problemas #04Paul Quiroz AliagaAún no hay calificaciones
- Ejercicios Capitulo 1 y 2Documento4 páginasEjercicios Capitulo 1 y 2Julii TrochezAún no hay calificaciones
- Guía TermodinámicaDocumento8 páginasGuía TermodinámicayoshiwisAún no hay calificaciones
- Guia Estudio Fisica 2Documento7 páginasGuia Estudio Fisica 2Luis EscobarAún no hay calificaciones
- Tema 3 TermodinámicaDocumento2 páginasTema 3 TermodinámicaCandi Garcia BarberaAún no hay calificaciones
- Problemas - Termodinamica - Introduccion - Principio Cero y Primer PrincipioDocumento5 páginasProblemas - Termodinamica - Introduccion - Principio Cero y Primer Principioestuardo201212600Aún no hay calificaciones
- Taller Numero 3Documento4 páginasTaller Numero 3Daniel DBAún no hay calificaciones
- Fisica TermicaDocumento4 páginasFisica TermicaPaty FluAún no hay calificaciones
- Term Odin A MicaDocumento5 páginasTerm Odin A MicaLauraPaez15100% (1)
- Practica No 3 Calor Temperatura Termodinamica 1 - 2019Documento4 páginasPractica No 3 Calor Temperatura Termodinamica 1 - 2019Wilver VasquezAún no hay calificaciones
- Dos Moles de Gas Ideal Están Comprimidos en Un Cilindro A Temperatura Constante de 65Documento10 páginasDos Moles de Gas Ideal Están Comprimidos en Un Cilindro A Temperatura Constante de 65todd coinAún no hay calificaciones
- Guia Cap19 y 20Documento5 páginasGuia Cap19 y 20victrexAún no hay calificaciones
- Equilibrio Quimico MolecularDocumento0 páginasEquilibrio Quimico MolecularHugo CqAún no hay calificaciones
- Degradación Enzimática EjemploDocumento2 páginasDegradación Enzimática EjemploNataly Serrano67% (3)
- 12 Ley de Proust o de BertholletDocumento6 páginas12 Ley de Proust o de BertholletÁlvaro Maldonado Santiago100% (1)
- Cuestionario Proteinas-Metabolismo y Bioquímica EstructuralDocumento2 páginasCuestionario Proteinas-Metabolismo y Bioquímica EstructuralINGRID VERONICA VERANO TELLEZAún no hay calificaciones
- Alwayse Catalogo BolasTransportadorasDocumento36 páginasAlwayse Catalogo BolasTransportadorasAlex HolguinoAún no hay calificaciones
- Labo 4 Determinacion de AluminioDocumento18 páginasLabo 4 Determinacion de AluminioFiorella HorqqueAún no hay calificaciones
- Ejemplos PsicrometríaDocumento13 páginasEjemplos PsicrometríaPaulo Cesar Carhuancho VeraAún no hay calificaciones
- Acelerante de FraguaDocumento22 páginasAcelerante de FraguaMario RcAún no hay calificaciones
- Triangulo de Inflamabilidad y Fash PointDocumento4 páginasTriangulo de Inflamabilidad y Fash Pointpaola sotoAún no hay calificaciones
- Leyes de La Termodinámica.Documento5 páginasLeyes de La Termodinámica.erika CerdaAún no hay calificaciones
- Las Semiceldas o Semireacciones en Una Celda VoltaicaDocumento1 páginaLas Semiceldas o Semireacciones en Una Celda VoltaicaMilagros SullaAún no hay calificaciones
- Practica de Unidades Quimicas de Masa 5toDocumento2 páginasPractica de Unidades Quimicas de Masa 5toKevin Victor Guillen VargasAún no hay calificaciones
- Ficha Tecnica Galvanizado en Frio ZRCDocumento5 páginasFicha Tecnica Galvanizado en Frio ZRCeduardohe_ing100% (1)
- Cuadernillo Tablas QuimicasDocumento20 páginasCuadernillo Tablas QuimicasamargaroAún no hay calificaciones
- Practica #3Documento14 páginasPractica #3Nasser MohamedAún no hay calificaciones
- Ejercicios Saturación2Documento5 páginasEjercicios Saturación2Dany AlmazánAún no hay calificaciones
- Edad de La MáquinaDocumento1 páginaEdad de La MáquinaGaly CornejoAún no hay calificaciones
- Ensayo END Tintas PenetrantesDocumento12 páginasEnsayo END Tintas PenetrantesMauricio VallejosAún no hay calificaciones
- Manual Desinfección CloraciónDocumento36 páginasManual Desinfección CloraciónMaritza Enriquez67% (6)
- Lab Física Práctica ViDocumento5 páginasLab Física Práctica ViAngela TorresAún no hay calificaciones
- ES - Aislamiento de Poliuretano y Gestión de ResiduosDocumento19 páginasES - Aislamiento de Poliuretano y Gestión de ResiduosNIXON HERRERAAún no hay calificaciones
- Guía N°6 Configuración Electrónica Segundo CicloDocumento4 páginasGuía N°6 Configuración Electrónica Segundo CicloMiguel StarAún no hay calificaciones
- Artroplastia Total de Cadera PrimariaDocumento8 páginasArtroplastia Total de Cadera Primariaabiezeth gTovarAún no hay calificaciones
- 5.1. Hojas de Seguridad - Aceite Lubricante y Grasa UsadosDocumento3 páginas5.1. Hojas de Seguridad - Aceite Lubricante y Grasa Usadosmatias lizamaAún no hay calificaciones
- Actividad de Aprendizaje 1 PcaDocumento3 páginasActividad de Aprendizaje 1 PcaMiguel Angel Martinez CadenaAún no hay calificaciones
- Saturación Grasa en RMDocumento45 páginasSaturación Grasa en RMAníbal J. MorilloAún no hay calificaciones
- Guia N°3 - 1° Medio - Química - Unidad 2Documento5 páginasGuia N°3 - 1° Medio - Química - Unidad 2Esteban Junox Belial CortesAún no hay calificaciones
- Temperatura de Bulbo Humedo y Bulbo SecoDocumento3 páginasTemperatura de Bulbo Humedo y Bulbo SecoCaterine BurbanoAún no hay calificaciones
- RES #1041 Del 3 de Abril de 2018 Permiso de Vertimiento PDFDocumento28 páginasRES #1041 Del 3 de Abril de 2018 Permiso de Vertimiento PDFGineth RodriguezAún no hay calificaciones