Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejercicio 2-7-09
Cargado por
Daniela Clavijo0 calificaciones0% encontró este documento útil (0 votos)
9 vistas2 páginasejercicios
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoejercicios
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
9 vistas2 páginasEjercicio 2-7-09
Cargado por
Daniela Clavijoejercicios
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
Ejercicio 2
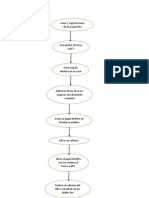
Efecto alostérico enzimas: se define como la situación en que una proteína ve alterada su actividad
como consecuencia de la unión de una molécula en un sitio diferente al centro activo.
Ejemplo: el centro catalítico de una enzima, donde se une el sustrato
el grupo hemo en la hemoglobina, donde se une la molécula de oxígeno
Podemos estudiar la alostería a través de varios ejemplos:
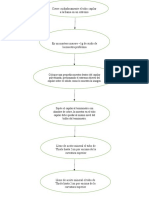
Actividad enzimática de la trombina. Se trata de una proteína monomérica (aunque
formada por dos cadenas), en la que no existe cooperatividad. Ejemplos de modulación
por efectores alostéricos negativos.
Actividad enzimática de la glucoquinasa. Esta es también una proteína monomérica, con
cinética sigmoidal. Ejemplos de modulación por efectores alostéricos positivos.
Oxigenación de la hemoglobina modulada por la unión del BPG. Se trata de una proteína
tetramérica que presenta cooperatividad. Ejemplo de modulación por un efector
alostérico negativo.
Inhibidores competitivos, no competitivos y mixtos
https://es.wikipedia.org/wiki/Inhibidor_enzim%C3%A1tico
También podría gustarte
- Diversidad (Género y Diversidad) - DISCAPACIDAD AUDITIVADocumento17 páginasDiversidad (Género y Diversidad) - DISCAPACIDAD AUDITIVADaniela ClavijoAún no hay calificaciones
- Laboratorio Fisica-Electromagnetismo 1Documento8 páginasLaboratorio Fisica-Electromagnetismo 1Daniela ClavijoAún no hay calificaciones
- Procedimiento 4Documento3 páginasProcedimiento 4Daniela ClavijoAún no hay calificaciones
- TALLER No 1 Intreacciones Intermoleculares - 1645763950 PDFDocumento3 páginasTALLER No 1 Intreacciones Intermoleculares - 1645763950 PDFDaniela ClavijoAún no hay calificaciones
- 2.pensamiento ComplejoDocumento9 páginas2.pensamiento ComplejoDaniela ClavijoAún no hay calificaciones
- Paradigmas - ReduccionismoDocumento10 páginasParadigmas - ReduccionismoDaniela ClavijoAún no hay calificaciones
- La Bioquímica y La Organización de Las CélulasDocumento28 páginasLa Bioquímica y La Organización de Las CélulasDaniela ClavijoAún no hay calificaciones
- Taller MN Aplicación de Principales MétodosDocumento2 páginasTaller MN Aplicación de Principales MétodosDaniela ClavijoAún no hay calificaciones
- Práctica 2 - Calibración de ManómetrosDocumento7 páginasPráctica 2 - Calibración de ManómetrosDaniela ClavijoAún no hay calificaciones
- 4 Practica Análisis Cualitativo de Proteína - Lípidos y CarbohidratosDocumento7 páginas4 Practica Análisis Cualitativo de Proteína - Lípidos y CarbohidratosDaniela ClavijoAún no hay calificaciones
- Densidad de Compuestos Puros y MezclasDocumento3 páginasDensidad de Compuestos Puros y MezclasDaniela ClavijoAún no hay calificaciones
- Clase 1 - Presentación Curso Balance de Masa y Energía - Grupo 2 Nocturno Martes 27-07-21Documento27 páginasClase 1 - Presentación Curso Balance de Masa y Energía - Grupo 2 Nocturno Martes 27-07-21Daniela ClavijoAún no hay calificaciones
- Curvas de TitulaciónDocumento11 páginasCurvas de TitulaciónDaniela ClavijoAún no hay calificaciones
- Clase 2 - Variables de Proces Curso Balance de Masa y Energía - Grupo 1 Diurno Jueves 29-07-21 y Martes 03-08-21Documento19 páginasClase 2 - Variables de Proces Curso Balance de Masa y Energía - Grupo 1 Diurno Jueves 29-07-21 y Martes 03-08-21Daniela ClavijoAún no hay calificaciones
- EVAPORACIÓN - ExposicionDocumento7 páginasEVAPORACIÓN - ExposicionDaniela ClavijoAún no hay calificaciones
- InfografiaDocumento1 páginaInfografiaDaniela ClavijoAún no hay calificaciones
- Tabla de DatosDocumento1 páginaTabla de DatosDaniela ClavijoAún no hay calificaciones
- Taller 6 Espacios VectorialesDocumento1 páginaTaller 6 Espacios VectorialesDaniela ClavijoAún no hay calificaciones
- Discapacidad Auditiva NataDocumento5 páginasDiscapacidad Auditiva NataDaniela ClavijoAún no hay calificaciones
- Taller Algebra LinealDocumento1 páginaTaller Algebra LinealDaniela ClavijoAún no hay calificaciones