Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Biología CTS
Cargado por
Camila ValecillosDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Biología CTS
Cargado por
Camila ValecillosCopyright:
Formatos disponibles
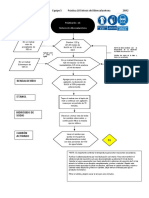
NOMECLATURA
Au2O3 Co(OH)3
sistemática: trióxido de dioro sistemática: trihidróxido de cobalto
stock: óxido de oro (III) stock: hidróxido de cobalto (III)
tradicional: óxido áurico tradicional: hidróxido cobáltico
Tipo de compuesto: óxido metálico Tipo de compuesto: hidróxido
(metal + oxígeno)
HI LiH
stock: yoduro de hidrógeno sistemática: monohidruro de litio
tradicional: ácido yodhídrico stock: hidruro de litio
tradicional: hidruro lítico
Tipo de compuesto: hidrácido Tipo de compuesto: hidruro metálico
CTS
Óxido áurico
Científico: sólido de color rojo-marrón, soluble en ácido nítrico
y ácido hidroclorhídrico.
Densidad: 11,34 g/cm3.
Punto de descomposición: 160 °C.
Masa molar: 441,93 g/mol.
Tecnológico:
4Au + 3 O2 → 2Au2O3.
Los óxidos metálicos o básico son la combinación de un metal
con el oxígeno originando un compuesto de la forma M2Ov ,
siendo v la valencia del metal .
Sociedad: Entre los usos más comunes del óxido áurico se
encuentran:
Industria aeroespacial.
Aplicaciones electroquímicas.
Elaboración de vidrio colorado.
Hidruro de litio
Científico : El hidruro de litio es incoloro y muy reactivo frente
a diversos elementos como el aire, el agua y los agentes
oxidantes.
Propiedades:
Densidad: 0,820 g/cm3.
Masa molar: 7,95 g/mol.
Punto de fusión: 692 °C.
Tecnológico: se ha obtenido en laboratorio mediante la
reacción entre el metal litio fundido y el gas hidrógeno a una
temperatura de 973 K (700 ºC). Se obtienen buenos resultados
cuando se aumenta la superficie expuesta del litio fundido y
cuando se disminuye el tiempo de sedimentación del LiH.
Sociedad: es utilizado como refrigerante, agente desecante, en
fabricado de cerámicas y generador de hidrógeno.
Hidróxido de cobalto (III)
Científico: es un sólido rosa insoluble en agua
Masa molar: 92,948 g/mol
Densidad: 3,6 g/cm³
Punto de fusión: 168 °C
Tecnológico: La adición de hidróxido potásico a una solución
de nitrato de cobalto (II) da como resultado la aparición de un
precipitado de color azul-violeta, que al ser hervido se
convierte en hidróxido de cobalto (II).
Sociedad: Utilizado en la elaboración de catalizadores
de refinación y petroquímica, se utiliza también para la
preparación de sales de Cobalto.
Ácido yodhídrico
Científico: gas incoloro que al reaccionar con oxígeno se forma agua y
yodo. Es un ácido fuerte.
Densidad: 2,85 g/cm3. Masa molar: 127,904 g/mol. Punto de fusión: -
89 °C.
Punto de ebullición: -35 °C.
Tecnológico: La formación de esta ácido puede ser por: Reacción de
los gases de yodo e hidrógeno en presencia de un catalizador, y
posterior absorción en agua. Tratamiento del yodo
con ácido sulfhídrico en solución acuosa. Reacción del yodo con
fósforo rojo y agua.
Sociedad: El yoduro de hidrógeno se puede obtener mediante los
siguientes procesos:
Combinación de H2 e I2: H2 + I2 » 2 HI
Reacción de I2 con hidracina: 2 I2 + N2H4 » 4 HI + N2
Borboteo de vapor de ácido sulfúrico en solución acuosa de yodo: H2S
+ I2 » 2 HI + S
Camila Valecillos
También podría gustarte
- Teoría de Las ColisionesDocumento9 páginasTeoría de Las ColisionesINGENIERIA BIOQUIMICAAún no hay calificaciones
- Nitrofurantoina Polarografia 1Documento13 páginasNitrofurantoina Polarografia 1Mario RangelAún no hay calificaciones
- Procedimiento Protecc. AnticorrosivaDocumento33 páginasProcedimiento Protecc. AnticorrosivaSisco Corp100% (1)
- FlareDocumento34 páginasFlareFranklin Santiago Suclla Podesta100% (1)
- Calor y TemperaturaDocumento9 páginasCalor y TemperaturaAnthony Ayala0% (1)
- Catálogo Del Espacio - Camila ValecillosDocumento7 páginasCatálogo Del Espacio - Camila ValecillosCamila ValecillosAún no hay calificaciones
- Rasgos Físicos de VenezuelaDocumento6 páginasRasgos Físicos de VenezuelaCamila ValecillosAún no hay calificaciones
- Química 3er AñoDocumento3 páginasQuímica 3er AñoCamila ValecillosAún no hay calificaciones
- Paracaidismo-Mapa MentalDocumento1 páginaParacaidismo-Mapa MentalCamila ValecillosAún no hay calificaciones
- ACTIVIDADES FÍSICAS PARA EMBARAZADAS - Camila ValecillosDocumento4 páginasACTIVIDADES FÍSICAS PARA EMBARAZADAS - Camila ValecillosCamila ValecillosAún no hay calificaciones
- Afiche de CarnavalDocumento1 páginaAfiche de CarnavalCamila Valecillos100% (2)
- Comic Sobre La Evoluciön Del HombreDocumento5 páginasComic Sobre La Evoluciön Del HombreCamila ValecillosAún no hay calificaciones
- Practica 8 - Eq 3 - 3im72Documento16 páginasPractica 8 - Eq 3 - 3im72Luis Angel Castillo OrtizAún no hay calificaciones
- Medición de La Conductividad Eléctrica de SolucionesDocumento4 páginasMedición de La Conductividad Eléctrica de SolucionesRodrigo AtiAún no hay calificaciones
- Química 04 CiDocumento4 páginasQuímica 04 CiliahAún no hay calificaciones
- Polimeros Introducción y ClasificaciónDocumento23 páginasPolimeros Introducción y ClasificaciónLeonardo100% (1)
- Unidad 2Documento94 páginasUnidad 2Sergio Esteban Hernandez Islas83% (6)
- Tema 12Documento11 páginasTema 12lauraAún no hay calificaciones
- Qué Es Un Punto Isosbéstico en Espectroscopía y Qué Revela - TriplenlaceDocumento3 páginasQué Es Un Punto Isosbéstico en Espectroscopía y Qué Revela - Triplenlacealc112Aún no hay calificaciones
- Ef TermodinamicaDocumento8 páginasEf TermodinamicaJhonatan Manrique FloresAún no hay calificaciones
- Práctica 10 Síntesis de DibenzalacetonaDocumento2 páginasPráctica 10 Síntesis de DibenzalacetonaVEGA FLORES Vianney IraisAún no hay calificaciones
- Practica 2 Adsorcion Desde Una SoluccionDocumento9 páginasPractica 2 Adsorcion Desde Una SoluccionManuel MtzAún no hay calificaciones
- Práctica No. 6 Ley de Conservación de La Masa y Clasificación de Reacciones QuímicasDocumento8 páginasPráctica No. 6 Ley de Conservación de La Masa y Clasificación de Reacciones QuímicasAnyelo PirajanAún no hay calificaciones
- Medidores de CaudalDocumento7 páginasMedidores de CaudalMarcos Condorí PacoAún no hay calificaciones
- Practica Quimica InorganicaDocumento3 páginasPractica Quimica InorganicaJose Reinaldo Olivera ChuraAún no hay calificaciones
- Informe Curvas de Calentamiento y Enfriamiento PDFDocumento8 páginasInforme Curvas de Calentamiento y Enfriamiento PDFAndres Felipe Cedeño BedoyaAún no hay calificaciones
- Informe 1 Lab 1. Med. TemperaturaDocumento19 páginasInforme 1 Lab 1. Med. TemperaturaLeandro David Paravia PomontiAún no hay calificaciones
- Absorcion Columna de RellenoDocumento21 páginasAbsorcion Columna de RellenojesiAún no hay calificaciones
- Quimica 03 (2)Documento1 páginaQuimica 03 (2)JOSE LUIS DEL CASTILLO MARTINEZAún no hay calificaciones
- Disolución / Desilución: M. en I. Pedro Valadez EslavaDocumento47 páginasDisolución / Desilución: M. en I. Pedro Valadez EslavaAlfred FonsecaAún no hay calificaciones
- Unidad 1Documento15 páginasUnidad 1Vargas Ortega EliannaAún no hay calificaciones
- Mec-2250 A Lab 2 y 3Documento33 páginasMec-2250 A Lab 2 y 3Fabiana Villarroel VargasAún no hay calificaciones
- sb1 2016 Q 02 PDFDocumento12 páginassb1 2016 Q 02 PDFAlex Robert Tang VenturonAún no hay calificaciones
- 3ro HIDROXIDOSDocumento2 páginas3ro HIDROXIDOSDarwini el ArtistiniAún no hay calificaciones
- Alpha y BetaDocumento13 páginasAlpha y BetaLucho BetoAún no hay calificaciones
- Composición Del Átomo 3ºDocumento23 páginasComposición Del Átomo 3ºEC MariaAún no hay calificaciones
- Quimica Analitica II Practica 3 ReporteDocumento6 páginasQuimica Analitica II Practica 3 ReporteRafael Gonzalez100% (1)