Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Semana 7.quimica
Cargado por
Héctor Eduardo Urquiaga CabreraTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Semana 7.quimica
Cargado por
Héctor Eduardo Urquiaga CabreraCopyright:
Formatos disponibles
UNMSM QUIMICA
SEMANA 7 II. El número de oxidación del
REACCIONES QUÍMICAS carbono en el agente reductor es
+ 3.
1. Establecer las relaciones III. Cada mol de agente oxidante
correctas. gana 5 electrones.
C O2 CO2 IV. La relación ocurre en medio
I.
alcalino.
a) Desplazamiento simple Son incorrectas:
II. 2NH3 N2 3H2
b) combinación A) I y II B) I y III
III. Na AgCl NaCl Ag C) Sólo IV D) III y IV
c) Descomposición E) II, III y IV
IV. NaOH HCl NaCl H2O
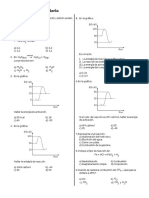
4. Del siguiente gráfico determine la
Doble desplazamiento energía de activación de la etapa
final en la reacción:
A) Ib, IIc, IIIa, IVd A B DE
B) Ia, IIb, IIc, IVd
C) Ib, IId, IIa, IVd
D) Ia, IId, IIIc, IVb
H(kcal mol1 )
E) N.A 190
110 D+E
2. Al balancear la siguiente ecuación
90
por el método ión electrón en
medio ácido y completar con el A+B
72
ión k . Indique el coeficiente
entero mínimo de Clorato de C
-22
Potasio.
Cl O3 S Cl2 SO42 A) 110 kcal/mol AVANCE
B) 190 kcal/mol
A) 6 B) 3 C) 94 kcal/mol
C) 0 D) 1 D) 12 kcal/mol
E) 4 E) 212 kcal/mol
3. Según el siguiente proceso: 5. En el proceso anterior, determine
Na2 C2O4 KMnO4 H2SO4 el calor de reacción total H y
mencione si el proceso total es
k 2SO4 Na2SO4 H2O MnSO4 CO2 exotérmico o endotérmico.
Tenemos las siguientes
afirmaciones: A) + 166 kcal/mol, endotérmico
B) + 94 kcal/mol, endotérmico
I. La relación molar agente C) - 94 kcal/mol, exotérmico
oxidante/agente reductor 2/5. D) + 18 kcal/mol, endotérmico
E) + 22 kcal/mol, exotérmico
SAN MARCOS 2018 CUESTIONARIO DESARROLLADO
UNMSM QUIMICA
6. En el proceso descrito en el IV. El cambio de color de las
problema 4. ¿Cuál es la energía sustancias.
liberada o absorbida por 1 solo
átomo del producto C? A) todas B) sólo I y II
C) sólo II y IV D) sólo III y I
A) 94 kcal E) I, II y IV
23
B) 1,56 10 kcal
22 10. Al balancear la siguiente ecuación:
C) 1,56 10 kcal
k 2Cr2O7 Kl H2SO4 k 2SO4
D) A y C
E) B y C Cr2 SO4 3 I2 H2O
Indicar cuántas proposiciones son
7. A partir de la siguiente expresión incorrectas.
de oxidación en medio alcalino: El coeficiente de la forma reducida
Fe2 O3 NO Fe O NO
3 4 2 es 1.
Determine la relación molar: Por cada mol de agente reductor
Agente reductor/Agente oxidante. se producen 0,5 mol de la forma
oxidada.
1 1 En la reacción el agente oxidante
A) B) pierde 6 electrones.
4 3 La relación molar entre la forma
1 1 reducida y el Nº de moles de H2 O
C) D)
2 5 es 1.
2 El coeficiente del agente reductor
E)
3 es 6.
8. ¿Qué especie poseen una dualidad A) 2 B) 1
oxidante y reductora? C) 3 D) 4
E) 5
II. P4 III. Cl2
I. MnO4
2
IV.Cr2 O 7 V. Zn
11. De la siguiente ecuación:
A) I, II, III B) I, II y IV CuS HNO3 Cu NO3 2 NO H2O SO2
C) IV, V, II D) II y III
Indicar cuántas proposiciones son
E) IV, I, V
correctas.
El coeficiente del ácido nítrico es
8.
9. ¿Cuáles de las siguientes
Se han producido dos oxidantes.
constituyen prueba inequívoca de
El ácido nítrico es el agente
que ha ocurrido una reacción
oxidante.
química?
El número de electrones
I. Desprendimiento de un gas. transferido es 24.
II. Formación de un precipitado.
III. El cambio de estado de las A) 0 B) 1
sustancias. C) 2 D) 3
SAN MARCOS 2018 CUESTIONARIO DESARROLLADO
UNMSM QUIMICA
E) 4 1 2
C) D)
5 5
2
E)
12. De: 3
J: C6H10O5 KClO4 kCl CO H2O
15. Ajustar la siguiente ecuación:
L: C2H6O K2Cr2 O7 H2SO4
CH3CHO K2SO4 Cr2 SO4 3 H2O PbS HNO3 Pb NO3 4 H2O NO S.
Determinar L, si:
Determine la suma de los suma de coeficientes
coeficientes de los agentes L
forma reducida
reductores y los coeficientes del
agua de “J” u “L”.
A) 10,5 B) 9,25
C) 0,37 D) 15,5
A) 20 B) 21
E) 16
C) 22 D) 13
E) 25
16. Determinar la relación L, si:
13. Al balancear determinar la L
coeficientes
relación L. forma reducida
coeficiente forma oxidada Pb3O4 HNO3 Pb NO3 2 Pb O2 H2O
coeficiente agua A) 2 B) 3
KNO2 H2SO4 K2SO4 HNO3 1 1
C) D)
NO H2O 5 3
E) 5
5 3
A) B)
2 4
17. Balancear la ecuación y calcular la
3 relación J.
C) 1 D)
4 coeficiente forma oxidada
3 J
E) coeficiente agente reductor
1
P4 KOH H2O KH2PO2 PH3
14. En la siguiente ecuación química:
KMnO4 H2C2O4 H2SO4
2
MnSO4 K2SO4 CO2 H2O A) 1 B)
5
1
Determinar la relación L, si: C) 3 D)
agente reductor 2
L E) 5
forma reducida
5 1
A) B)
2 3
SAN MARCOS 2018 CUESTIONARIO DESARROLLADO
UNMSM QUIMICA
18. A partir de la reacción oxido- - La suma total de los coeficientes
reducción en medio básico. de I y II es 41.
1
- Las formas oxidadas son NO3 y
ClO1 S2O23 Cl1 SO24 BrO13 .
Calcule el valor de la relación
molar J, si:
A) 1 B) 2
agente oxidante C) 3 D) 5
J
forma oxidada E) 4
A) 2 B) 3
1 1 21. Balancear en medio ácido
C) D) FeS NO13 NO SO24 Fe3
2 3
E) 4
e indicar la relación molar “J”.
19. En la siguiente ecuación REDOX,
en medio ácido Agente oxidante
J
Coeficiente agua
H1
A) 3 B) 1
H2O2 Cr2O27 Cr3 O2 1 3
C) D)
2
3 2
Los coeficientes del agua, Cr2O7 2
E)
y H1 en la ecuación balanceada, 3
son respectivamente.
A) 1; 3; 8 B) 7; 1; 8 22. Indicar el número de electrones
C) 1; 3; 14 D) 3; 1; 8 transferidos y la suma de
E) 3; 1; 14 coeficientes de ión H1 y de agua.
As2S3 NO13 AsO34 SO2 NO2
20. Al balancear en medio ácido:
A) 30 y 35 B) 22 y 28
I. Cr2O72 NO12 Cr3 NO13
C) 16 y 24 D) 22 y 24
II. N2O4 Br1 NO12 BrO13 E) 20 y 18
Se puede afirmar que el número
de proposiciones correctas es:
- En I transfieren 6 electrones y en
II 3 electrones.
- La suma de los coeficientes de
agua es 7.
- Los coeficientes de los agentes
oxidantes son 1 y 3
respectivamente.
SAN MARCOS 2018 CUESTIONARIO DESARROLLADO
UNMSM QUIMICA
23. Balancear la siguiente ecuación:
1
MnO14 CH3OH
OH
MnO2 HCO12
Determinar la suma de
coeficientes.
A) 15 B) 17
C) 19 D) 21
E) 23
SAN MARCOS 2018 CUESTIONARIO DESARROLLADO
También podría gustarte
- BalanceDocumento4 páginasBalanceEdwis Castañeda VelásquezAún no hay calificaciones
- QuimicaDocumento9 páginasQuimicaeudy99Aún no hay calificaciones
- Semana 09-Reacciones Quimicas-Transferencia - CienciasDocumento3 páginasSemana 09-Reacciones Quimicas-Transferencia - CienciasLALESHKA JACQUELINE CRUZ GONZALESAún no hay calificaciones
- Material Química 05 (Claves)Documento5 páginasMaterial Química 05 (Claves)Jhennsi Carlos JaureguiAún no hay calificaciones
- Qui - S9 IiDocumento7 páginasQui - S9 IiWalsen Helian Evangelista VidalAún no hay calificaciones
- Cuadernillo-20220102 082158UOZyDocumento3 páginasCuadernillo-20220102 082158UOZyYuliana yanelaAún no hay calificaciones
- Balance oDocumento4 páginasBalance oEdwis Castañeda VelásquezAún no hay calificaciones
- Paralelo RQ B 30.11Documento5 páginasParalelo RQ B 30.11Alexis Terrones GuzmánAún no hay calificaciones
- Del Colegio A La Universidad!!: Taller de Repaso Reacciones RedoxDocumento2 páginasDel Colegio A La Universidad!!: Taller de Repaso Reacciones RedoxyoryanfabianAún no hay calificaciones
- REPASO 4-QuimicaDocumento7 páginasREPASO 4-QuimicaLeidy Torres MedranoAún no hay calificaciones
- Reacciones Químicas 2 (P)Documento3 páginasReacciones Químicas 2 (P)GIMEL AMERICO ABANTO ALAYOAún no hay calificaciones
- Repaso Total-SkinnerDocumento3 páginasRepaso Total-SkinnerJimmy ruben Calle reyesAún no hay calificaciones
- Q Sem25Documento3 páginasQ Sem25Oliver DuxAún no hay calificaciones
- Balance de Ecuaciones.Documento1 páginaBalance de Ecuaciones.cesar ayala canchariAún no hay calificaciones
- Av-Práctica de Química 03 (Reacciones Químicas y Unidades Químicas)Documento4 páginasAv-Práctica de Química 03 (Reacciones Químicas y Unidades Químicas)Vale OliveraAún no hay calificaciones
- practica del 21 de diciembreDocumento2 páginaspractica del 21 de diciembreAcademia JOHN NEPERAún no hay calificaciones
- QuímicaDocumento5 páginasQuímicaQuimica Tecnologia100% (1)
- Practica Quimica Revisiom v2Documento12 páginasPractica Quimica Revisiom v2Carlos Morales JuarezAún no hay calificaciones
- Reacciones RedoxDocumento4 páginasReacciones RedoxHelen Ramos CcAún no hay calificaciones
- Seminario de Quimica (San Marcos 2018-I) - 1Documento5 páginasSeminario de Quimica (San Marcos 2018-I) - 1Darly Esthefany Huisa FernandezAún no hay calificaciones
- Asesoría - 23 I QUIMICA-Athenas 2021-IIDocumento28 páginasAsesoría - 23 I QUIMICA-Athenas 2021-IIErick FrancoAún no hay calificaciones
- (Invierno) Práctica #08 Reacciones Químicas CEPUDocumento2 páginas(Invierno) Práctica #08 Reacciones Químicas CEPUNelson GonzalesAún no hay calificaciones
- Teoria de Balanceo de Ecuaciones 3° CVMDocumento2 páginasTeoria de Balanceo de Ecuaciones 3° CVMWaldo Lino Palma SorianoAún no hay calificaciones
- Teoria de Balanceo de Ecuaciones 3° CVMDocumento2 páginasTeoria de Balanceo de Ecuaciones 3° CVMWaldo Lino Palma SorianoAún no hay calificaciones
- Balanceo Reacciones Masa MolarDocumento3 páginasBalanceo Reacciones Masa MolarAcademia FermatAún no hay calificaciones
- QUIMICADocumento3 páginasQUIMICAthales.secretaria academilaAún no hay calificaciones
- Preguntas de Química para Simulacro - Semana 7 & 8Documento2 páginasPreguntas de Química para Simulacro - Semana 7 & 8Julio cesar Ramos mendoAún no hay calificaciones
- Examen Zonal 2018 Química A BuenoDocumento4 páginasExamen Zonal 2018 Química A BuenoEdrey EspinozaAún no hay calificaciones
- Q_RUNI_Diri_Sem3Documento3 páginasQ_RUNI_Diri_Sem3JOSEPH CARLOS LEON TAIPEAún no hay calificaciones
- QUIMICA I - REPASO PenultDocumento2 páginasQUIMICA I - REPASO PenultXiomara CardenasAún no hay calificaciones
- Semana 09 - Reacciones Químicas - PSDocumento4 páginasSemana 09 - Reacciones Químicas - PSDanithza LimaAún no hay calificaciones
- Repaso Quimica LunesDocumento2 páginasRepaso Quimica LunesEdson Luis Egusquiza Cordova100% (1)
- Reacciones redox balanceadas en medio ácidoDocumento4 páginasReacciones redox balanceadas en medio ácidoAlexander UracahuaAún no hay calificaciones
- Adicional Tema Viii Reacciones QuímicasDocumento12 páginasAdicional Tema Viii Reacciones QuímicasMatias EncisoAún no hay calificaciones
- Teste de EvaluaciónDocumento5 páginasTeste de EvaluaciónValenzuela C PazAún no hay calificaciones
- ESTEQIMETRIA TRECENTO GCDocumento2 páginasESTEQIMETRIA TRECENTO GCBryan O.VAún no hay calificaciones
- Qui S9Documento6 páginasQui S9Walsen Helian Evangelista VidalAún no hay calificaciones
- Transferencia Semana 08 Ciencias Cepunt 2023 - IDocumento3 páginasTransferencia Semana 08 Ciencias Cepunt 2023 - ICharles Gustavo Rojas RomeroAún no hay calificaciones
- Cuadernillo-20210307 132316sbuiDocumento3 páginasCuadernillo-20210307 132316sbuiGustavo CanasaAún no hay calificaciones
- Quimica 2B Vers14 Y 10Documento8 páginasQuimica 2B Vers14 Y 10Miguel RiofrioAún no hay calificaciones
- semana 7Documento8 páginassemana 7Kevin Barreto UrbinaAún no hay calificaciones
- Ver Uni Qu S6 VCDocumento5 páginasVer Uni Qu S6 VCJunHa ContCasAún no hay calificaciones
- Ion - ElectronDocumento2 páginasIon - ElectronKarla Pyerina TUMI CALSINAún no hay calificaciones
- Semana 7Documento8 páginasSemana 7Anonymous 7za15o0100% (1)
- Quìmica 2do Bim VRS 7Documento6 páginasQuìmica 2do Bim VRS 7Miguel RiofrioAún no hay calificaciones
- UNI Química Reacciones Químicas II Práctica Dirigida Semana 25 2021Documento2 páginasUNI Química Reacciones Químicas II Práctica Dirigida Semana 25 2021WiloAún no hay calificaciones
- Sem 05 Quimica ChininDocumento2 páginasSem 05 Quimica ChininMayra FernándezAún no hay calificaciones
- Reacciones Químicas - PrácticaDocumento1 páginaReacciones Químicas - PrácticaLea FloresAún no hay calificaciones
- Tema 5 Balance de Ecuaciones RedoxDocumento4 páginasTema 5 Balance de Ecuaciones RedoxYeawipipixdAún no hay calificaciones
- Las Fijas - Quimica - 1 - Real MontessoriDocumento2 páginasLas Fijas - Quimica - 1 - Real MontessoriCutipa Cama Vianca Mishel BenitaAún no hay calificaciones
- Repaso 04 IntensivoDocumento3 páginasRepaso 04 IntensivoKatherine N. SauñeAún no hay calificaciones
- Practica Reacciones QuimicasDocumento7 páginasPractica Reacciones QuimicasEdwis Castañeda VelásquezAún no hay calificaciones
- Señale La Proposición IncorrectaDocumento5 páginasSeñale La Proposición IncorrectaRaul Angel ValdiviaAún no hay calificaciones
- Ejercicios de química general y nomenclaturaDocumento4 páginasEjercicios de química general y nomenclaturaBianca SilvaAún no hay calificaciones
- Copia de QUÍMICA - 10 - SEMESTRAL - INTENSIVODocumento6 páginasCopia de QUÍMICA - 10 - SEMESTRAL - INTENSIVOaalatrista622Aún no hay calificaciones
- Quimica Sem8 Reacciones QuímicasDocumento3 páginasQuimica Sem8 Reacciones QuímicasBEST JIMINISTAAún no hay calificaciones
- Mini Ensayo Psu QuimicaDocumento10 páginasMini Ensayo Psu QuimicaAllison BecerraAún no hay calificaciones
- Guia QuimicaDocumento7 páginasGuia QuimicairnaimadAún no hay calificaciones
- Redox - Ion Electron - Taller 20-05-16Documento3 páginasRedox - Ion Electron - Taller 20-05-16Lucero PinedoAún no hay calificaciones
- Sesion 12 - Ordenamiento de Enunciados 2021Documento7 páginasSesion 12 - Ordenamiento de Enunciados 2021Héctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Sem 10 - SINÓNIMOS Y ANTÓNIMOSDocumento6 páginasSem 10 - SINÓNIMOS Y ANTÓNIMOSHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 3 RMDocumento9 páginasSemana 3 RMHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 4 RMDocumento15 páginasSemana 4 RMJhoel Eusebio Parraga IsidroAún no hay calificaciones
- Semana 9.RVDocumento13 páginasSemana 9.RVHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Libro de Lázaro Lógica 1Documento204 páginasLibro de Lázaro Lógica 1Héctor Eduardo Urquiaga Cabrera71% (7)
- Semana 16 RVDocumento15 páginasSemana 16 RVHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 10 - Sinónimos y AntónimosDocumento14 páginasSemana 10 - Sinónimos y AntónimosHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Lenguaje Semana 4 CSDocumento4 páginasLenguaje Semana 4 CSHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 12.RVDocumento13 páginasSemana 12.RVHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 4 RMDocumento15 páginasSemana 4 RMJhoel Eusebio Parraga IsidroAún no hay calificaciones
- Semana 3 RMDocumento9 páginasSemana 3 RMHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Lógica: Objeto de estudio, principios y áreas de la lógicaDocumento142 páginasLógica: Objeto de estudio, principios y áreas de la lógicaJuan Adolfo Nicasio Santillan0% (1)
- Unmsm Teoria Aptitud Matemática 1Documento113 páginasUnmsm Teoria Aptitud Matemática 1Héctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 16 RVDocumento15 páginasSemana 16 RVHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 15 RVDocumento12 páginasSemana 15 RVHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- BIOILOGIA Semana 16Documento4 páginasBIOILOGIA Semana 16Héctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 15 RVDocumento12 páginasSemana 15 RVHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Preguntas de Sistema Nervioso 2Documento5 páginasPreguntas de Sistema Nervioso 2mercikatAún no hay calificaciones
- Biologia Semana 12Documento6 páginasBiologia Semana 12Héctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 8 RMDocumento17 páginasSemana 8 RMHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Biologia Semana 12Documento6 páginasBiologia Semana 12Héctor Eduardo Urquiaga CabreraAún no hay calificaciones
- SEMANA 14lenguajeDocumento3 páginasSEMANA 14lenguajeHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Preguntas de Sistema Nervioso 2Documento5 páginasPreguntas de Sistema Nervioso 2mercikatAún no hay calificaciones
- Problemas de móviles en diferentes sentidos con menos deDocumento21 páginasProblemas de móviles en diferentes sentidos con menos deHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- GEOMETRIA 4º Semana CSDocumento9 páginasGEOMETRIA 4º Semana CSHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- FISICA 4º SEMANA CS - Doc0Documento11 páginasFISICA 4º SEMANA CS - Doc0Héctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Problemas de móviles en diferentes sentidos con menos deDocumento21 páginasProblemas de móviles en diferentes sentidos con menos deHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Semana 11.quimicaDocumento4 páginasSemana 11.quimicaHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- GEOMETRIA 7º Semana CSDocumento9 páginasGEOMETRIA 7º Semana CSHéctor Eduardo Urquiaga CabreraAún no hay calificaciones
- Procesamiento e interpretación de SEVs utilizando softwareDocumento7 páginasProcesamiento e interpretación de SEVs utilizando softwarePaul SoriaAún no hay calificaciones
- Huesos de la cara: Maxilar superiorDocumento18 páginasHuesos de la cara: Maxilar superiorKarenAún no hay calificaciones
- Informe de Gestión Mgs. Joan CastroDocumento10 páginasInforme de Gestión Mgs. Joan CastroJoan CastroAún no hay calificaciones
- Cancer OcupacionalDocumento2 páginasCancer OcupacionalzairaAún no hay calificaciones
- Guia 1° Medio OidoDocumento10 páginasGuia 1° Medio OidoCarlosArnoldoManzanoAvelloAún no hay calificaciones
- Tarea 3Documento1 páginaTarea 3Jorge Hernández0% (1)
- La Razón de Mariátegui - El Diario de Un SocialistaDocumento14 páginasLa Razón de Mariátegui - El Diario de Un SocialistaAndrés LópezAún no hay calificaciones
- DS 1939 - 20140319 - Reglamenta La Ley 448 - Componentes Del Programa Nacional de Frutas, Hortalizas, RUMIANTES MENORES y PescaDocumento7 páginasDS 1939 - 20140319 - Reglamenta La Ley 448 - Componentes Del Programa Nacional de Frutas, Hortalizas, RUMIANTES MENORES y PescaJuan MontalvoAún no hay calificaciones
- Dosaje EtilicoDocumento6 páginasDosaje EtilicoStefania MorochoAún no hay calificaciones
- Taller de Matematica Con FosforosDocumento31 páginasTaller de Matematica Con FosforosJavier100% (1)
- Trabajo Final LoggiDocumento73 páginasTrabajo Final LoggiMariana Shiary Saldivar BendezúAún no hay calificaciones
- Cuestionario Disco DuroDocumento2 páginasCuestionario Disco Durodaniel gonzalesAún no hay calificaciones
- Informe DiseñoDocumento10 páginasInforme Diseñoalixander garciaAún no hay calificaciones
- TRILLAS Catalogo Artes y Oficios Sept2016 PDFDocumento19 páginasTRILLAS Catalogo Artes y Oficios Sept2016 PDFVicente Banda ZuñigaAún no hay calificaciones
- Intensidad de Campo EléctricoDocumento24 páginasIntensidad de Campo EléctricoAndrés Alejandro Martínez GuerreroAún no hay calificaciones
- Métodos MatematicosDocumento4 páginasMétodos MatematicosÓscar AlvaradoAún no hay calificaciones
- Introducción Al PROMODELDocumento36 páginasIntroducción Al PROMODELhectorsimula100% (3)
- Flujograma de ProcesosDocumento9 páginasFlujograma de ProcesosAlcides ChanaAún no hay calificaciones
- Corte 7 Hector Lopez Etapa 5Documento2 páginasCorte 7 Hector Lopez Etapa 5camila corredorAún no hay calificaciones
- Actividad de Puntos Evaluables Escenario 2 Primer Bloque Teorico Psicologia Educativa Grupo b02Documento7 páginasActividad de Puntos Evaluables Escenario 2 Primer Bloque Teorico Psicologia Educativa Grupo b02KevinCifuentesAún no hay calificaciones
- Cómo tratar hematomas y moretonesDocumento4 páginasCómo tratar hematomas y moretonesKevin Andres Briñez RodriguezAún no hay calificaciones
- 3 Tejidos Parenquim-Ticos PDFDocumento7 páginas3 Tejidos Parenquim-Ticos PDFFacundo DominguezAún no hay calificaciones
- El Otro SenderoDocumento337 páginasEl Otro SenderoJuanpablo Arescuerenaga100% (1)
- Carros NuevosDocumento6 páginasCarros NuevosAndres Moreno SandovalAún no hay calificaciones
- 01 El Oficio Del Productor MusicalDocumento34 páginas01 El Oficio Del Productor MusicalFernando OrtegaAún no hay calificaciones
- Compra de Verduras 11.03.2023Documento2 páginasCompra de Verduras 11.03.2023cintiaAún no hay calificaciones
- Matematica AnexoDocumento2 páginasMatematica AnexoOmar Valentin Zevallos CerpaAún no hay calificaciones
- Inmobiliaria y Construcciones Kaza EirlDocumento8 páginasInmobiliaria y Construcciones Kaza EirlElizabeth HuarotoAún no hay calificaciones
- Contrato de Arrendamiento PardoDocumento6 páginasContrato de Arrendamiento PardoPedroJulioBlancoDelgadoAún no hay calificaciones
- Manual de Seguridad e Higiene - AnkyDocumento11 páginasManual de Seguridad e Higiene - AnkyAngel FuentesAún no hay calificaciones