Documentos de Académico
Documentos de Profesional
Documentos de Cultura
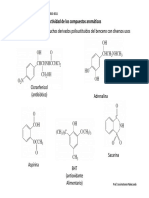
Reactividad Benceno Aqo
Cargado por
Antonio José González ParejaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Reactividad Benceno Aqo
Cargado por
Antonio José González ParejaCopyright:
Formatos disponibles
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Reactividad de los compuestos aromáticos
Los compuestos aromáticos tienen una reactividad especial debida a su estabilidad y
a la nube de electrones que tienen por arriba y por abajo.
Por ello su reactividad característica es la de reaccionar con electrófilos, en
reacciones de sustitución, que se denominan de sustitución electrofílica aromática
SEAr
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
El ataque al electrófilo deja un carbocatión, igual que en los alquenos.
Este catión (intermedio de Wheland) está estabilizado por resonancia
+ +
Pero no es aromático. Luego es menos estable que el producto de partida
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Si reaccionara como un alqueno:
+
Z-
No aromático
Pero si sufre una eliminación:
+
Z-
+ HZ
Aromático
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Esto se puede representar así:
Luego la primera etapa es lenta y la segunda rápida
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
La reacción general es:
Y se denomina Sustitución Electrofílica aromática. SEAr
Las reacciones y los electrófilos (Y+) más comunes son:
- Halogenación (Br+, Cl+, I+)
- Nitración (NO2+)
- Sulfonación (SO3H+)
+
- Acilación de Friedel-Craft ( )
- Alquilación de Friedel-Craft (R+)
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
La diferencia entre estas reacciones es la generación del electrófilo
Halogenación Se requiere un ácido de Lewis (por ejemplo FeCl3)
Bromación
Bromobenceno
Cloración
Clorobenceno
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
El ácido de Lewis acepta un par de electrones del halógeno, lo que debilita el enlace
Ahora el anillo aromático puede atacar a este electrófilo
El ácido de Lewis se regenera (catalizador)
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Para la iodación, el iodo electrofílico se prepara con iodo en condiciones de oxidación
Iodobenceno
El agente oxidante puede ser el ácido nítrico
El mecanismo es el mismo
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Nitración
Nitrobenceno
La reacción entre el nítrico (que actúa como base) y el sulfúrico (que actúa como ácido) da:
Ac. Nítrico Ac. Sulfúrico Ión Nitronio
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Zona muy electrófila
La mezcla nítrico/sulfúrico se denomina mezcla nitrante
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Sulfonación
Acido bencenosulfónico
Se utiliza sulfúrico fumante, una disolución de SO3 en ácido sulfúrico.
También se puede generar el electrófilo calentando sulfúrico:
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Por el mecanismo de la SEAr:
Los ácidos sulfónicos son ácidos bastante fuertes, ya que al ceder el protón, queda un
anión muy estabilizado
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
La sulfonación es una reacción reversible:
El mecanismo es el inverso de la sulfonación
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Reacciones de Friedel-Craft
Francia (La Sorbona) Estados Unidos (MIT)
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Acilación de Friedel-Craft
En esta reacción, el electrófilo se puede preparar a partir de un cloruro de ácido o de
un anhídrido
Cloruro de ácido
Anhídrido
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
A partir de cloruro de ácido, el electrófilo (ión acilio) se forma con la ayuda de un ácido
de Lewis, generalmente tricloruro de aluminio.
Ión acilio
Y luego, el mismo mecanismo
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Es necesario usar exceso de ácido de Lewis, porque el carbonilo del producto final
atrapa parte, ya que es una base de Lewis
Al final de la reacción, hay que añadir agua para liberar el producto del complejo
Con un anhídrido la generación del acilio es similar
+ AlCl3
+ + +
- -
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Alquilación de Friedel-Craft
El electrófilo se forma por tratamiento de un haluro de alquilo con un ácido de Lewis
Y luego el mecanismo de SEAr
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Como tenemos un catión alquílico, pueden darse reagrupamientos para generar el catión
más estable:
1-fenilbutano 2-fenilbutano
35% 65%
Carbocatión secundario
Carbocatión primario Más estable
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
En realidad, no se forman los carbocationes primarios, sino que el electrófilo es el
complejo con el ácido de Lewis (catión incipiente)
Se dibujan los carbocationes por simplicidad.
Por eso no se reagrupan del todo. Depende de la estabilidad relativa y de la fuerza de
la atracción entre el ácido de Lewis y el reactivo.
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
En general, si formamos un carbocatión en presencia de benceno, se dará una reacción
de alquilación.
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Hemos visto que la reacción con haluros de alquilo primarios da el producto reagrupado
mayoritario minoritario
¿Cómo preparamos el minoritario en buen rendimiento?
Combinando una acilación con una reducción
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Existen distintos métodos de hacer la reducción:
Tener distintos métodos es importante para moléculas más complejas, ya que cada
método tiene sus características (medio ácido, básico…) y será compatible con unos
compuestos o con otros.
Prof. José Antonio Palenzuela
Química Orgánica de Farmacia, Grupo B, curso 2010-2011
Información general
Existen métodos más modernos (y complejos) para preparar derivados del benceno.
Un ejemplo son los acoplamientos catalizados por paladio.
A los descubridores de estas reacciones les dieron el Premio Nobel de Química 2010.
"Pd"
+
Heck
"Pd"
+
Negishi
"Pd"
+
Suzuki
Prof. José Antonio Palenzuela
También podría gustarte
- Glosario de Cosmetologia PDFDocumento64 páginasGlosario de Cosmetologia PDFana montagneAún no hay calificaciones
- Clase 3-IndicadoresDocumento24 páginasClase 3-IndicadoresAntonio José González ParejaAún no hay calificaciones
- Verano Azul-Cap. 2 (E5) - La Sonrisa Del Arco IrisDocumento58 páginasVerano Azul-Cap. 2 (E5) - La Sonrisa Del Arco IrisAntonio José González ParejaAún no hay calificaciones
- Conf Elec AlumDocumento1 páginaConf Elec AlumAntonio José González ParejaAún no hay calificaciones
- Ejercicios Del Bloque II. 1Documento18 páginasEjercicios Del Bloque II. 1Antonio José González ParejaAún no hay calificaciones
- Clase 6-ReductoresDocumento16 páginasClase 6-ReductoresAntonio José González ParejaAún no hay calificaciones
- FQ2ESODocumento194 páginasFQ2ESOAntonio José González ParejaAún no hay calificaciones
- PR Cticas Reacciones Cocina 2Documento6 páginasPR Cticas Reacciones Cocina 2Antonio José González ParejaAún no hay calificaciones
- Aplic Vol RedoxDocumento12 páginasAplic Vol RedoxAntonio José González ParejaAún no hay calificaciones
- Arquimedes 2 AlumDocumento3 páginasArquimedes 2 AlumAntonio José González ParejaAún no hay calificaciones
- Tema ProbabilidadDocumento28 páginasTema ProbabilidadAntonio José González ParejaAún no hay calificaciones
- Isomeria Change MetaDocumento3 páginasIsomeria Change MetaAntonio José González ParejaAún no hay calificaciones
- 2q082las-Pilas Change MetaDocumento6 páginas2q082las-Pilas Change MetaAntonio José González ParejaAún no hay calificaciones
- Proyecto de InvestigaciónDocumento1 páginaProyecto de InvestigaciónAntonio José González ParejaAún no hay calificaciones
- Tabla-Periodoca Change MetaDocumento7 páginasTabla-Periodoca Change MetaAntonio José González ParejaAún no hay calificaciones
- DISTANCIAS INACCESIBLES (TRABAJO PRÁCTICO) FDocumento6 páginasDISTANCIAS INACCESIBLES (TRABAJO PRÁCTICO) FAntonio José González ParejaAún no hay calificaciones
- Prob Arom PDFDocumento2 páginasProb Arom PDFAntonio José González ParejaAún no hay calificaciones
- Ejercicios Dominios FuncionesDocumento2 páginasEjercicios Dominios FuncionesAntonio José González ParejaAún no hay calificaciones
- Prob Alquen AlquinDocumento5 páginasProb Alquen AlquinAntonio José González ParejaAún no hay calificaciones
- Nomenclatura RS-qoDocumento11 páginasNomenclatura RS-qoAntonio José González ParejaAún no hay calificaciones
- Inducción de La Indefensión AprendidaDocumento5 páginasInducción de La Indefensión AprendidaAntonio José González ParejaAún no hay calificaciones
- Reactividad Benceno2 QoDocumento24 páginasReactividad Benceno2 QoAntonio José González ParejaAún no hay calificaciones
- Oxidos Del NitrogenoDocumento15 páginasOxidos Del NitrogenoAntonio José González ParejaAún no hay calificaciones
- Alcanos1 - Estructura y ReactividadDocumento37 páginasAlcanos1 - Estructura y ReactividadAntonio José González ParejaAún no hay calificaciones
- Capítulo 2 Enzimas: Figura 1. Estructura de La HoloenzimaDocumento17 páginasCapítulo 2 Enzimas: Figura 1. Estructura de La HoloenzimaDiego NolascoAún no hay calificaciones
- Determinación de Sal y Extracto Seco Total en QuesosDocumento13 páginasDeterminación de Sal y Extracto Seco Total en QuesosRichard MelgarejoAún no hay calificaciones
- Division de La QuimicaDocumento3 páginasDivision de La QuimicaSebas MarquezAún no hay calificaciones
- Examen Final de Recuperacion de QuimicaDocumento3 páginasExamen Final de Recuperacion de QuimicaCÉSAR AUGUSTO RUMICHE AMAYAAún no hay calificaciones
- Ejercicios MolaridadDocumento1 páginaEjercicios MolaridadRaúl CortésAún no hay calificaciones
- Preguntas Quimica - 25añosDocumento9 páginasPreguntas Quimica - 25añosCarla TraficanteAún no hay calificaciones
- Tratamiento de Soluciones, SX-CA-IX, BenaventeDocumento88 páginasTratamiento de Soluciones, SX-CA-IX, Benaventen.nAún no hay calificaciones
- El Mundo de Los PolimerosDocumento41 páginasEl Mundo de Los PolimerosMarisol Mallcco AyalaAún no hay calificaciones
- Determinación de Arsénico en AguasDocumento14 páginasDeterminación de Arsénico en AguasDiego Alexander Hans Muñoz Borja50% (2)
- Arseniuro de GalioDocumento9 páginasArseniuro de GalioGIANCARLO GUISSEPI MOLLEDA CARHUAYAún no hay calificaciones
- 2do Parcial QMC 99Documento1 página2do Parcial QMC 99Misael OrellanoAún no hay calificaciones
- EDTA AnteproyectoDocumento32 páginasEDTA AnteproyectoFernanda Itzel Hernandez CortesAún no hay calificaciones
- Guía de Ejercicios EstequiometriaDocumento2 páginasGuía de Ejercicios EstequiometriaEmmanuel RodriguezAún no hay calificaciones
- Aldehidos y CetonasDocumento18 páginasAldehidos y CetonasGABRIEL ERMILO ORTEGON BAUTISTAAún no hay calificaciones
- Practica1 - Cuestionario y Diagramas ExperimentalesDocumento9 páginasPractica1 - Cuestionario y Diagramas ExperimentalesBettyCSAún no hay calificaciones
- Informe Lab 3 ElectroquimicaDocumento18 páginasInforme Lab 3 ElectroquimicaAlexander Colque TorresAún no hay calificaciones
- Practica 5Documento39 páginasPractica 5lady hanaAún no hay calificaciones
- Elementos BiogenésicosDocumento30 páginasElementos BiogenésicosMaría Alejandra Molina ParedesAún no hay calificaciones
- Taller Compuestos AromaticosDocumento3 páginasTaller Compuestos AromaticosAnonymous GdWMlV46bUAún no hay calificaciones
- Informe n6Documento5 páginasInforme n6Maria MendozaAún no hay calificaciones
- Qui MicaDocumento4 páginasQui MicaLuis Fernando Mamani RamosAún no hay calificaciones
- Planta de Llenado de Agua Purificada Santa Barbara Vida H2oDocumento9 páginasPlanta de Llenado de Agua Purificada Santa Barbara Vida H2oCHIFFLES ANDINOSAún no hay calificaciones
- Tema 14: Flujo de Energía en EcosistemasDocumento6 páginasTema 14: Flujo de Energía en EcosistemasROJAS VICENTE LUIS ALBERTOAún no hay calificaciones
- Formato Informe Síntesis Del K (CR (C2O4) 2 (H2O) ) .3H2ODocumento5 páginasFormato Informe Síntesis Del K (CR (C2O4) 2 (H2O) ) .3H2OGabriel TipantuñaAún no hay calificaciones
- Ejercicios de Análisis GravimétricoDocumento1 páginaEjercicios de Análisis GravimétricoRosmery GonzalesAún no hay calificaciones
- Guía Del Laboratorio 3.cambio Físico y Cambio QuímicoDocumento15 páginasGuía Del Laboratorio 3.cambio Físico y Cambio QuímicoRoosvelt Antonio Palomino ChucoAún no hay calificaciones
- Analisis Elemental CualitativoDocumento6 páginasAnalisis Elemental CualitativoCRISTIAN ANDRES LEDESMA CAÑONAún no hay calificaciones
- Ficha Tecnica y Certificado Microesfera de VidrioDocumento2 páginasFicha Tecnica y Certificado Microesfera de VidrioPasion Argentina EliuAún no hay calificaciones
- Semana 7 - AlquinosDocumento42 páginasSemana 7 - AlquinosLuis Moreno MenachoAún no hay calificaciones