Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Q P2 J120 Allan Jonathan Alan Carlos
Q P2 J120 Allan Jonathan Alan Carlos
Cargado por
Allan HernándezCopyright:
Formatos disponibles
También podría gustarte
- Procesos de Procesamiento de SuperficiesDocumento42 páginasProcesos de Procesamiento de SuperficiesJulio MolinaAún no hay calificaciones
- Desorden Alimenticio 2Documento48 páginasDesorden Alimenticio 2Allan HernándezAún no hay calificaciones
- Desorden AlimenticioDocumento39 páginasDesorden AlimenticioAllan HernándezAún no hay calificaciones
- Desorden AlimenticioDocumento39 páginasDesorden AlimenticioAllan HernándezAún no hay calificaciones
- ADN EmprendedorDocumento1 páginaADN EmprendedorAllan HernándezAún no hay calificaciones
- Tarea de Sociologia PDFDocumento27 páginasTarea de Sociologia PDFAllan HernándezAún no hay calificaciones
- Infografia 1 PDFDocumento11 páginasInfografia 1 PDFAllan Hernández100% (1)
- Infografia 3Documento13 páginasInfografia 3Allan HernándezAún no hay calificaciones
- Tarea 3.2Documento6 páginasTarea 3.2Allan HernándezAún no hay calificaciones
- Tarea 1Documento7 páginasTarea 1Allan HernándezAún no hay calificaciones
- 7.-Diseño de MesclasDocumento15 páginas7.-Diseño de MesclasEDGARAún no hay calificaciones
- Ensayos No Destructivos en El Mantenimiento IndustrialDocumento14 páginasEnsayos No Destructivos en El Mantenimiento IndustrialAngel Bohórquez Cueva100% (1)
- Presentaci N Rea de Termofluidos para La Asignatura SEMINARIO de TITULACI N 2 0Documento4 páginasPresentaci N Rea de Termofluidos para La Asignatura SEMINARIO de TITULACI N 2 0Hugo Sepulveda MuñozAún no hay calificaciones
- Ahogarse en Un Vaso de Agua - Spanish Lesson - Meaning and ContextDocumento7 páginasAhogarse en Un Vaso de Agua - Spanish Lesson - Meaning and ContextAgnieszka KołodziejczakAún no hay calificaciones
- PROBLEMA Circunferencia AsiloDocumento2 páginasPROBLEMA Circunferencia AsiloPeter Slip33% (3)
- PFC P 51Documento276 páginasPFC P 51Arturo PalaciosAún no hay calificaciones
- Sistema de Encendido HallDocumento9 páginasSistema de Encendido HallSantiago Chamakito AnrangoAún no hay calificaciones
- Semana 05 - Segunda Ley Termodinamica 2018-1Documento59 páginasSemana 05 - Segunda Ley Termodinamica 2018-1Edgar Santillan TrigosoAún no hay calificaciones
- HOSCLIMA S02 Material Montaje y AislamientoDocumento74 páginasHOSCLIMA S02 Material Montaje y AislamientoaceitepcbAún no hay calificaciones
- Conducción de Calor Transitorio 1d Programa Matlab Metodo ExplicitoDocumento5 páginasConducción de Calor Transitorio 1d Programa Matlab Metodo ExplicitoWalter Ivan Salazar SuarezAún no hay calificaciones
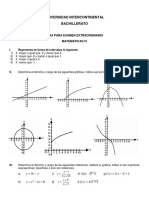
- Guia de Examen Extraordinario Mate IVDocumento6 páginasGuia de Examen Extraordinario Mate IVMartin Gustavo Sanchez ReynosoAún no hay calificaciones
- Curso de Liofilizacion1Documento3 páginasCurso de Liofilizacion1Jorge Rivera100% (1)
- Coal-Tar Epoxico C200 PDFDocumento3 páginasCoal-Tar Epoxico C200 PDFMiguel YanezAún no hay calificaciones
- Elevador de CangilonesDocumento6 páginasElevador de CangilonesYilmar VenturaAún no hay calificaciones
- Manual de GrafologíaDocumento25 páginasManual de GrafologíaMery PumaAún no hay calificaciones
- Componentes Del Hormigon ProyectadoDocumento12 páginasComponentes Del Hormigon ProyectadoDenys QuispeAún no hay calificaciones
- Laboratorio 2 EletrotecniaDocumento9 páginasLaboratorio 2 EletrotecniaBrenda MiriamAún no hay calificaciones
- Gases Nobles o Gases InertesDocumento11 páginasGases Nobles o Gases InertesJose EmmanuelAún no hay calificaciones
- Conclusión, Bibliografia y GlosarioDocumento2 páginasConclusión, Bibliografia y GlosariodayanaAún no hay calificaciones
- Trane TVR II SistemasDocumento48 páginasTrane TVR II Sistemaschl777Aún no hay calificaciones
- Formulario Certamen 1 de Mecanica GeneralDocumento4 páginasFormulario Certamen 1 de Mecanica GeneralEduardo PerezAún no hay calificaciones
- Silabo de R1-2015-ADocumento7 páginasSilabo de R1-2015-AHugo A Bravo MascaróAún no hay calificaciones
- Transcripciones Biancardi Neurociencias PDFDocumento113 páginasTranscripciones Biancardi Neurociencias PDFRodrigoo DíazAún no hay calificaciones
- Cristales de AZUCARDocumento2 páginasCristales de AZUCARdaniAún no hay calificaciones
- 11 Forensic Analysis - Analisys Forense - RepairedDocumento19 páginas11 Forensic Analysis - Analisys Forense - RepairedGalaxia PirataAún no hay calificaciones
- Inducción Seguridad 2Documento9 páginasInducción Seguridad 2CHARLOTHYAún no hay calificaciones
- FlavonoidesDocumento20 páginasFlavonoideslucero_147755007Aún no hay calificaciones
Q P2 J120 Allan Jonathan Alan Carlos
Q P2 J120 Allan Jonathan Alan Carlos
Cargado por
Allan HernándezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Q P2 J120 Allan Jonathan Alan Carlos
Q P2 J120 Allan Jonathan Alan Carlos
Cargado por
Allan HernándezCopyright:
Formatos disponibles
“Propiedades de los Compuestos”
Laboratorio de Química
Instructores: Wilfredo Lontero, Alejandra López
Alan Hernández (21611158)
Jonathan Jiménez (21611157)
Allan Díaz (21741042)
Carlos Bustamante (21841274)
San Pedro Sula, Cortes
24 de octubre del 2019
Propiedades de los Compuestos Laboratorio de Química 2
1.
Introducción
Cada sustancia tiene un conjunto de propiedades que son sus características propias y le dan
una identidad exclusiva. Estas propiedades se clasifican como propiedades químicas y físicas.
Las propiedades físicas son las características inherentes de una sustancia que se pueden
determinar sin alterar su composición. Algunas propiedades físicas comunes son el color,
olor, punto de ebullición y densidad. Ciertas propiedades físicas pueden observarse sin la
ayuda de aparatos de laboratorio, tales como el color y el olor donde sólo se requiere de los
sentidos para poder determinarlas. Para poder determinar otras propiedades como el punto
de ebullición y a la densidad se requiere utilizar instrumentos de laboratorio. Durante el
desarrollo de la práctica aprenderemos a determinar el punto de ebullición y la densidad de
dos sustancias líquidas comunes.
Allan, Jonathan, Alan, Carlos
Propiedades de los Compuestos Laboratorio de Química 2
2.
Objetivos de la Experiencia
1) Obtener conocimientos básicos de cómo realizar la determinación del punto de
ebullición en compuestos líquidos.
2) Obtener los conocimientos para poder determinar la densidad de compuestos líquidos.
3) Saber sobre el punto de ebullición de ciertos líquidos y conocer sobre la fórmula de
densidad.
Allan, Jonathan, Alan, Carlos
Propiedades de los Compuestos Laboratorio de Química 2
3.
Resumen de trabajo Realizado
Primero trabajamos con el experimento #1 en el cual teníamos que diferenciar
entre dos sustancias. Teníamos que notar su olor y color.
También en otro experimento medimos lo que es el punto de ebullición de un
líquido. Esto se pudo hacer de la siguiente manera:
El sistema se coloca en un baño de aceite. Encienda y ajuste un mechero para
que obtenga una llama azul. Se calienta gradualmente (2-3 °C/min) hasta que
del capilar se desprenda un rosario continuo de burbujas. En seguida se
suspende el calentamiento y en el instante en que el líquido entre por el capilar
se lee la temperatura de ebullición.
En esta práctica aprendimos sobre el conjunto de propiedades de las sustancias
y que se clasifican en físicas y químicas. Identificamos características físicas
comunes como olor y color del alcohol y acetona. Aprendimos a encontrar el
punto de ebullición y densidad de sustancias y estas también son propiedades
físicas.
Allan, Jonathan, Alan, Carlos
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
4.
Reporte de Datos y Cálculos
Experimento 1
Liquido color olor sustancia
Liquido 1 incoloro alcohol acetona
Liquido 2 incoloro alcohol alcohol
Experimento 2
Masa(g) Densidad (g/ml)
Masa probeta 1 120.3g
Masa probeta + liquido 145.2g 0.83g/ml
1,30ml
Masa probeta + liquido 161.5g 0.83g/ml
1,50ml
Masa probeta + liquido 182.5g 0.83g/ml
1,75ml
Densidad promedio liquido 1 0.82g/ml
Masa(g) Densidad (g/ml)
Masa probeta 2 136.2g
Masa probeta + liquido 159g 0.76g/ml
1,30ml
Masa probeta + liquido 175.7g 0.79g/ml
1,50ml
Masa probeta + liquido 195.4g 0.70g/ml
1,75ml
Densidad promedio liquido 2 0.77g/ml
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
5.
Liquido 1
Tiempo (minutos) Temperatura (C)
0 25
1 30
2 60
2.40 65
Liquido 2
Tiempo (minutos) Temperatura (C)
0.26 0
1 25
2 34
3 37
4 71
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
6.
Análisis de Resultados
En el experimento III pudimos ver el punto de ebullición de cada liquido. Y se pudo
comprobar los resultados que la guía mostraba
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
7.
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
8.
Conclusiones
Obtuvimos conocimientos básicos de cómo realizar la determinación del
punto de ebullición en compuestos líquidos.
Comprendimos como determinar la densidad de los fluidos utilizados.
Conocimos la diferencia entre propiedades físicas y propiedades químicas de
sustancias.
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
9.
Bibliografía
(2019). Retrieved 31 October 2019, from https://brainly.lat/
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
10.
Anexos
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
11.
¿Cómo influye la presencia de impurezas solubles en el punto de ebullición?
Lo hace aumentar ya que las moléculas que deberían separarse lo suficiente para
formar el gas, están "ocupadas" solventando a las impurezas, entonces tendrás
que entregarle más energía para lograrlo.
¿Por qué la presión atmosférica influye sobre el punto de ebullición?
Porque el punto de ebullición es la temperatura a la cual la presión de vapor del líquido
iguala a la presión atmosférica. Por tanto, si la presión atmosférica es menor o mayor a 1
atm (condiciones normales), entonces el punto de ebullición variará de la misma forma. Si
por ejemplo, la presión atmosférica es mayor a 1atm, (el agua bulle a 100°C, a 1atm de
presión) entonces el agua tendrá un mayor punto de ebullición, quiere decir que necesita
mas temperatura para aumentar su presión de vapor e igualarse a la presión atmosférica.
¿Dónde se cocinará más rápido un huevo?:
• en el Himalaya (p = 300 torr),
• en la luna (patm = 20 torr) o
• en Bogotá (patm = 560 torr) Explique su respuesta.
Entonces donde se cocinaría más rápido seria en BOGOTA. Por otra parte, los compuestos
más ligeros se evaporan a menor temperatura que los más pesados. Siguiendo esta regla,
sabiendo que el peso molecular del agua es 18 comparándolo con otras sustancias,
deducimos que la temperatura de ebullición del agua debería ser 91º bajo cero y entonces,
a temperatura ambiente no habría agua líquida y, por tanto, no habría vida. Sin embargo,
la temperatura de ebullición del aguaes, por fortuna, bastante mayor: 100ºC
aproximadamente. Esto es así debido a que los átomos de agua están tan fuertemente
unidos que se necesita mucha energía (calor)para separarlas (convirtiéndolas en gas).
¿Por qué los alimentos se cocinan más fácilmente en una olla a presión?
En una olla normal con tapa, los alimentos reciben la presión atmosférica (1 atm), y se
logra una temperatura máxima de ebullición del agua, 100°C.
En una olla de presión, la presión que reciben los alimentos es mayor a la atmosférica
(1 atm), a esta se agrega la presión por la acumulación de vapor de agua y el
aumento en la temperatura de ebullición de 100°C. En un corto tiempo la presión total
equivale a dos atmósferas (2 atm) y se mantiene constante debido a la válvula de
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
12.
seguridad que regula la salida de vapor cuando la presión sobrepasa cierto valor. Es
por esto que se logra un cocimiento más rápido y por tanto un ahorro de energía.
Explique la diferencia entre una propiedad física y una propiedad química, dé
dos ejemplos de cada una de ellas.
Propiedades Físicas
Desde el punto de vista más general, se puede definir a las propiedades físicas
como aquellas que se pueden medir u observar sin alterar la composición de la
sustancia.
Estado físico (sólido líquido o gaseoso).
Olor (dulce, cítrico, entre otros.).
Propiedades Químicas
Las propiedades químicas se pueden definir, desde un punto de vista general como
aquellas que, pueden ser observadas solo cuando una sustancia sufre un cambio en su
composición.
Reactividad (forma en que una sustancia reacciona frente a otra).
Combustión (reacción frente al oxígeno que produce energía en forma de luz
o de calor).
¿La densidad sirve como criterio para establecer la pureza de un líquido? ¿Por qué?
La densidad sirve como criterio de concentración, por ende, con el mismo podemos
saber si un líquido tiene una concentración que permite una pureza o no.
¿Se afecta significativamente la densidad de un líquido con los cambios de temperatura?
¿Con los cambios de presión?
La densidad si que varía con la temperatura, esta disminuye al aumentar la Temperatura y
viceversa; es la principal causa del fenómeno de convección.
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
13.
¿Cómo se determina la densidad de un gas? ¿Qué factores afectan la densidad
de los gases?
Sabemos que la ecuación de los gases es: PV=nRT donde P es la presión de el gas ,
V es el volumen del gas, n son las moles del gas, R es las constante universal de los
gases y T es la temperatura del gas.
Un recipiente de vidrio pesa 25.60 g estando vacío y 35.55 g cuando se llena con
agua a 20 oC. La densidad del agua a esta temperatura es de 0.998 g/cm3.
Cuando se colocan 10.20 g de municiones de plomo en el recipiente y se llena
éste nuevamente con agua a 20 oC, resulta un peso total de 44.83 g. ¿Cuál es la
densidad del plomo?
d H2O = 0.998 g/cm³
1. calcular volumen desplazado: Vdesp. = V2 - V1
V2 = 35.55 g
V1 = 25.60 g
V desp. = 35.55 g - 25.60 g = 9.95 g
2. calcular volumen del agua: d = m/v
V = 9.95 g / 0.998 g/cm³
V = 9.97 cm³
3. calcular masa total ( vaso + plomo): 44.83 g
m total: 44.83 g - 25.60 g = 19.23 g
m agua: 19.23 g - 10.20 g = 9.03 g
Allan, Jonathan, Alan
OPERACIONES SENCILLAS DEL LABORATORIO Laboratorio de Química 1
14.
4. calcular volumen de agua
V = 9.03 g / 0.998 g/cm³
V = 9.05 cm³
5. calcular el volumen desplazado por el plomo:
V desplazado: 9.97 cm³ - 9.05 cm³ = 0.92 cm³
6. calcular la densidad
d = 10.20 g / 0.92 cm³
d = 11.08 g/cm³
Allan, Jonathan, Alan
También podría gustarte
- Procesos de Procesamiento de SuperficiesDocumento42 páginasProcesos de Procesamiento de SuperficiesJulio MolinaAún no hay calificaciones
- Desorden Alimenticio 2Documento48 páginasDesorden Alimenticio 2Allan HernándezAún no hay calificaciones
- Desorden AlimenticioDocumento39 páginasDesorden AlimenticioAllan HernándezAún no hay calificaciones
- Desorden AlimenticioDocumento39 páginasDesorden AlimenticioAllan HernándezAún no hay calificaciones
- ADN EmprendedorDocumento1 páginaADN EmprendedorAllan HernándezAún no hay calificaciones
- Tarea de Sociologia PDFDocumento27 páginasTarea de Sociologia PDFAllan HernándezAún no hay calificaciones
- Infografia 1 PDFDocumento11 páginasInfografia 1 PDFAllan Hernández100% (1)
- Infografia 3Documento13 páginasInfografia 3Allan HernándezAún no hay calificaciones
- Tarea 3.2Documento6 páginasTarea 3.2Allan HernándezAún no hay calificaciones
- Tarea 1Documento7 páginasTarea 1Allan HernándezAún no hay calificaciones
- 7.-Diseño de MesclasDocumento15 páginas7.-Diseño de MesclasEDGARAún no hay calificaciones
- Ensayos No Destructivos en El Mantenimiento IndustrialDocumento14 páginasEnsayos No Destructivos en El Mantenimiento IndustrialAngel Bohórquez Cueva100% (1)
- Presentaci N Rea de Termofluidos para La Asignatura SEMINARIO de TITULACI N 2 0Documento4 páginasPresentaci N Rea de Termofluidos para La Asignatura SEMINARIO de TITULACI N 2 0Hugo Sepulveda MuñozAún no hay calificaciones
- Ahogarse en Un Vaso de Agua - Spanish Lesson - Meaning and ContextDocumento7 páginasAhogarse en Un Vaso de Agua - Spanish Lesson - Meaning and ContextAgnieszka KołodziejczakAún no hay calificaciones
- PROBLEMA Circunferencia AsiloDocumento2 páginasPROBLEMA Circunferencia AsiloPeter Slip33% (3)
- PFC P 51Documento276 páginasPFC P 51Arturo PalaciosAún no hay calificaciones
- Sistema de Encendido HallDocumento9 páginasSistema de Encendido HallSantiago Chamakito AnrangoAún no hay calificaciones
- Semana 05 - Segunda Ley Termodinamica 2018-1Documento59 páginasSemana 05 - Segunda Ley Termodinamica 2018-1Edgar Santillan TrigosoAún no hay calificaciones
- HOSCLIMA S02 Material Montaje y AislamientoDocumento74 páginasHOSCLIMA S02 Material Montaje y AislamientoaceitepcbAún no hay calificaciones
- Conducción de Calor Transitorio 1d Programa Matlab Metodo ExplicitoDocumento5 páginasConducción de Calor Transitorio 1d Programa Matlab Metodo ExplicitoWalter Ivan Salazar SuarezAún no hay calificaciones
- Guia de Examen Extraordinario Mate IVDocumento6 páginasGuia de Examen Extraordinario Mate IVMartin Gustavo Sanchez ReynosoAún no hay calificaciones
- Curso de Liofilizacion1Documento3 páginasCurso de Liofilizacion1Jorge Rivera100% (1)
- Coal-Tar Epoxico C200 PDFDocumento3 páginasCoal-Tar Epoxico C200 PDFMiguel YanezAún no hay calificaciones
- Elevador de CangilonesDocumento6 páginasElevador de CangilonesYilmar VenturaAún no hay calificaciones
- Manual de GrafologíaDocumento25 páginasManual de GrafologíaMery PumaAún no hay calificaciones
- Componentes Del Hormigon ProyectadoDocumento12 páginasComponentes Del Hormigon ProyectadoDenys QuispeAún no hay calificaciones
- Laboratorio 2 EletrotecniaDocumento9 páginasLaboratorio 2 EletrotecniaBrenda MiriamAún no hay calificaciones
- Gases Nobles o Gases InertesDocumento11 páginasGases Nobles o Gases InertesJose EmmanuelAún no hay calificaciones
- Conclusión, Bibliografia y GlosarioDocumento2 páginasConclusión, Bibliografia y GlosariodayanaAún no hay calificaciones
- Trane TVR II SistemasDocumento48 páginasTrane TVR II Sistemaschl777Aún no hay calificaciones
- Formulario Certamen 1 de Mecanica GeneralDocumento4 páginasFormulario Certamen 1 de Mecanica GeneralEduardo PerezAún no hay calificaciones
- Silabo de R1-2015-ADocumento7 páginasSilabo de R1-2015-AHugo A Bravo MascaróAún no hay calificaciones
- Transcripciones Biancardi Neurociencias PDFDocumento113 páginasTranscripciones Biancardi Neurociencias PDFRodrigoo DíazAún no hay calificaciones
- Cristales de AZUCARDocumento2 páginasCristales de AZUCARdaniAún no hay calificaciones
- 11 Forensic Analysis - Analisys Forense - RepairedDocumento19 páginas11 Forensic Analysis - Analisys Forense - RepairedGalaxia PirataAún no hay calificaciones
- Inducción Seguridad 2Documento9 páginasInducción Seguridad 2CHARLOTHYAún no hay calificaciones
- FlavonoidesDocumento20 páginasFlavonoideslucero_147755007Aún no hay calificaciones