Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Problema de Lecho Fluidizado
Cargado por
Diana Cueva MillaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Problema de Lecho Fluidizado
Cargado por
Diana Cueva MillaCopyright:
Formatos disponibles
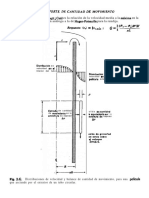
1. Se realiza una oxidación parcial pasando aire con 1.
2 por ciento mol (% mol) de un
hidrocarburo a través de tubos de 40 mm empacados con 2 m de gránulos (pellets)
cilíndricos de catalizador de 3 mm por 3 mm. El aire entra a 350 °C y 2.0 atm con una
velocidad superficial de 1 m/s. ¿Cuál es la caída de presión a través de los tubos
empacados? ¿Cuánto se reduciría la caída de presión utilizando gránulos de 4 mm?
Suponga que ε = 0.40.
SOLUCION:
Asumir que el hidrocarburo plantea el peso molecular del aire a 30, entonces:
30 x 273 x 2 Kg
ρ= =1.174 3
22.4 x 623 m
m
De tablas : ϕ s=1. 0 ,como datos: V 0=1 D p=0.003 m
s
L=2 m −5
μ=3 x 10 Pa . s
Sustituyendo en la ecuación de Ergun:
Δ P 150 x 1 x 3 x 10−5 x 0.602
=
2 12 x 0.0030 2 x 0.40 3
ΔP kg
=2812.5+6420.3=9232.8 2 2
2 m −s
kg
Δ P=2 x 9232.8
m −s2
2
N
Δ P=18.466 2
o 0,185 ¯¿
m
FUENTE: OPERACIONES BASICAS DE INGENIERIA QUIMICA, MC CABE/SMITH
También podría gustarte
- Taller Molienda - TamizadoDocumento3 páginasTaller Molienda - TamizadoDiego Andrés CárdenasAún no hay calificaciones
- Ejercicios de Molienda y Tamizado (Recuperado 1)Documento12 páginasEjercicios de Molienda y Tamizado (Recuperado 1)Oscar A. MorochoAún no hay calificaciones
- Transporte de materiales sólidos con bandas y tornillosDocumento78 páginasTransporte de materiales sólidos con bandas y tornillosJUDITH YOLANDA SANCHEZ OREAún no hay calificaciones
- P4 - Analisis Granulometrico de Un Material Polidisperso A Traves de La Técnica de TamizadoDocumento5 páginasP4 - Analisis Granulometrico de Un Material Polidisperso A Traves de La Técnica de TamizadoJORGE ANDRES ARIAS BATALLASAún no hay calificaciones
- Ley de ErgùnDocumento3 páginasLey de Ergùncoreano63Aún no hay calificaciones
- Tarea1-Ramos Prieto LuisDocumento16 páginasTarea1-Ramos Prieto LuisRandyAún no hay calificaciones
- Img, 85,88,89Documento3 páginasImg, 85,88,89Gabrielsh11Aún no hay calificaciones
- Determinación Reynold flujoDocumento5 páginasDeterminación Reynold flujoAlejandra SanchezAún no hay calificaciones
- Problemas de FluidizacionDocumento6 páginasProblemas de FluidizacionJose Luis Chumpitaz ZárateAún no hay calificaciones
- Tarea Nº3Documento34 páginasTarea Nº3R RodríguezAún no hay calificaciones
- Para Hallar La Velocidad: Tubo de Venturi: Peso Específico P W V N M P N M M VP G M X 0,92 KGM S MDocumento2 páginasPara Hallar La Velocidad: Tubo de Venturi: Peso Específico P W V N M P N M M VP G M X 0,92 KGM S MDaniela MorenoAún no hay calificaciones
- Ecología Proyecto III Canastas de PET FMADocumento7 páginasEcología Proyecto III Canastas de PET FMAJosee MaayaAún no hay calificaciones
- Ejercicio 1 y 9Documento3 páginasEjercicio 1 y 9andrea jimenezAún no hay calificaciones
- Caracterización de SólidosDocumento8 páginasCaracterización de SólidosJesicaCarrascalAún no hay calificaciones
- Proyecto de SolidosDocumento3 páginasProyecto de SolidosCristopher AguaizaAún no hay calificaciones
- Propiedades sólidos laboratorioDocumento9 páginasPropiedades sólidos laboratoriopaulaAún no hay calificaciones
- Discusion Sedimentacion 2017Documento5 páginasDiscusion Sedimentacion 2017Dee-Deecita ItiAún no hay calificaciones
- Problemario de Filtración - Procesos de Separación I - 20 PDFDocumento3 páginasProblemario de Filtración - Procesos de Separación I - 20 PDFIsaac RamirezAún no hay calificaciones
- TEF Primer Examen Parcial Parte BDocumento6 páginasTEF Primer Examen Parcial Parte BEstefanía Angel ClavijoAún no hay calificaciones
- Ejercicio 7.6: Operaciones Unitarias IDocumento3 páginasEjercicio 7.6: Operaciones Unitarias IRAUL ALCIBIADES PEREZ MENAAún no hay calificaciones
- Evaporador simple concentra solución salinaDocumento41 páginasEvaporador simple concentra solución salinaSichem GuerreroAún no hay calificaciones
- REDUCCIÓN de TAMAÑO y Analisis GranulometricoDocumento7 páginasREDUCCIÓN de TAMAÑO y Analisis GranulometricoAnonymous vVsidh3n100% (1)
- Ejercicio 1Documento5 páginasEjercicio 1Daniel LautaroAún no hay calificaciones
- Flujo de Fluidos Practica 2 BombasDocumento12 páginasFlujo de Fluidos Practica 2 BombasVALERIA CCSTAún no hay calificaciones
- 16Documento2 páginas16Joss Rbles100% (1)
- TP 9 - Determinación de Cloruros - Potenciometría de PrecipitaciónDocumento7 páginasTP 9 - Determinación de Cloruros - Potenciometría de PrecipitaciónMaría Esperanza AlmeidaAún no hay calificaciones
- Banco de Preguntas Mecanica de FluidosDocumento5 páginasBanco de Preguntas Mecanica de FluidosSandra ColqueAún no hay calificaciones
- Seminario #4Documento1 páginaSeminario #4Joshua GordilloAún no hay calificaciones
- Practica de MetalesDocumento18 páginasPractica de MetalesLISBET NORIEGAAún no hay calificaciones
- 2° Taller Enzimología - Universidad Incca de ColombiaDocumento23 páginas2° Taller Enzimología - Universidad Incca de ColombiaJusney GarzonAún no hay calificaciones
- Angulos Compuestos 1Documento4 páginasAngulos Compuestos 1WALTERICOAún no hay calificaciones
- Plantilla Sillas de BerlDocumento8 páginasPlantilla Sillas de BerlEnya Vives BntzAún no hay calificaciones
- Unidad 5: Transferencia de Calor - Radiación: Termodinámica BásicaDocumento37 páginasUnidad 5: Transferencia de Calor - Radiación: Termodinámica BásicaGeronimo DiazAún no hay calificaciones
- Problemas 1 Flores Garcia Elizabeth CompressDocumento18 páginasProblemas 1 Flores Garcia Elizabeth CompressCarlos Antonio Arias ChoquehuancaAún no hay calificaciones
- Prueba 1 2020Documento10 páginasPrueba 1 2020Ferdi VaroroAún no hay calificaciones
- Clase 19-20 CromatografiaDocumento19 páginasClase 19-20 CromatografiaJean Piero Bocanegra0% (1)
- Cálculo de La Velocidad Mínima de FluidizaciónDocumento3 páginasCálculo de La Velocidad Mínima de FluidizaciónFiorela TorpocoAún no hay calificaciones
- Propiedades y Tratamiento de Partículas SólidasDocumento5 páginasPropiedades y Tratamiento de Partículas SólidasGeraldine Huaroc PeñaAún no hay calificaciones
- Control SO2Documento5 páginasControl SO2Rakuen 23Aún no hay calificaciones
- Ejercicio 2Documento2 páginasEjercicio 2Ruby SandovalAún no hay calificaciones
- Ejercicio 1 - FiltracionDocumento7 páginasEjercicio 1 - FiltracionLIZ DEXI FLORES BARDALESAún no hay calificaciones
- Análisis tamizado muestra arneadaDocumento10 páginasAnálisis tamizado muestra arneadaLuis Carlos Moreno ChamorroAún no hay calificaciones
- Ejercicio de Evaporadores Triple EfectoDocumento130 páginasEjercicio de Evaporadores Triple EfectoJuan SandovalAún no hay calificaciones
- Lou - I - Agitacion 2008-IIDocumento23 páginasLou - I - Agitacion 2008-IIJuanCarlosOrtizHuanca0% (1)
- Practica 3 Separaciones MecanicasDocumento8 páginasPractica 3 Separaciones MecanicasPerla MonroyAún no hay calificaciones
- Taller1 Operaciones Unitarias IDocumento3 páginasTaller1 Operaciones Unitarias IElkin L. Roldan BenitoAún no hay calificaciones
- Mec Fluidos Ejemplos - CompressDocumento45 páginasMec Fluidos Ejemplos - CompressJoel CalleAún no hay calificaciones
- Polibutiléno Succinato (PBS)Documento7 páginasPolibutiléno Succinato (PBS)julio marioAún no hay calificaciones
- Previo OPUS Ejercicios 4 - 28Documento8 páginasPrevio OPUS Ejercicios 4 - 28lolaAún no hay calificaciones
- Evap FinalDocumento19 páginasEvap FinalSalem PacoAún no hay calificaciones
- Lab 2Documento31 páginasLab 2Karen GallegosAún no hay calificaciones
- DocumentDocumento23 páginasDocumentZully CabreraAún no hay calificaciones
- Guia 3 35805Documento6 páginasGuia 3 35805MarceloValeriaAún no hay calificaciones
- Ejercicios ResueltosDocumento12 páginasEjercicios ResueltoserikaAún no hay calificaciones
- Problema 1.-Chokys (Horneado) : GalletaDocumento8 páginasProblema 1.-Chokys (Horneado) : GalletaPlay CharlyAún no hay calificaciones
- Unidad 2. Ejemplos 4 y 5. Ejercicio Propuesto CORREGIDODocumento5 páginasUnidad 2. Ejemplos 4 y 5. Ejercicio Propuesto CORREGIDOluna martinezAún no hay calificaciones
- Ejercicios Transferencia de MasaDocumento20 páginasEjercicios Transferencia de MasaCarolina Chávez100% (2)
- ADA 1.3 - VarguezDocumento19 páginasADA 1.3 - VarguezEduardo VarguezAún no hay calificaciones
- Tarea 3Documento3 páginasTarea 3Angiela LZAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- LadderrrrDocumento12 páginasLadderrrrRenato OviedoAún no hay calificaciones
- Prob Centrifuga de DiscosDocumento1 páginaProb Centrifuga de DiscosDiana Cueva MillaAún no hay calificaciones
- Aditivos Alimentarios (PDF, 208 KB)Documento6 páginasAditivos Alimentarios (PDF, 208 KB)myselfzzAún no hay calificaciones
- Implementación HACCP snacksDocumento3 páginasImplementación HACCP snacksDiana160295Aún no hay calificaciones
- Diptico de Lodos Activados 1Documento3 páginasDiptico de Lodos Activados 1miguel333Aún no hay calificaciones
- CalderasDocumento23 páginasCalderasDiana Cueva MillaAún no hay calificaciones
- Aislamiento Acustico ResumenDocumento2 páginasAislamiento Acustico ResumenDiana Cueva MillaAún no hay calificaciones
- Prob 2 FinalDocumento2 páginasProb 2 FinalDiana Cueva MillaAún no hay calificaciones
- Mezcla de Harina de Maiz y Soya Enriquecida Con Afrecho CerveceroDocumento13 páginasMezcla de Harina de Maiz y Soya Enriquecida Con Afrecho CerveceroDiana Cueva MillaAún no hay calificaciones
- Informe Fem Vs TDocumento15 páginasInforme Fem Vs TDiana Cueva MillaAún no hay calificaciones
- Hoja Req Tab2 ScribdDocumento2 páginasHoja Req Tab2 ScribdDiana Cueva MillaAún no hay calificaciones
- Lodos ActivadosDocumento2 páginasLodos ActivadosDiana Cueva MillaAún no hay calificaciones
- Arbol de Seguridad OprganizacionalDocumento1 páginaArbol de Seguridad OprganizacionalDiana Cueva MillaAún no hay calificaciones
- Labo Potenciometria PHDocumento16 páginasLabo Potenciometria PHDiana Cueva MillaAún no hay calificaciones
- Difusión MolecularDocumento5 páginasDifusión MolecularDiana160295100% (1)
- Logo ElectricidadDocumento9 páginasLogo ElectricidadDiana Cueva MillaAún no hay calificaciones
- Problema de Lecho Fluidizado.Documento1 páginaProblema de Lecho Fluidizado.Diana Cueva MillaAún no hay calificaciones
- Solicit oDocumento1 páginaSolicit oDiana Cueva MillaAún no hay calificaciones
- Sesion de Aprendizaje de MatematicasDocumento10 páginasSesion de Aprendizaje de MatematicasDiana Cueva MillaAún no hay calificaciones
- EDO de Primer OrdenDocumento51 páginasEDO de Primer OrdenDiana Cueva MillaAún no hay calificaciones
- Prob Centrifuga de DiscosDocumento2 páginasProb Centrifuga de DiscosDiana Cueva MillaAún no hay calificaciones
- Programa Integral Nacional para El Bienestar Familiar INABIFDocumento5 páginasPrograma Integral Nacional para El Bienestar Familiar INABIFDiana Cueva MillaAún no hay calificaciones