Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cromatografia
Cargado por
Carlos Felipe Rubio RodriguezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cromatografia
Cargado por
Carlos Felipe Rubio RodriguezCopyright:
Formatos disponibles
MACROMOLECULAS I.
Pedro L. Beltrán, María J. De Arcos, Álvaro J. Palacio, Carlos F. Rubio.
Estudiantes IV semestre Universidad del Atlántico.
pedroluisbeltran22@gmail.com, palacioalvaro@gmail.com, majodearcoz@gmail.com
Resumen: en esta experiencia de laboratorio se empleó la técnica de cromatografía en capa
fina para separar y diferenciar dos monosacáridos, puntualmente, la glucosa y la fructosa.
Para ello se requirió de una placa cromatográfica donde se marcaron tres puntos, los dos
primeros correspondientes a cada azúcar y el tercero fue una mezcla entre la glucosa y la
fructosa. Con la exposición de la placa a los rayos de luz ultravioleta se pudo determinar los
factores de retención para cada compuesto y su posterior análisis.
Palabras claves: azucares, cromatografía, macromoléculas, factor de retención.
Abstract: in this lab chromatography technique he was used to separate thin layer and
differentiate two monosaccharides, promptly, glucose and fructose. To do so it required a
chromatographic plate where three points are scored, the first two for each sugar and the third
was a mixture of glucose and fructose. With the exposure of the plate to ultraviolet light rays
could be determined retention factors for each compound and subsequent analysis.
1. Introducción elementos carbono, hidrogeno, oxigeno y
nitrogeno.
Las estructuras bioquimicas y los procesos
de las celulas vivas implican un alto grado En general para este experimento se
de organización de tales sistemas utilizaron macromoleculas como la fructosa,
complejos, pero que es muy inferior al de los sacarosa, glucosa, lactosa y maltosa que
organismos vivos. Las grande moleculas (a pueden ser determinadas por la tecnica de
menudo llamadas macromoleculas) como cromatografia en capa fina.
las que se encentran en las proteinas
pueden prepararse bioquimicamente La cromatografia en capa fina (Thin layer
uniendo sinteticamente un gran numero de chromatography, TLC) continua siendo la
moleculas de tamaño ordinario. tecnica de analisis de mezclas mas versatil,
facil de emplear y economica de uso en el
laboratorio. Se han encontrado gran
numero de aplicaciones con tratamientos
sencillos de la muestra analizada, como en
analisis y producion de farmacos, industria
quimica, toxicologia ambiental, quimica de
alimentos, analisis de aguas, cosmetica,
Su biosintesis y reacciones dependen en fitoquimica, entre otras.
parte de las enzimas (que tambien son
grandes moleculas), que catalizan de forma La TLC, hace parte de una gran familia de
muy especifica las reacciones de las tecnicas cromatograficas entre las que se
macromoleculas. La mayoria de las encuentran la cromatografia en columna
macromoleculas organicas estan (CC), la de gases (GC) y la cromatografia
compuestas principalmente por lo liquida de alta presion (HPLC) como las
mas populares. Las tecnicas visible. La presencia de un compuesto
cromatograficas constituyen una activo en el UV evita que el indicador
herramienta fundamental en los laboratorios absorba la luz en la zona en la que se
analiticos y de investigacion por lo que su encuentra el producto, y el resultado es la
conocimiento es trascendental relevancia. visualización de una mancha en la placa
Entre otras cosas la TLC permite determinar que indica la presencia de un compuesto.
el grado de pureza de un compuesto,
comparar muestras y realizar el
seguimiento de una reaccion. 2. Objetivos
Emplear la técnica de cromatografía
de capa fina para separar e
identificar monosacáridos de uso
común como la fructosa y la glucosa.
Aplicar de manera correcta la técnica
de cromatografía de capa fina.
Calcular y emplear los factores de
retención (Rf) para diferenciar cada
una de las azucares empleadas.
La muestra a analizar se deposita cerca de
un extremo de una lámina de plástico o 3. Metodología y procedimiento.
aluminio que previamente ha sido
recubierta de una fina capa de adsorbente Para la siguiente práctica enfocada en la
(fase estacionaria). Entonces, la lámina se separación de monosacáridos por
coloca en una cubeta cerrada que contiene cromatografía de capa fina fue necesario el
uno o varios disolventes mezclados uso de una placa cromatográfica, a la cual
(eluyente o fase móvil). A medida que la se le dibujaron 3 puntos con lápiz que
mezcla de disolventes asciende por señalizaban en lugar en que las diferentes
capilaridad a través del adsorbente, se muestras se iban agregar y observar su
produce un reparto diferencial de los comportamiento durante la fase móvil.
productos presentes en la muestra entre el
disolvente y el adsorbente. Los monosacáridos utilizados para esta
práctica fueron la glucosa y sacarosa
La relación entre las distancias recorridas además de un mix de estos dos, las tres
por el soluto y por el eluyente desde el sustancias anteriormente mencionadas se
origen de la placa se conoce como Rf, y diluyeron en agua y por medio de un capilar
tiene un valor constante para cada se agregaron en los puntos señalizados en
compuesto en unas condiciones la placa, el orden de agregación fue
cromatográficas determinadas (adsorbente, fructosa, glucosa y por último el mix de
disolvente, tamaño de la cubeta, estas dos.
temperatura, etc.).
La mayor parte de las placas de
cromatografía llevan un indicador
fluorescente que permite la visualización de
los compuestos activos a la luz ultravioleta.
El indicador absorbe la luz UV y emite luz
que la placa estuvo totalmente seca al
utilizar los rayos UVE.
Imagen 1. Estructuras orgánicas de la glucosa y
fructosa.
Para la preparación de la fase móvil fue
necesario el uso de acetonitrilo y agua en
una proporción de (85:12 v/v), esta se
agregó a un beaker de 20 mL, se tapó con
un vidrio reloj y se dejó en reposo por 30min
aproximadamente, esto para que el beaker Imagen 3. Marcas reveladas de cromatografía en
se saturara con la mezcla de solventes. presencia de luz ultravioleta.
las machas se dibujaron a una distancia fija
dese el origen que concuerdan con cada
una de las muestras aplicadas, la primera
de glucosa, la segunda de fructuosa y la
tercera corresponde a la fusión de estas dos
azucares. Así mismo, estas manchas se
señalaron con un lápiz, tal como se muestra
a continuación:
Imagen 2. Técnica de cromatografía en capa fina.
La placa se coloca dentro del beaker y se
retira antes que la solución llegue al
extremo del papel. La placa de
cromatografía al ser hidrofílica forma una
película delgada de agua que la recubre y
deja deslizar la fase orgánica (acetonitrilo).
Los azucares son retenidos por la fase
acuosa adherida al papel y arrastrados por
la fase orgánica móvil. Cada azúcar avanza Imagen 4. Placa cromatográfica empleada en la
en una longitud proporcional al experiencia de laboratorio.
desplazamiento de la fase orgánica, los
Por último, se realiza la determinación de
desplazamientos se pudieron observar por
los factores de retención para cada una de
medio del uso de rayos UVE, cabe resaltar
las azucares empleadas. La fórmula
utilizada para determinar el Rf (relación de - Aplicación insuficiente de la glucosa
frentes) se muestra a continuación. y la fructosa en el punto de referencia
con el capilar.
Distancia recorrida por el azúcar
Rf =
Distancia recorrida por el disolvente - Humedad en el beaker cuando se
introdujo la placa cromatográfica.
Las longitudes obtenidas se encuentran en
la siguiente tabla. - Errores humanos y aleatorios al
momento de sacar la placa
Fructosa Glucosa Mix cromatográfica del beaker e impedir
Longitud que la fase móvil excediera el frente
recorrida por 4,0 cm 4,4 cm 4,4 cm del disolvente.
el azúcar
Longitud 4. Conclusiones.
recorrida por 4,6 cm 4,9 cm 4,8 cm
el disolvente
Factor de En la siguiente práctica de laboratorio se
retención 0,87 0,89 0,92 tuvo como finalidad la separación e
(Rf) identificación de monosacáridos por
cromatografía de capa fina, en esta se pudo
Tabla 1. Longitudes y Rf obtenidos en la técnica de
cromatografía para cada azúcar.
establecer la importancia de este tipo de
técnicas en la rama alimenticia además de
Los Rf obtenidos se pueden comparar con afianzar y adquirir destrezas en el uso de
los Rf reportados en la literatura y así materiales para este tipo de prácticas y
encontrar un porcentaje de desviación. fortalecer los conocimientos teórico-
prácticos en esta área de la química
orgánica.
7. Referencias
1. Universidad del Atlántico. Química
orgánica experimental II manual de
laboratorio. Departamento de Química,
Barranquilla, 2001.
Tabla 2. Factores de retención teóricos para
diferentes azucares. 2. Durst Dupon H., Gokel Gill W. Química
orgánica experimental. Primera edición,
Al estimar los porcentajes de desviación Reverté, España, 2007, pp. 476 – 489.
para los factores de retención encontrados
experimentalmente con los reportados en la 3. L. G. Wade, Jr. Química orgánica
tabla 2, se obtiene un valor del 89,1% para volumen 2. Séptima edición, Pearson,
la fructosa y 90,1% para la glucosa. Estos Mexico, 2012, pp. 807 – 833.
altos valores permiten concluir que la
eficiencia del laboratorio no fue buena y se
puede atribuir a errores sistemáticos a la
hora de realizar la cromatografía; entre ellos
se encuentran:
También podría gustarte
- Caso Practico UJADocumento11 páginasCaso Practico UJALina Velasquez Velasco0% (1)
- PET - Colocación de Bloques de ConcretoDocumento10 páginasPET - Colocación de Bloques de ConcretoQuenitzon Meza ArevaloAún no hay calificaciones
- Proceso de Producción de BencenoDocumento19 páginasProceso de Producción de BencenoCarlos Felipe Rubio RodriguezAún no hay calificaciones
- Informe Piña AlmibarDocumento21 páginasInforme Piña AlmibarCarlos Felipe Rubio RodriguezAún no hay calificaciones
- El BrushingDocumento25 páginasEl BrushingBarbara Ruano75% (4)
- E65 Cambio Automático GA6HP26Z y Transmisión de Fuerza MTDocumento55 páginasE65 Cambio Automático GA6HP26Z y Transmisión de Fuerza MTJuanCarlosCastillo100% (1)
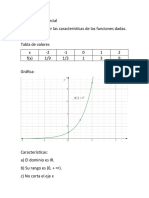
- Función ExponencialDocumento6 páginasFunción ExponencialCarlos Felipe Rubio RodriguezAún no hay calificaciones
- Taller de Matemáticas FinancierasDocumento2 páginasTaller de Matemáticas FinancierasCarlos Felipe Rubio RodriguezAún no hay calificaciones
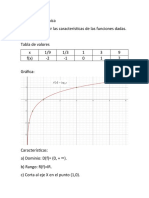
- Función LogaritmicaDocumento5 páginasFunción LogaritmicaCarlos Felipe Rubio RodriguezAún no hay calificaciones
- Figuras Geometricas Plan de Aula Primeros 4 PeriodoDocumento26 páginasFiguras Geometricas Plan de Aula Primeros 4 PeriodoCarlos Felipe Rubio RodriguezAún no hay calificaciones
- JUGUETESDocumento5 páginasJUGUETESCarlos Felipe Rubio RodriguezAún no hay calificaciones
- Exposicion Importante MatematicasDocumento8 páginasExposicion Importante MatematicasCarlos Felipe Rubio Rodriguez100% (1)
- Notificacion 13Documento2 páginasNotificacion 13Carlos Felipe Rubio RodriguezAún no hay calificaciones
- LinealizaciónDocumento19 páginasLinealizaciónCarlos Felipe Rubio RodriguezAún no hay calificaciones
- Constitucion Politica Pros y ContrasDocumento5 páginasConstitucion Politica Pros y ContrasCarlos Felipe Rubio RodriguezAún no hay calificaciones
- Simulación de Un Arreglo de PetlyukDocumento17 páginasSimulación de Un Arreglo de PetlyukCarlos Felipe Rubio RodriguezAún no hay calificaciones
- Informe Intercambiador de Tubos ConcentricosDocumento18 páginasInforme Intercambiador de Tubos ConcentricosCarlos Felipe Rubio Rodriguez100% (1)
- LABORATORIO Nº5-Generador CCDocumento10 páginasLABORATORIO Nº5-Generador CCCarlos ChalcoAún no hay calificaciones
- AlgebraDocumento9 páginasAlgebraJose AndresAún no hay calificaciones
- Guía de Atención A Clientes Presencial Del Camarón CansadoDocumento11 páginasGuía de Atención A Clientes Presencial Del Camarón CansadoGestión De RedesAún no hay calificaciones
- 2 - Capítulo 3 GinaDocumento24 páginas2 - Capítulo 3 GinaLuluRamirezAún no hay calificaciones
- Especificacion Tecnica Kit Riego Por AspersionDocumento6 páginasEspecificacion Tecnica Kit Riego Por AspersionFaviola Herrada GarciaAún no hay calificaciones
- Docsity Propedeutica Clinica Exploracion de Cabeza y CuelloDocumento73 páginasDocsity Propedeutica Clinica Exploracion de Cabeza y CuelloMonse AlcalaAún no hay calificaciones
- Catalogo Cine B 2 2009Documento108 páginasCatalogo Cine B 2 2009juanesrcAún no hay calificaciones
- Tarea5 AnalisisContable KerenRamirez61911522Documento26 páginasTarea5 AnalisisContable KerenRamirez61911522Keren RamirezAún no hay calificaciones
- Bachiller PresentacionDocumento27 páginasBachiller PresentacionPercy LopezAún no hay calificaciones
- Accidente en Fabrica de ArepasDocumento20 páginasAccidente en Fabrica de ArepasluzAún no hay calificaciones
- FERNANDO FÉLIX DULANTO AQUINO - 7 2022 Lab Prueba de Estado de Transistores BJTDocumento5 páginasFERNANDO FÉLIX DULANTO AQUINO - 7 2022 Lab Prueba de Estado de Transistores BJTcarlos velasquezAún no hay calificaciones
- Taller de Fisca Mecanica Areas y VolumenesDocumento8 páginasTaller de Fisca Mecanica Areas y Volumenesdavid rojasAún no hay calificaciones
- Bus IDEDocumento5 páginasBus IDEErick LópezAún no hay calificaciones
- Edicion Impresa 05-08-21Documento16 páginasEdicion Impresa 05-08-21Diario El SigloAún no hay calificaciones
- DripticoDocumento2 páginasDripticoLara Perez perezAún no hay calificaciones
- Tarea Cambio Social 3Documento4 páginasTarea Cambio Social 3Hernandez Davalos Jose AntonioAún no hay calificaciones
- GISTDocumento33 páginasGISTGianmarco CorreaAún no hay calificaciones
- Actividad 2 - Glosario - Conceptos Basicos de La Célula (1) IBERO PDFDocumento6 páginasActividad 2 - Glosario - Conceptos Basicos de La Célula (1) IBERO PDFYuni Cordero50% (4)
- Photopills Meteors EsDocumento43 páginasPhotopills Meteors EsAlly McBeal FurnariAún no hay calificaciones
- Toshiba A60 Sp126Documento3 páginasToshiba A60 Sp126pariciotomasAún no hay calificaciones
- INDICACIONES GENERALES Segunda Opcion-1.2021 Ing. SotoDocumento4 páginasINDICACIONES GENERALES Segunda Opcion-1.2021 Ing. SotoCristian Rivas MatiasAún no hay calificaciones
- Diagramas de LíneasDocumento11 páginasDiagramas de LíneasJj De Acero Jaramillo100% (1)
- 1°B Cuentos Tía en DificultadesDocumento3 páginas1°B Cuentos Tía en DificultadesYani Nina100% (1)
- Amenazas A La M Quin1Documento4 páginasAmenazas A La M Quin1isssiAún no hay calificaciones
- Plan de Estudios Tecnologia e InformaticaDocumento5 páginasPlan de Estudios Tecnologia e Informaticafrankc2911hotmail.comAún no hay calificaciones
- PHOTOMATHDocumento21 páginasPHOTOMATHNashira Grecia Garcia TemoAún no hay calificaciones