Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Taller Gasadiabatico
Cargado por
alejandramartinez0040 calificaciones0% encontró este documento útil (0 votos)
43 vistas1 páginaTaller sobre gases
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoTaller sobre gases
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
43 vistas1 páginaTaller Gasadiabatico
Cargado por
alejandramartinez004Taller sobre gases
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
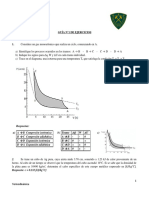
TALLER GAS Y PROCESOS ADIABÁTICOS menor que la presión inicial, y la presión el trabajo
realizado sobre el gas era el mínimo posible.
7. Dos moles de un gas monoatómico ideal a una
presión de 400 kPa y una temperatura de 300 K se
1. El diagrama PV de la figura representa 3 moles de un
expande hasta la presión ha disminuido a 160 kPa.
gas monoatómico ideal. El gas está inicialmente en el
Encuentre la temperatura final volumen, el trabajo
punto A. los caminos AD y BC representan cambios
realizado y el calor absorbido por el gas si la expansión
isotérmicos. Si el sistema se lleva al punto C a lo largo
es (a) isotérmica y (b) adiabática.
de la trayectoria AEC, encuentra (a) la inicial y
temperaturas finales, (b) el trabajo realizado por el gas,
y (c) el calor absorbido por el gas.
8. Un medio mol de helio se expande adiabáticamente
y cuasi-estáticamente de una presión inicial de 3 atm y
temperatura de 3OO K a una presión final de 1 atm.
Encontrar (a) la final temperatura, (b) el volumen final,
(c) el trabajo realizado por el gas, y (d) el cambio en la
energía interna del gas.
9. Una bomba de mano se utiliza para inflar un
neumático de bicicleta a una presión manométrica de
482 kPa (aproximadamente 70 kg/m2). Qué trabajo se
debe hacer en cada golpe de la bomba. Es un proceso
adiabático? La presión atmosférica es de 1 atm, la
temperatura del aire está inicialmente a 20 ° C, y el
2. Supongamos que los caminos AD y BC representan volumen del aire en el neumático permanece
procesos adiabáticos. ¿Cuál es el trabajo realizado Y constante a 1 L
el calor absorbido por el gas siguiendo el camino ABC?
10. Un cilindro térmico aislado vertical se divide en dos
3 Dos moles de un gas ideal diatómico están partes por un pistón móvil de masa m. Inicialmente el
comprimidos isotérmicamente de 7 L a 3 L. En el pistón se mantiene en reposo. La parte superior es
proceso, 180 calorías se escapan del sistema. evacuada y la parte inferior es llenado con 1 mol de gas
Determinar la cantidad de trabajo realizado por el gas, ideal diatómico a una temperatura de 300 K. Después
el cambio en la energía interna, y el cambio inicial y de que el pistón se libera y el sistema llega al equilibrio,
final temperatura del gas. el volumen, ocupado por el gas, se reduce a la mitad.
Encuentra la temperatura final del gas.
4. Supongamos que los dos moles de un gas ideal
diatómico en El problema ANTERIOR se comprime de
11 L a 6 L adiabáticamente, sí el trabajo realizado sobre
el gas es 820J. Hallar la temperatura inicial y las
presiones inicial y final.
5. ¿Cuánto trabajo debe hacerse a 30 gramos de
CO a temperatura y presión estándar para
comprimirlo a una quinta parte de su volumen inicial
si el proceso es (a) isotérmico;
(b) adiabático?
6. Tres moles de gas monoatómico, inicialmente a
temperatura T. experimenta un proceso en el que su
temperatura es cuádruple y su volumen se reduce a la
mitad. Encuentra la cantidad de calor transferido al gas.
Se sabe que en este proceso la presión nunca fue
También podría gustarte
- Taller 3Documento2 páginasTaller 3Jeisson OmarAún no hay calificaciones
- FIS2 - HT - TermodinámicaDocumento2 páginasFIS2 - HT - TermodinámicaLuis Cárdenas corderoAún no hay calificaciones
- EJERCICIOS 9 (Termodinamica)Documento3 páginasEJERCICIOS 9 (Termodinamica)Jenny UlloaAún no hay calificaciones
- Problemas de Física 1 Semana 6Documento3 páginasProblemas de Física 1 Semana 6ALONSO CONDORI CORNEJOAún no hay calificaciones
- Practica #4 de Termodinamica I Gas IdealDocumento4 páginasPractica #4 de Termodinamica I Gas IdealChristian Arias ChavezAún no hay calificaciones
- Practica #4 de Termodinamica I Gas Ideal (Semana N°4)Documento5 páginasPractica #4 de Termodinamica I Gas Ideal (Semana N°4)elvergalargacm35Aún no hay calificaciones
- Serie de Problemas #1 Termodinamica IIDocumento4 páginasSerie de Problemas #1 Termodinamica IIFrank C. Flores100% (1)
- Taller 4 TDDocumento2 páginasTaller 4 TDSantiago LondoñoAún no hay calificaciones
- Fisica PracticaDocumento1 páginaFisica PracticaFiorella YarlequeAún no hay calificaciones
- Gua N1 Termodinmica 2015Documento9 páginasGua N1 Termodinmica 2015Elías Raphael Rubilar BugueñoAún no hay calificaciones
- FISICADocumento2 páginasFISICAJeison Steven Gutierrez VegaAún no hay calificaciones
- Problemario Primera Ley TermodinámicaDocumento4 páginasProblemario Primera Ley TermodinámicajearlugAún no hay calificaciones
- Primera Ley de La TermodinamicaDocumento3 páginasPrimera Ley de La TermodinamicaJuan PARDO ESGUERRAAún no hay calificaciones
- Taller Primera LeyDocumento4 páginasTaller Primera LeyScribdLibros11Aún no hay calificaciones
- FseyndrxuDocumento4 páginasFseyndrxuMiguel SaavedraAún no hay calificaciones
- Guía de TermodinámicaDocumento9 páginasGuía de TermodinámicaJavier CortésAún no hay calificaciones
- Guia Gases IdealesDocumento7 páginasGuia Gases IdealesDiego GasparAún no hay calificaciones
- 1ra Ley GasesDocumento2 páginas1ra Ley GasesFedra UndaAún no hay calificaciones
- Actividad de Aprendizaje - N°07Documento4 páginasActividad de Aprendizaje - N°07JadeAún no hay calificaciones
- Guía 1 PDFDocumento3 páginasGuía 1 PDFDaniel Andres Roa UmañaAún no hay calificaciones
- 9-Seminario Termo 2018-2Documento2 páginas9-Seminario Termo 2018-2Edgar Alberto Palomino HuamaniAún no hay calificaciones
- 3 TermodinamicaDocumento3 páginas3 TermodinamicaMarubiru SeruAún no hay calificaciones
- Termodinamica IDocumento2 páginasTermodinamica IPEDRO REYESAún no hay calificaciones
- 01 Ejercicios IntroduccionTermodinamica IDocumento4 páginas01 Ejercicios IntroduccionTermodinamica IJulissa Guzman67% (3)
- TALLER No 1Documento1 páginaTALLER No 1angela rodgersAún no hay calificaciones
- S15-FG - Chinchay Garcia Eduin Omar.Documento8 páginasS15-FG - Chinchay Garcia Eduin Omar.Ch G Omąr100% (1)
- Problemas Termodinámica 2015Documento12 páginasProblemas Termodinámica 2015Jose DanielAún no hay calificaciones
- Ejercicios W y Q. Primera Ley 2020-IDocumento7 páginasEjercicios W y Q. Primera Ley 2020-IOleggValVilAún no hay calificaciones
- Practica No 13 Fisica NRC 3617 2022-2 PDFDocumento3 páginasPractica No 13 Fisica NRC 3617 2022-2 PDFGena546Aún no hay calificaciones
- Problemario Encb-BDocumento1 páginaProblemario Encb-BCarlos SandovalAún no hay calificaciones
- Tarea No.7 Trabajo y Primera Ley de La TermodinamicaDocumento3 páginasTarea No.7 Trabajo y Primera Ley de La TermodinamicaLuis FelipeAún no hay calificaciones
- Trabajo - Termodinamica PDFDocumento2 páginasTrabajo - Termodinamica PDFExamenesPorWhatsappAún no hay calificaciones
- Banco de Preguntas de TermodinamicaDocumento2 páginasBanco de Preguntas de Termodinamicamaitealfaro2901Aún no hay calificaciones
- Problemas Tema 2Documento2 páginasProblemas Tema 2José Rafael GuillénAún no hay calificaciones
- Practica 1 FQDocumento5 páginasPractica 1 FQmirkoAún no hay calificaciones
- Taller 2-GASES Y Ciclos - 2020Documento2 páginasTaller 2-GASES Y Ciclos - 2020caren malpicaAún no hay calificaciones
- Discusión 1 Ciii-17Documento5 páginasDiscusión 1 Ciii-17Luis LemusAún no hay calificaciones
- GTP6Documento4 páginasGTP6Santi BerntzAún no hay calificaciones
- Guía TermodinámicaDocumento8 páginasGuía TermodinámicayoshiwisAún no hay calificaciones
- Taller de Procesos Termodinámicos 201820Documento4 páginasTaller de Procesos Termodinámicos 201820Jairo Mesa ChaparroAún no hay calificaciones
- A15 FG - Ejercicios Procesos TermodinámicosDocumento3 páginasA15 FG - Ejercicios Procesos TermodinámicosPIERO MIGUEL VILLARAN PABLOAún no hay calificaciones
- Guia Fisicoquimica Segundo Parcial SumoDocumento17 páginasGuia Fisicoquimica Segundo Parcial SumoJanethe Cruz100% (1)
- Taller 5Documento9 páginasTaller 5William Quinchia100% (1)
- 1 - Gases Ideales y RealesDocumento8 páginas1 - Gases Ideales y RealesAnonymous xB4O3LB50% (2)
- 4 Tarea de Primera Ley de La TermodinámicaDocumento5 páginas4 Tarea de Primera Ley de La TermodinámicaAtomAppleAún no hay calificaciones
- Gases Q WDocumento2 páginasGases Q WJose andres Cordoba moraAún no hay calificaciones
- Taller Primera LeyDocumento2 páginasTaller Primera LeyFernando Pazos MoralesAún no hay calificaciones
- TC SeguroDocumento4 páginasTC SeguroFelixBoyerIgredaAún no hay calificaciones
- Problemas de La Primera Ley de La TermodinamicaDocumento17 páginasProblemas de La Primera Ley de La Termodinamicalucifers1115Aún no hay calificaciones
- PROBLEMAS RESUELTOS DE TERMODINAMICA-z, 1ra LeyDocumento7 páginasPROBLEMAS RESUELTOS DE TERMODINAMICA-z, 1ra LeyElmer Diaz EspinosaAún no hay calificaciones
- PD F1 03 Procesos Termodinamicos 2013-IDocumento4 páginasPD F1 03 Procesos Termodinamicos 2013-IKiaraLilianVargasRaymundoAún no hay calificaciones
- Taller 5 Termodinámica - 2021Documento3 páginasTaller 5 Termodinámica - 2021Vanessa PortillaAún no hay calificaciones
- Problemas Gases Ideales Pericles EnunciadosDocumento23 páginasProblemas Gases Ideales Pericles EnunciadosAna Belen RodriguezAún no hay calificaciones
- 1Documento20 páginas1Jacob Fields50% (4)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Seminario 1 - Incremento de Esfuerzos Debido A Diferentes Tipos de CargaDocumento14 páginasSeminario 1 - Incremento de Esfuerzos Debido A Diferentes Tipos de CargaRoger TuestaAún no hay calificaciones
- Falla Frecuente en Ultra SlimDocumento5 páginasFalla Frecuente en Ultra SlimJuan Leonardo SanabriaAún no hay calificaciones
- Manual de Configuracion de Video Confer en CIA PolycomDocumento320 páginasManual de Configuracion de Video Confer en CIA Polycompayto_1570% (1)
- Ensayo (Pequeñas y Medianas Empresas)Documento4 páginasEnsayo (Pequeñas y Medianas Empresas)dayanasl67% (6)
- BIBIS Solo Verificar AnexosDocumento5 páginasBIBIS Solo Verificar AnexosRicardo ErickAún no hay calificaciones
- Plan Pollo A La BrasaDocumento61 páginasPlan Pollo A La BrasaTalento Circulo EducativoAún no hay calificaciones
- Diseño y Análisis Psicométrico de Un Instrumento para Detectar Presencia de Ciberbullying en Un Contexto EscolarDocumento14 páginasDiseño y Análisis Psicométrico de Un Instrumento para Detectar Presencia de Ciberbullying en Un Contexto EscolarRuth RosadoAún no hay calificaciones
- Evaluacion 1 ProgramacionDocumento3 páginasEvaluacion 1 ProgramacionMaribel OrtizAún no hay calificaciones
- Jorge ZabalaDocumento21 páginasJorge ZabalaNAZLBETTINAún no hay calificaciones
- Copia de Check List Revisión ASTDocumento1 páginaCopia de Check List Revisión ASTJaviera Ortiz BordonesAún no hay calificaciones
- Formato de Carga AcadémicaDocumento3 páginasFormato de Carga Académicajoselep2011Aún no hay calificaciones
- Clases InternasDocumento8 páginasClases Internasluisvar12Aún no hay calificaciones
- La Impresión en 3DDocumento1 páginaLa Impresión en 3DLeidys BalcazarAún no hay calificaciones
- Reg 89E GNCDocumento12 páginasReg 89E GNCfabiostefania100% (1)
- Cromática Nuevo Ecuador 2023Documento6 páginasCromática Nuevo Ecuador 2023Dario Aldaz0% (2)
- Sistemas de Suspensión - Fluidos Tema 4Documento27 páginasSistemas de Suspensión - Fluidos Tema 4Sheila Martinez SalasAún no hay calificaciones
- Planificación Taasdller HojalateriaDocumento14 páginasPlanificación Taasdller Hojalateriatruen0260% (1)
- Caso de Diversificacion Del Producto de GloriaDocumento5 páginasCaso de Diversificacion Del Producto de GloriaOlenkaLópezAlvaAún no hay calificaciones
- BP Drill Bellators 1Documento1 páginaBP Drill Bellators 1emalfeAún no hay calificaciones
- Catalogo Peak Tour 2013 - Equipaje, Mochilas, Porta Laptops, CosmetiquerasDocumento40 páginasCatalogo Peak Tour 2013 - Equipaje, Mochilas, Porta Laptops, CosmetiquerasKristophe Al TziganiAún no hay calificaciones
- Eeid - Eeid-611 - Trabajofinal - Segunda Entrega - TirapoDocumento14 páginasEeid - Eeid-611 - Trabajofinal - Segunda Entrega - TirapoLesly Tirapo RodriguezAún no hay calificaciones
- Control de Temperatura TermoparDocumento9 páginasControl de Temperatura TermoparPipe CastilloAún no hay calificaciones
- Lenguaje CorporalDocumento15 páginasLenguaje Corporaltania pumaAún no hay calificaciones
- Microciclo PerfeccionamientoDocumento2 páginasMicrociclo PerfeccionamientoJaume Ramis Claver50% (2)
- Causa RaizDocumento11 páginasCausa RaizcarlosAún no hay calificaciones
- Disciplina en El Trabajo. Actividad 1Documento5 páginasDisciplina en El Trabajo. Actividad 1Anonymous dLpwiH60% (5)
- Usando El ResonadorDocumento22 páginasUsando El Resonadorinxs_the_bestAún no hay calificaciones
- Curva SDocumento16 páginasCurva STrisha ReyesAún no hay calificaciones
- Check List RetroexcavadoraDocumento1 páginaCheck List RetroexcavadoraJuan Renteria AAún no hay calificaciones
- Calculos Del MotorDocumento15 páginasCalculos Del MotorWalter Coronel100% (1)