Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Congelacion
Cargado por
juan jose montalvo0 calificaciones0% encontró este documento útil (0 votos)
17 vistas2 páginasEl documento presenta 3 problemas relacionados con el cálculo de puntos de congelación de soluciones utilizando la constante crioscópica. En el primer problema se calcula el punto de congelación de una solución de ácido cítrico en agua como -0.668°C. En el segundo problema se calcula el peso molecular de un soluto desconocido como 14.15°C. En el tercer problema se pide calcular el peso molecular aproximado del ácido benzoico en benceno, cuya respuesta es 244.3 g/mol.
Descripción original:
Título original
congelacion.docx
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl documento presenta 3 problemas relacionados con el cálculo de puntos de congelación de soluciones utilizando la constante crioscópica. En el primer problema se calcula el punto de congelación de una solución de ácido cítrico en agua como -0.668°C. En el segundo problema se calcula el peso molecular de un soluto desconocido como 14.15°C. En el tercer problema se pide calcular el peso molecular aproximado del ácido benzoico en benceno, cuya respuesta es 244.3 g/mol.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
17 vistas2 páginasCongelacion
Cargado por
juan jose montalvoEl documento presenta 3 problemas relacionados con el cálculo de puntos de congelación de soluciones utilizando la constante crioscópica. En el primer problema se calcula el punto de congelación de una solución de ácido cítrico en agua como -0.668°C. En el segundo problema se calcula el peso molecular de un soluto desconocido como 14.15°C. En el tercer problema se pide calcular el peso molecular aproximado del ácido benzoico en benceno, cuya respuesta es 244.3 g/mol.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
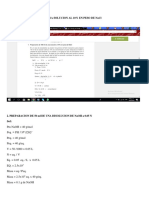
3.
0 ¿Cuál será el punto de congelación de una solución que contiene 17,25 g de
ácido cítrico (C6H8O7) disueltos en 250 g de agua. (Agua: temperatura de
congelación 0 °C y constante crioscopía 1,86 °C/molar)
Veamos cuantos moles de C6H8O7 tenemos
17,25 g / (6·12 + 8·1 + 7·16) =0,0 898 moles
Calculamos la molalidad
0,0898 moles -----------250 g agua
x moles --------------1000 g agua
x= 0,3592 moles / kg
Aplicamos la fórmula
0 - T disolución =1,86 * 0,3592
T disolución = 0 - 0 668
= - 0,668ºC
4.0 Calcule el peso molecular de un no electrolito si el agua se congela a -0,50
°C cuando en 20 g de ella se disuelven 12 g de soluto. (Agua: temperatura de
congelación 0 °C y constante crioscopía 1,86 °C/molar)
Calculamos la masa de alcohol = volumen x densidad
masa =50 · 0,7=35 g
Calculamos los moles de alcohol
moles =gramos / masa molar= 35 / 46=0,761 moles de alcohol
100 ml de agua = 100 g
Calculamos la molalidad
0,761 moles de alcohol en------------100 g de agua
x moles de alcohol en---------------1000 g de agua
x= molalidad =7,61moles / kg
0 - T disolución= 1,86 *7,61
T disolución=0 - 14,15
= - 14,15 ºC
Si se disuelven 3,96 g de ácido benzoico en 80,6 g de benceno y la solución se
congela a -4,47 °C. Hallar el peso molecular aproximado del ácido benzoico.
(Benceno: temperatura de congelación 5,5 °C y constante crioscopia 5,12
°C/molar) (Respuesta = 244,3 g/mol)
A 100 mL de agua se agregan 50 mL de alcohol (masa molar 46 y densidad 0,7 g/mL) ¿Cual será el
punto de congelación de esta mezcla. (Agua: temperatura de congelación 0 °C y constante
crioscópica 1,86 °C/molar ) (Respuesta = 14,13 °C)
5) Si se disuelven 3,96 g de ácido benzoico en 80,6 g de benceno y la solución se congela a -4,47
°C. Hallar el peso molecular aproximado del ácido benzoico. (Benceno: temperatura de
congelación 5,5 °C y constante crioscópica 5,12 °C/molal)
También podría gustarte
- Guía de Ejercicios de Propiedades ColigativasDocumento3 páginasGuía de Ejercicios de Propiedades ColigativasDiego Cortez FernandezAún no hay calificaciones
- Ejercicios Propiedades ColigativasDocumento2 páginasEjercicios Propiedades ColigativasOscar Waldo Vega Farías100% (1)
- Propiedades Coligativas Clase (5) - 1Documento1 páginaPropiedades Coligativas Clase (5) - 1ana guerrero100% (1)
- Presión de VaporDocumento4 páginasPresión de VaporpiangereAún no hay calificaciones
- Ejercicios ColigativasDocumento2 páginasEjercicios Coligativasmunguiafatima0704Aún no hay calificaciones
- Problemario FQDocumento3 páginasProblemario FQocaherAún no hay calificaciones
- Propiedades ColigativasDocumento2 páginasPropiedades ColigativasyonivelAún no hay calificaciones
- Propiedades Coligativas de Las Soluciones Ideales PDFDocumento2 páginasPropiedades Coligativas de Las Soluciones Ideales PDFJuliWindischbauerAún no hay calificaciones
- Ejercicios Unidad 4.1Documento2 páginasEjercicios Unidad 4.1José Carlos JúniorAún no hay calificaciones
- Guia de Ejercicios Propiedades ColigativasDocumento2 páginasGuia de Ejercicios Propiedades ColigativasVictor Peña AranedaAún no hay calificaciones
- Ejercicios Tema 5Documento4 páginasEjercicios Tema 5Sara AlfoceaAún no hay calificaciones
- Problemas de Propiedades ColigativasDocumento2 páginasProblemas de Propiedades ColigativasLorenaAún no hay calificaciones
- Ejercicios de Propiedades ColigativasDocumento3 páginasEjercicios de Propiedades ColigativasMacarena Vega100% (1)
- PRACTICA (Coligativas)Documento1 páginaPRACTICA (Coligativas)Victor Quecaña GutierrezAún no hay calificaciones
- Trabajo Práctico - ColigativasDocumento2 páginasTrabajo Práctico - ColigativasJavy EspíndolaAún no hay calificaciones
- AUMENTODocumento25 páginasAUMENTOAnonymous pNGMNovAún no hay calificaciones
- Calculpunto de Congelaiconar El Punto de Congelación de Una DisoluciónDocumento4 páginasCalculpunto de Congelaiconar El Punto de Congelación de Una DisoluciónGenoveva AcostaAún no hay calificaciones
- Clase Propiedades ColigativasDocumento3 páginasClase Propiedades ColigativasJesús David Barrios GonzalezAún no hay calificaciones
- 1 Ejercicios PropuestosDocumento7 páginas1 Ejercicios PropuestosArnaldo ArizaAún no hay calificaciones
- Ejercicios de Propiedades ColigativasDocumento3 páginasEjercicios de Propiedades Coligativasluiscalvo970% (1)
- Práctico 3 - QMC025 - 2022Documento9 páginasPráctico 3 - QMC025 - 2022Britney Nina ArganaAún no hay calificaciones
- Deber SolucionesDocumento2 páginasDeber SolucionesHapinessis foodAún no hay calificaciones
- Practica para ExamenDocumento4 páginasPractica para Examenaneladames9052100% (1)
- Ejercicios de Los 100 ProblemasDocumento55 páginasEjercicios de Los 100 ProblemasJorge juniorAún no hay calificaciones
- Ejercicios de Propiedades Coligativas 1Documento7 páginasEjercicios de Propiedades Coligativas 1Resolvemos Ejercicios de Matemáticas50% (4)
- Ejercicios de Coligativas FDocumento6 páginasEjercicios de Coligativas FZayuriAún no hay calificaciones
- Ejercicios T4 DISOLUCIONESDocumento3 páginasEjercicios T4 DISOLUCIONESJavaeAún no hay calificaciones
- Ejercicios Propiedades ColigativasDocumento2 páginasEjercicios Propiedades ColigativasRoberto Daniel Rivera Castro0% (1)
- Ejercicios Propiedades ColigativasDocumento4 páginasEjercicios Propiedades ColigativasJhonatan Dávila100% (1)
- Relación de Problemas Tema 9 - 3 PDFDocumento4 páginasRelación de Problemas Tema 9 - 3 PDFJose Luis de Posada0% (1)
- Práctico 3 - QMC025 - Equilibrio en Disolución y Propiedades ColigativasDocumento2 páginasPráctico 3 - QMC025 - Equilibrio en Disolución y Propiedades ColigativasIdania CazasAún no hay calificaciones
- Problemas Tema3 QDocumento4 páginasProblemas Tema3 Qignaciolangarica68Aún no hay calificaciones
- Cuestionario Dra. NigdDocumento9 páginasCuestionario Dra. NigdChristiansito AndresitoAún no hay calificaciones
- Físico QuímicaDocumento4 páginasFísico QuímicaValeria DelgadoAún no hay calificaciones
- Ejercicios Propiedades ColigativasDocumento1 páginaEjercicios Propiedades ColigativasLeo LoyolaAún no hay calificaciones
- Disoluciones Ejercicios 2Documento6 páginasDisoluciones Ejercicios 2juan davidAún no hay calificaciones
- 6 Guia de Trabajo Coligativas RespuestasDocumento10 páginas6 Guia de Trabajo Coligativas RespuestasJavier HerreraAún no hay calificaciones
- Ejercicios de ConcentraciónDocumento5 páginasEjercicios de ConcentraciónNicol MosqueraAún no hay calificaciones
- Propiedades-Coligativas-Ejercicios TerminadoDocumento19 páginasPropiedades-Coligativas-Ejercicios TerminadonayelisAún no hay calificaciones
- Gu A de Ejercicios Propiedades ColigativasDocumento1 páginaGu A de Ejercicios Propiedades Coligativasoscar castilloAún no hay calificaciones
- Presion Osmotica y Ke KCDocumento1 páginaPresion Osmotica y Ke KCGiis MoralesAún no hay calificaciones
- Sol y Prpied... WatssappDocumento2 páginasSol y Prpied... WatssappAlex EfcAún no hay calificaciones
- Ejercicios Propiedades ColigativasDocumento3 páginasEjercicios Propiedades ColigativasLilianaCatalinaMejiaLizcanoAún no hay calificaciones
- DisolucioneshadrhdthaetjDocumento3 páginasDisolucioneshadrhdthaetjelgema0% (1)
- Calculos de Propiedades ColigativasDocumento3 páginasCalculos de Propiedades Coligativascatalina infante0% (1)
- Soluciones 2Documento32 páginasSoluciones 2MARIA JOSE POLOAún no hay calificaciones
- ColigativasDocumento2 páginasColigativasRené Ruli MolinaAún no hay calificaciones
- Resultados Informe 10Documento5 páginasResultados Informe 10Juan David Alarcon0% (1)
- Resultados Informe 10Documento5 páginasResultados Informe 10Juan David AlarconAún no hay calificaciones
- TAREA 4a FISICO QCA I III SEMESTREDocumento3 páginasTAREA 4a FISICO QCA I III SEMESTRELeydi Bravo67% (3)
- Disoluciones Ideales y Propiedades Coligativas Tema 13Documento2 páginasDisoluciones Ideales y Propiedades Coligativas Tema 13Kassandra de QuesadaAún no hay calificaciones
- 2019-1 Taller Propiedades ColigativasDocumento1 página2019-1 Taller Propiedades ColigativasKevin PerdomoAún no hay calificaciones
- Practico 5 de Propiedades ColigativasDocumento11 páginasPractico 5 de Propiedades Coligativasyordy puñaAún no hay calificaciones
- Miscelanea de Ejercicios Propiedades ColigativasDocumento3 páginasMiscelanea de Ejercicios Propiedades ColigativasJulian VillafuerteAún no hay calificaciones
- Mi Primer Pecera Todo lo que Necesitas Saber para Iniciarte en el Cuidado de los PecesDe EverandMi Primer Pecera Todo lo que Necesitas Saber para Iniciarte en el Cuidado de los PecesAún no hay calificaciones
- El Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásDe EverandEl Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásAún no hay calificaciones
- Dieta Paleo: Los Secretos De La Pérdida De Peso Rápida Y Un Estilo De Vida SaludableDe EverandDieta Paleo: Los Secretos De La Pérdida De Peso Rápida Y Un Estilo De Vida SaludableAún no hay calificaciones
- Cómo Preparar Té Devonshire (Auténticas Recetas Inglesas Libro 7)De EverandCómo Preparar Té Devonshire (Auténticas Recetas Inglesas Libro 7)Aún no hay calificaciones
- 1.2 - Infografia Clase AminoácidosDocumento1 página1.2 - Infografia Clase Aminoácidosjuan jose montalvoAún no hay calificaciones
- Informe 10 y 11Documento8 páginasInforme 10 y 11juan jose montalvoAún no hay calificaciones
- Trabajo de balance-WPS OfficeDocumento7 páginasTrabajo de balance-WPS Officejuan jose montalvoAún no hay calificaciones
- Taller de Bioquimica PDFDocumento12 páginasTaller de Bioquimica PDFjuan jose montalvoAún no hay calificaciones