Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Quimica Aplicada Informe V
Quimica Aplicada Informe V
Cargado por
Omar MendozaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Quimica Aplicada Informe V
Quimica Aplicada Informe V
Cargado por
Omar MendozaCopyright:
Formatos disponibles
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
El mtodo potenciomtrico es la
PRCTICA SEGUNDA SERI
medicin
de
las
diferencias
de
potencial de una celda electroqumica.
3.- MTODO
El anlisis potenciomtrico se realiza
POTENCIOMTRICO
para
determinar
la
actividad
concentracin del ion activo o de los
PRCTICA 3
cambios de potencial, en el caso de la
TITULACIONES
prctica
POTENCIOMTRICAS
ejecutada
se
utiliz
la
titulacin potenciomtrica en donde se
adiciona porciones del reactivo que se
Instituto Universitario de Tecnologa
titula, a medida que se acerca el punto
Dr. Federico Rivero Palacio, PNF
final de la titulacin se demuestra por
Ingeniera de Materiales Industriales
los cambios de potenciales cada que
Mendoza O, Ros Y, Vsquez E,
se agrega el reactivo, hasta que en
Vsquez N.
cada agregado los incrementos son
ms pequeos.
29/03/2016
En las titulaciones se utiliza un
electrodo indicador, y se compara el
potencial del electrodo con la solucin
1.- MARCO TERICO
La titulacin potenciomtrica se
problema,
estas
suelen
precisas
que
los
ser
ms
indicadores
realiza cuando no es posible la
coloreados; para determinar el punto
detencin de punto final de una
final o de equivalencia, sin embargo
valoracin empleando un indicador
estas utilizan ms tiempo que las
visual. Se considera uno de los
titulaciones en donde se emplea un
mtodos ms exactos, porque el
indicador
potencial sigue el cambio real de la
depende del electrodo utilizado, por
actividad y el punto final coindice
ejemplo si se utiliza electrodos de pH,
directamente
su tiempo de calibracin es ms corto
equivalencia
con
el
punto
de
coloreado,
el
tiempo
que un electrodo de ion selectivo y se
determina el pH de una muestra en 1
min, mientras que otros electrodos (Ion
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
selectivo,
sensores
de
gas
concentraciones iguales, en el
enzimticos) utilizan 1 a 5 min para
punto de equivalencia. Los
determinar una muestra simple.
iones
hidrxidos
estn
en
exceso, despus del punto de
Titulacin
Potenciometrica
equivalencia.
Acido - Base
Caractersticas de la titulacin
Esta se fundamenta en los iones
de
hidrgenos
presentes
Acido dbil- Base fuerte.
como
resultados de la disociacin o hidrolisis
Al principio la solucin solo
de solutos, son neutralizados mediante
tiene iones hidronios y existe
la titulacin de una base, estndar. El
relacin entre su concentracin
mtodo consiste en la medicin y
y su constante de disociacin.
registro del potencial de la celda (en
Despus de agregar varias
mini-voltios o pH) despus de la
cantidades de base, se produce
adicin del reactivo
una serie de amortiguadores,
donde existe relacin entre la
El punto final o de equivalencia
concentracin
se realiza de forma grfica, los
mtodos
para
relacionados
determinarlo
a
matemticas tal es el caso de la
conjugada, es decir una sal.
mayor cantidad que de los
antes
del
punto de equivalencia.
Los
iones
del
punto
de
exceso.
2.- OBJETIVOS
Los iones de hidronios estn de
hidrxidos
Despus
equivalencia, existe base en
Acido fuerte- Base fuerte.
iones
En el punto de equivalencia la
solucin solo contiene la forma
Caractersticas de titulacin
base
cido dbil.
primera derivada (pH / vol) y la
segunda derivada (2 pH / 2 vol).
la
conjugada, y concentracin del
estn
expresiones
de
hidronios
hidrxidos estn presentes en
Aprender
el
uso
del
potencimetro o pHmetro.
Preparar soluciones de cidos
y bases diluidas a partir de
otras ms concentradas.
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
Desarrollar
el
mtodo
titulaciones
potenciomtricas
bsico, obteniendo una lectura
de
de pH 7.
cido-base.
Preparacin
de
la
solucin patrn de NaOH
final de la titulacin.
3.2.-
Determinacin grfica del punto
Determinar la constante de
disociacin de un cido dbil.
Se prepararon 100 ml de
solucin de hidrxido de sodio
NaOH de concentracin 0,4 N
3.- MARCO METODOLGICO
a partir de una solucin ms
concentrada
3.1.- Calibracin del pHmetro.
que
fue
suministrada por el profesor,
Fueron
suministradas
dos
ulteriormente se llen la bureta
soluciones buffer, una de pH 4
con la solucin preparada.
y otra de pH 7.
Preparacin
de
las
electrodo de vidrio al pHmetro y
soluciones diluidas de cido fuerte y
se encendi el equipo.
acido dbil.
Se adicionaron 20 ml de las
soluciones
buffer
respectivamente en beakers de
100 ml.
3.3.-
Se procedi a conectar el
Se
prepararon
respectivamente
50
de
ml
las
soluciones; cido clorhdrico
HCl de concentracin 0,2N y
Posteriormente se realiz la
medicin del pH en la solucin
buffer de carcter acido, con la
finalidad
de
calibrar
el
instrumento, obteniendo un una
cido actico (CH3COOH) de
concentracin 0,2N. A partir de
soluciones ms concentrada
que fueron suministradas por el
profesor
lectura de pH 4, se sustrajo el
electrodo y fue purificado con
agua
destilada
desmineralizada.
forma
se
De
procedi
3.4.- Procedimiento de
titulacin Potenciomtrica.
igual
con
la
solucin buffer de carcter
3.4.1.- Titulacin acido fuertebase fuerte.
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
Se procedi con el montaje del
c. Parar la agitacin.
sistema
d. Medir el pH de la solucin
de
titulacin
comprendido por; el soporte
3.4.2.- Titulacin cido dbil-
universal, baln de tres bocas,
plancha de agitacin, agitador
magntico, bureta, pHmetro y
base fuerte.
En
correlacin
con
el
anterior,
se
electrodo de vidrio.
procedimiento
Posteriormente se adiciono la
procedi en aplicar el mismo
solucin patrn de NaOH a
mtodo de titulacin pero en
0,4 N en la bureta.
este apartado se agreg en el
Se transfiri una alcuota de 25
baln de tres bocas la solucin
ml de cido clorhdrico diluido al
preparada de cido actico
baln
(CH3COOH).
de
tres
bocas
introduciendo el electrodo de
4.-
vidrio y un imn a travs de su
Ulteriormente adicionando la
cantidad de agua destilada
suficiente para cubrir la punta
del electrodo dentro del baln
de tres bocas.
DISCUSIONES
entrada lateral.
RESULTADOS
Se
presentan
los
resultados
obtenidos durante la ejecucin de la
prctica y por medio de los anlisis
cuantitativos, siendo tabulados para
una mayor compresin.
Procediendo a titular hasta la
obtencin del pH en un rango
de
(11-12),
realizado
bajo
4.1.- Reacciones
procedimiento
el
Reacciones qumicas ocurridas
siguiente
orden jerrquico;
durante la ejecucin de la prctica.
a. Adicin de 1 ml de la solucin
Reaccin de un cido fuerte
ms una base fuerte
titulante al baln de tres bocas
que contiene el cido.
b. Proceder con la agitacin de la
solucin.
NaOH + HCl NaCl + H2O
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
4.2.1.-
Ocurrida durante la ejecucin del
paso metodolgico 3.4.1 del proceso
Acido
fuerte-Base
Fuerte
experimental de titulacin.
Se proceder en presentar los
Reaccin de un cido dbil
datos obtenidos durante la ejecucin
ms una base fuerte
del
procedimiento
3.4.1,
CH3COOH + NaOH CH3COONa + H2O
Ocurrida durante la ejecucin del
paso metodolgico 3.4.2 del proceso
experimental de titulacin.
Tabla 1 Valores obtenidos por medio de la
titulacin cido fuerte-base fuerte.
V (ml)
agregado
NaOH
Inicial
0-1 ml
12
2-3
3- 4
4- 5
5- 6
6- 7
7- 8
8- 9
9- 10
10- 11
11- 12
Empleada en el procedimiento
para la determinacin de la constante
de disociacin del cido actico.
4.2.- Grafique las curvas de
titulacin (pH medido vs Volumen
agregada)
para
cada
titulacin
recabados durante la ejecucin del
paso metodolgico 3.4, los valores se
tabularon para otorgar un mayor nivel
de anlisis y comprensin.
pH
NaOH+HCl
1,51
1,56
1,58
1,60
1,66
1,75
1,83
1,95
2,09
2,35
2,98
10,98
11,56
En la tabla N1 se puede
Para la realizacin de la curva de
titulacin, se emplearan los datos
sern
curva de titulacin.
Reaccin de un cido dbil
base
valores
empleados para la realizacin de la
CH3COOHCH3COO-+H+
de
cuyos
metodolgico
observar los datos obtenidos durante la
ejecucin de paso metodolgico 3.4.1
por medio de la titulacin, la solucin
de carcter acido fuerte presento un
pH
inicial
de
1.51,
requiriendo
posteriormente la adicin de 12 ml de
la solucin de NaOH para llevarlo
hasta un pH final de 11,56 y en
congruencia s puede apreciar el
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
cambio brusco del valor de pH entre el
Se proceder en presentar los
rango de (10,11) ml del volumen
datos obtenidos durante la ejecucin
agregado de NaOH sobre la solucin
del procedimiento metodolgico 3.4.2
de HCl. Los valores presentados en la
por medio de la titulacin, cuyos
tabulacin nos permitirn trazar la
valores sern empleados para la
grfica de titulacin cido fuerte-base
realizacin de la curva de titulacin.
fuerte.
Tabla 2 Valores obtenidos por medio de la
titulacin cido dbil-base fuerte.
V (ml)
agregado
NaOH
Inicial
0-1 ml
1-2
2 -3
3- 4
4- 5
5- 6
6- 7
7- 8
8- 9
9- 10
10- 11
11- 12
12- 13
13-14
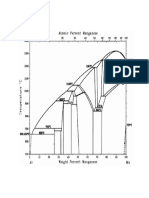
Ilustracin 1 Grfica de la curva de titulacin
cido fuerte-base fuerte.
Se
puede
apreciar
en
la
Ilustracin N1 la curva de titulacin
acido fuerte-base fuerte, la cual es
obtenida por medio de los valores
establecidos en la tabla N1; se
puede observar en la grfica el
aumento del pH en relacin de cada 1
ml
del
correlacin
volumen
con
agregado.
lo
En
anteriormente
expuesto se denota el cambio brusco
del pH, ocurrido entre los 10 ml del
volumen agregado con pH 2,98 hasta
los 11 ml del volumen agregado con pH
10,98.
4.2.2.- Acido Dbil-Base Fuerte
pH
NaOH+CH3COOH
3,04
3,65
3,95
4,19
4,32
4,48
4,61
4,77
4,94
5,09
5,26
5,51
5,98
10,67
11,57
En la tabla N2 se puede
observar los datos obtenidos durante la
ejecucin de paso metodolgico 3.4.2
por medio de la titulacin. La solucin
de carcter acido dbil presento un
pH
inicial
de
3.04,
requiriendo
posteriormente la adicin de 14 ml de
la solucin de NaOH para llevarlo
hasta un pH final de 11,57 y en
congruencia s puede apreciar el
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
cambio brusco del valor de pH entre el
observar con mayor claridad en los
rango de (12,13) ml
anexos.
del volumen
agregado de NaOH sobre la solucin
de
CH3COOH.
Los
4.3.- Determine grficamente el
valores
presentados en la tabulacin nos
permitirn trazar la grfica de titulacin
punto final de cada una de las
titulaciones, utilizando el mtodo de
la primera derivada (grfica de:
cido dbil-base fuerte.
pH/V versus Volumen medio)
Para realizar las grficas de
curva de titulacin, es necesario la
obtencin previa de los valores de la
primera derivada pH/V y volumen
medio
V,
mediante
los
datos
recabados en las tablas N1 y N2,
Ilustracin 2 Grfica de la curva de titulacin
cido dbil-base fuerte.
Se
puede
apreciar
en
procediendo posteriormente a emplear
las siguientes formulas.
la
Ilustracin N2 la curva de titulacin
Formula
de
la
primera
derivada
acido dbil-base fuerte, la cual es
obtenida por medio de los valores
establecidos en la tabla N2; se
puede observar en la grfica el
Donde;
aumento del pH en relacin de cada 1
ml
del
volumen
correlacin
con
agregado.
lo
pHf; Es el pH final.
En
anteriormente
pHi; Es el pH inicial.
expuesto se denota el cambio brusco
Vf; Es el Volumen final.
del pH, ocurrido entre los 12 ml del
volumen agregado con pH 5,98 hasta
Vi; Es el volumen inicial.
los 13 ml del volumen agregado con pH
10,67.
Nota;
Las
grficas
de
las
ilustraciones N1 y N2, se puede
Formula del volumen medio
=
+
2
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
Donde;
empleando los valores establecidos en
Vf; Es el Volumen final.
la tabla N1.
Vi; Es el volumen inicial.
4.3.1.-
cido
fuerte-Base
Fuerte.
Se proceder en presentar los
datos obtenidos mediante los clculos
de la primera derivada pH/V y
volumen medio V, cuyos valores
sern empleados para la realizacin de
Ilustracin 3 Grfica del punto final del cido
fuerte-base fuerte.
Se
puede
apreciar
en
la
la grfica y obtencin del punto de
ilustracin "N3" la curva de la primera
equivalencia.
derivada vs el volumen medio, donde
la curva tiene un punto mximo que
Tabla 3 Valores del cido fuerte-base fuerte
obtenidos por medio de la primera derivada y
volumen medio.
pH/V
0
0,05
0,02
0,02
0,06
0,07
0,08
0,12
0,14
0,26
0,63
8
0,58
V
0
0,5
1,5
2,5
3,5
4,5
5,5
6,5
7,5
8,5
9,5
10,5
11,5
corresponde el punto de equivalencia,
(tericamente
al
tratarse
de
una
titulacin acido fuerte- base fuerte el
punto de equivalencia se produce al
alcanzar un pH7). En la mencionada
grfica, se puede apreciar un punto
mximo que corresponde
8 lo que
equivale a un pH 8.
4.3.2.- cido Dbil-Base Fuerte
Se proceder en presentar los
datos obtenidos mediante los clculos
En la tabla N3 se puede
de la primera derivada pH/V y
observar los datos obtenidos por medio
volumen medio V, cuyos valores
de los clculos de la primera derivada
sern empleados para la realizacin de
pH/V y volumen medio V"
la grfica y obtencin del punto de
equivalencia.
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
Tabla 4 Valores del cido dbil-base fuerte
obtenidos por medio de la primera derivada y
volumen medio.
pH/V
0
0,61
0,31
0,23
0,13
0,16
0,13
0,16
0,17
0,15
0,17
0,25
0,47
4,69
0,9
la curva tiene un punto mximo que
corresponde el punto de equivalencia,
(tericamente
V
0
0,5
1,5
2,5
3,5
1,8
2,2
2,6
3
3,4
3,8
4,2
4,6
5
5,4
al
tratarse
de
una
titulacin cido dbil- base fuerte el
punto de equivalencia se produce al
alcanzar un pH mayor que 7). En la
mencionada grfica, se puede apreciar
un punto mximo que corresponde
4,69 lo que equivale a un pH 4,69.
Nota;
Las
grficas
de
las
ilustraciones N3 y N4, se puede
observar con mayor claridad en los
anexos.
En la tabla N4 se puede
4.4.-
Determine
las
observar los datos obtenidos por medio
concentraciones reales de cada
de los clculos de la primera derivada
cido,
pH/V y volumen medio V"
Concentraciones
empleando los valores establecidos en
desviacin absoluta media.
HCl
CH3COOH.
promedio
la tabla N2.
Las concentraciones reales de
las soluciones, se determinaran por
medio
de
la
siguiente
ecuacin
qumica.
Ecuacin
qumica
para
determinar concentraciones
y volmenes en soluciones
Ilustracin 4 Grfica del punto final del cido
dbil-base fuerte.
Se
puede
apreciar
en
la
ilustracin "N4" la curva la primera
derivada vs el volumen medio, donde
1 1 = 2 2
Despejando N1 obtenemos:
1 =
2 2
1
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
actico, empleando los datos de la
En donde:
tabla N2. El procedimiento para su
N1: Normalidad Concentrada
determinacin
se
encontrara
estructurado bajo los siguientes pasos.
V1: Volumen Concentrada
N2: Normalidad Diluida
Pasos para la determinacin
de
la
constante
de
disociacin (Ka) del cido
V2: Volumen Diluida
actico
Clculos
de
las
concentraciones reales de
a) Se empelara la reaccin global
las soluciones de HCL y
del
CH3COOH
hidrxido de sodio.
CONCENTRACIN HCl
cido
actico
ms
el
CH3COOH+NaOHCH3COONa+H2O
b) En correlacin con el paso
0,2 50
1 =
=1
10
CONCENTRACIN CH3COOH
anterior se procede en ajustar
la reaccin global para la
relacin de la constante de
0,2 50
1 =
=1
10
acides.
CH3COOHCH3COO-+H+
4.5.- Determine la constante de
disociacin (ka) del cido actico,
promedio y desviacin absoluta
media. Compare el valor obtenido
con la constante de disociacin
c) Se procede en implementar la
siguiente tabla de datos.
Tabla 5 Concentracin inicial y final de los
compuesto presentes del cido actico.
terica, cuyo valor es 1,75x10-5 a
Compuesto
CH3COOH
CH3COO-
H+
Inicial
0,2
Equilibrio
0,2-x
25C.
En el presente apartado se
proceder en realizar los clculos de la
constante de disociacin del cido
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
d) El valor del reactante es de
0,2N en condiciones iniciales y
en estado de equilibrio ser de
0,2-x.
La
representa
incgnita
el
valor
en
g) Se repite el procedimiento con
todos
la
valor
puede
ser
cuantificado por medio de los
datos del pH en nuestra tabla
N2, empleando la siguiente
relacin.
de
pH
V (ml)
agrega
NaOH
pH
NaOH+CH3C
Ka
OOH
Inicial
3,04
4,179x10-6
0-1 ml
3,65
2,507x10-8
1-2
3,95
6,321x10-8
2 -3
4,19
2,094x10-8
3- 4
4,32
1,150x10-8
4- 5
4,48
5,507x10-9
5- 6
4,61
3,027x10-9
se
6- 7
4,77
1,449x10-9
establece la relacin; [H+] =
7- 8
4,94
6,623x10-10
[CH3COO-]. Ulteriormente se
8- 9
5,09
3,319x10-10
determina la concentracin en
9- 10
5,26
1,517x10-10
equilibrio
CH3COOH
10- 11
5,51
4,798x10-11
empleando la relacin 0,2-x,
11- 12
5,98
5,509x10-12
en
12- 13
10,67
2,296x10-21
13-14
11,57
3,640x10-23
Aplicando
propiedades
logartmicas obtenemos;
+ = 10
e) Una vez obtenido el valor de la
concentracin
de
de
donde
[H+],
es
la
concentracin de H+ obtenida.
f)
valores
Tabla 6 Valores de la constante de acides
en comparacin con el volumen agregado y sus
respectivos pH.
do
= [ + ]
los
suministrados en la tabla N2.
formacin de los productos,
dicho
[3 ] [ + ]
[3 ]
Posteriormente se realiza la
En la tabla N 6 se puede
sustitucin de los valores en la
visualizar los valores de Ka obtenidos
ecuacin de la constante de
por medio de la aplicacin de los pasos
acides,
que
encuentra
para la determinacin de la constante
expresada
por
la siguiente
de disociacin del cido actico,
relacin.
empleando los datos de la tabla N2.
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
Los datos suministrados nos
indican que a mayor adicin de NaOH
4.6.- Discusin de resultados y
sobre la solucin de CH3COOH se
alcalinizara y volviendo el cido ms
conclusin
dbil que el valor terico 1,75x10-5.
Clculo para determinar (Ka)
de la solucin concentrada
del cido actico.
Durante la realizacin de la
prctica se lograron cumplir con los
dos primeros objetivos; instruyndonos
en el uso del pHmetro que es de til
para determinar el valor exacto del pH,
Se procede a realizar los pasos
estableciendo la acidez o alcalinidad
establecidos anteriormente para la
en una solucin. Tambin en el
determinacin de la constante de
adiestramiento en la preparacin de
disociacin, en excepcin de las
soluciones diluidas por medio de otras
condiciones iniciales y en equilibrio
ms concentradas.
para el compuesto CH3COOH donde
En cumplimiento con el tercer
se empleara la concentracin a 1N
obtenida en el apartado 4.4, se
objetivo se desarroll el mtodo de
titulacin potenciomtrica, empleando
obtendra;
las
+ = 103,04 = 9,120104
soluciones
anteriormente
preparadas se obtuvieron los datos
necesarios para la determinacin de
Luego;
los valores de la primera derivada y el
[9,120104 ]2
8,314108
=
=
1 9,120104
0,999
= 8,325x105
volumen medio, que se utilizaron en la
elaboracin de la grfica del punto
final.
En correlacin al cuarto objetivo
La constante de disociacin del
de la prctica, se logr cumplir,
cido obtenida presenta una magnitud
obteniendo las grficas N 3 y N4
mayor en comparacin con el valor
primera
vs
volumen),
terico.
mediante una titulacin
previa y
clculos
derivada
realizados,
donde
se
puede visualizar claramente el punto
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
de equilibrio acido- base, conllevando
encima a los 1,80x10-16 lo que indica
a las siguientes conclusiones.
que nuestro acido es de carcter ms
fuerte que el agua y a pH alcalinos
Se logr valorar el HCl con el
NaOH,
Logrando
caractersticas
as
de
la
curva
una
titulacin potenciomtrica, basada en
nuestro Ka se encuentra muy por
debajo
del
valor
anteriormente
expresado, indicndonos que es de
carcter ms dbil que el agua.
cido y base fuerte, obteniendo as dos
valores claves; como se demuestra en
La adicin del hidrxido de sodio
la grfica N1 como los valores de
en el cido actico dispersa las
cido se reducan conforme a los
concentraciones
valores de pH crecan; y el valor del
solucin volviendo su estado a un
punto de equilibrio grafica N3 de 8
carcter alcalino.
del
cido
en
la
el cual acerca al terico que equivale a
Si se toma el valor de la
7.
normalidad
del
cido
actico
Para el caso de la valoracin de
concentrado 1 N y se establece el pH
CH3COOH con el NaOH, se obtuvieron
de 3,04, luego prosiguiendo con los
de la misma forma 2 valores claves, el
pasos para determinar la constantes
cual se pueden visualizar en las
de disociacin Ka, se obtiene un valor
grficas "N 2 y N 4" pero con la
de 8,325x10-5 que a comparacin con
diferencia de su punto de equilibrio es
el valor terico 1,75x10-5 se observa
4,69.
que la constante de disociacin de
nuestra solucin concentrada es de
En relacin a nuestro ltimo
objetivo, se obtuvieron los valores de
las constantes de disociacin del cido
actico, resultando menores a los del
valor terico que es de 1,75x10-5,
expresando que nuestra solucin es de
carcter ms dbil a lo establecido.
En condiciones de pH cidos los
valores de Ka se encuentran por
magnitud superior.
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
ANEXOS
Ilustracin 1 Grfica de la curva de titulacin cido fuerte-base fuerte.
Ilustracin 2 Grfica de la curva de titulacin cido dbil-base fuerte.
Departamento de Tecnologa de Materiales
Cermica-Metalurgia
Ilustracin 3 Grfica del punto final del cido fuerte-base fuerte.
Ilustracin 4 Grfica del punto final del cido dbil-base fuerte.
También podría gustarte
- Correcion ABC en El TradingDocumento2 páginasCorrecion ABC en El TradingMario NavesAún no hay calificaciones
- Manual Instalaciones GLP Cepsa IDocumento150 páginasManual Instalaciones GLP Cepsa Iwww.so.w.49620Aún no hay calificaciones
- HP Prime - Consideraciones Del Lenguaje PPL - 1° ParteDocumento29 páginasHP Prime - Consideraciones Del Lenguaje PPL - 1° ParteRaul Barrios MAún no hay calificaciones
- Prueba de JarrasDocumento9 páginasPrueba de JarrasAnny Marroquin100% (1)
- Examen Tipo Escondida VialDocumento24 páginasExamen Tipo Escondida Vialeliecerdarby88% (16)
- Informe #6 (Densidad Aparente Suelta y Compactada y Densaidad MaxDocumento14 páginasInforme #6 (Densidad Aparente Suelta y Compactada y Densaidad MaxDario Torres100% (1)
- Informe N°3 Mecanica de SuelosDocumento8 páginasInforme N°3 Mecanica de SuelosMilton Tinoco BrionesAún no hay calificaciones
- Primer EjercicioDocumento7 páginasPrimer EjercicioOmar MendozaAún no hay calificaciones
- Práctica ColadoDocumento7 páginasPráctica ColadoOmar MendozaAún no hay calificaciones
- Informe Diagrama de Fases (OMAR)Documento21 páginasInforme Diagrama de Fases (OMAR)Omar MendozaAún no hay calificaciones
- Informe II Quimica Aplicada FinalgDocumento9 páginasInforme II Quimica Aplicada FinalgOmar MendozaAún no hay calificaciones
- Diagrama Al-MnDocumento1 páginaDiagrama Al-MnOmar MendozaAún no hay calificaciones
- Trabajo CaolinDocumento34 páginasTrabajo CaolinOmar MendozaAún no hay calificaciones
- Memoria Topo Gloria Grande AteDocumento8 páginasMemoria Topo Gloria Grande Ateexitos13Aún no hay calificaciones
- NMX-AA - 047 Determinacion de MercurioDocumento4 páginasNMX-AA - 047 Determinacion de MercuriorrollerAún no hay calificaciones
- Electrostática 1-Solucionario PDFDocumento3 páginasElectrostática 1-Solucionario PDFWilson BautistaAún no hay calificaciones
- Los Sistemas de Cableado EstructuradoDocumento27 páginasLos Sistemas de Cableado EstructuradotetepaqueteAún no hay calificaciones
- Laboratorio de Mineralogía Óptica. Alvaro Gomez-Kender RDocumento14 páginasLaboratorio de Mineralogía Óptica. Alvaro Gomez-Kender RAlvaro Gómez VeraAún no hay calificaciones
- 10-Temple y Revenido v2Documento19 páginas10-Temple y Revenido v2Alba Duaneth Rocabado MendietaAún no hay calificaciones
- Practica #2 OBTENCIÓN DE CICLOHEXANONA A PARTIR DE CICLOHEXANOLDocumento8 páginasPractica #2 OBTENCIÓN DE CICLOHEXANONA A PARTIR DE CICLOHEXANOLElizabethBelloAún no hay calificaciones
- Manual de Geologia PDFDocumento489 páginasManual de Geologia PDFMariana LinaresAún no hay calificaciones
- Normas de Seguridad en El LaboratorioDocumento28 páginasNormas de Seguridad en El Laboratoriojuanjovallenato23Aún no hay calificaciones
- Manual de Toxicología. Facultad de Química. ORIGINALDocumento92 páginasManual de Toxicología. Facultad de Química. ORIGINALfachemestry100% (1)
- Lixiviacion de Mineral de Cobre..Documento19 páginasLixiviacion de Mineral de Cobre..gurrenAún no hay calificaciones
- Avt0271 Selector de ArvencesDocumento4 páginasAvt0271 Selector de Arvencesalefleav100% (1)
- Unidad 5 CompresoresDocumento24 páginasUnidad 5 CompresorescastelanAún no hay calificaciones
- Grupo 5 - Medidas Electricas - Laboratorio 1Documento18 páginasGrupo 5 - Medidas Electricas - Laboratorio 1JANPIER FRANCO PIZARRO NONALAYAAún no hay calificaciones
- Vanadio y TungstenoDocumento14 páginasVanadio y TungstenoJose Mxyz100% (1)
- Contenido de La InfografiaDocumento14 páginasContenido de La InfografiaHector PerezAún no hay calificaciones
- Los Axiones de La Comunicación y Los Estilos ComunicacionalesDocumento6 páginasLos Axiones de La Comunicación y Los Estilos ComunicacionalesJael Andrea Benito NavarroAún no hay calificaciones
- Trabajo Practicos de FisicaDocumento10 páginasTrabajo Practicos de FisicaSergioFabianAriasAún no hay calificaciones
- Silabus - Termodinámica PDFDocumento4 páginasSilabus - Termodinámica PDFJoan Paul AncajimaAún no hay calificaciones
- Teoría de PreciptaciónDocumento15 páginasTeoría de PreciptaciónCieza Cueva VitteAún no hay calificaciones
- Electrodo OxidanteDocumento15 páginasElectrodo OxidanteRaul Quispe RamirezAún no hay calificaciones
- Manual de DesinfeccionDocumento34 páginasManual de DesinfeccionBrigitte O.Aún no hay calificaciones
- Dinámica Clase 3 - Movimiento Curvilíneo (Coord Normal - Tangencial)Documento20 páginasDinámica Clase 3 - Movimiento Curvilíneo (Coord Normal - Tangencial)Alejandro Salamanca100% (1)