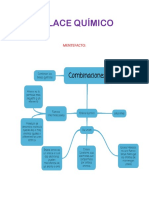
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Qui Mica
Cargado por
Vladimir NogalesDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Qui Mica
Cargado por
Vladimir NogalesCopyright:
Formatos disponibles
Propiedades fsicas y qumicas
La sustancias del mundo real , tal y como las percibimos con nuestros
sentidos, se caracterizan por sus propiedades fsicas o qumicas, es decir,
cmo reaccionan a los cambios que se realicen sobre ellas.
Las propiedades fsicas son aquellas que se pueden medir sin que se afecte
la composicin o la identidad de la sustancia. Ejemplo de estas propiedades
son la densidad, el punto de fusin, el punto de ebullicin, entre otras.
Tambin existen las propiedades qumicas, las cuales se observan cuando
una sustancia sufre un cambio qumico, es decir, una transformacin de su
estructura interna, convirtindose en otras sustancias nuevas. Dichos
cambios qumicos, pueden ser reversibles o irreversibles, cuando stos
ltimos ocurren en una sola direccin (como en la combustin de la
madera).
Las propiedades de las sustancias tambin se pueden clasificar como
extensivas e intensivas. Las propiedades extensivas se caracterizan porque
dependen de la cantidad de sustancia considerada (como la masa y el
volumen)A. Las propiedades intensivas no dependen de la cantidad de
sustancia (como la densidad y la temperatura).
Si se electriza un pedazo de cobre, se imanta un trozo de hierro, se calienta
una cierta masa de azufre o se comprime un volumen determinado de cloro,
las propiedades fsicas de estas substancias varan tan slo en lo que
respecta a la modificacin producida y en una extensin que depende de
ella, pero las propiedades qumicas de estas sustancias permanecen
inalteradas; ha tenido lugar en cada caso un fenmeno fsico. Si se llega a
fundir el pedazo de azufre o si el cloro se lica, las propiedades fsicas
cambian totalmente pero el comportamiento qumico del azufre fundido o el
del cloro lquido es el mismo que el del azufre slido o el del cloro gaseoso,
por lo que el proceso de fusin o el de licuefaccin es tambin un cambio
fsico que afecta nicamente al estado de agregacin de la substancia
correspondiente. En cambio, si se calienta xido mercrico, polvo rojo, en un
tubo de ensayo, se desprende oxgeno y en la parte superior del tubo se
condensa mercurio en forma de minsculas gotas: ha tenido lugar un
cambio qumico.
Los procesos fsicos y qumicos se diferencian fundamentalmente en los
siguientes aspectos:
Los cambios qumicos van acompaados por una modificacin
profunda de las propiedades del cuerpo o cuerpos reaccionantes; los
cambios fsicos dan lugar a una alteracin muy pequea y muchas
veces parcial de las propiedades del cuerpo.
Los cambios qumicos tienen casi siempre carcter permanente
mientras que, en general, los cambios fsicos persisten nicamente
mientras acta la causa que los origina.
Los cambios qumicos van acompaados por una variacin
importante de energa mientras que los cambios fsicos van unidos a
una variacin de energa relativamente pequea. As, por ejemplo, la
formacin de 1.0 g de agua a temperatura ambiente, a partir de
hidrgeno y oxgeno, Ase desprenden cerca de 3800 caloras,
mientras que la solidificacin a hielo de 1.0 g de agua o la
condensacin a agua lquida a 100 C de 1.0 g de vapor de agua
desprende tan slo, respectivamente, cerca de 80 de 540 caloras.
En algunos casos, tal como en la disolucin del cloruro de hidrgeno
gaseoso o incluso del cloruro sdico en agua o la simple dilucin del cido
sulfrico concentrado, parece difcil decidir claramente si un proceso es
qumico o fsico, ya que ofrece aspectos de uno y otro tipo de
transformaciones.
La estructura de Lewis, tambin llamada diagrama de punto y raya
diagonal, modelo de Lewis, representacin de Lewis o frmula de Lewis, es
una representacin grfica que muestra los pares de electrones de enlaces
entre los tomos de una molcula y los pares de electrones solitarios que
puedan existir. Son representaciones adecuadas y sencillas de iones y
compuestos, que facilitan el recuento exacto de electrones y constituyen
una base importante, estable y relativa. Esta representacin se usa para
saber la cantidad de electrones de valencia de un elemento que interactan
con otros o entre su misma especie, formando enlaces ya sea simples,
dobles, o triples y estos se encuentran en cada enlace formado.
Las estructuras de Lewis muestran los diferentes tomos de una
determinada molcula usando su smbolo qumico y lneas que se trazan
entre los tomos que se unen entre s. En ocasiones, para representar cada
enlace, se usan pares de puntos en vez de lneas. Los electrones apartados
(los que no participan en los enlaces) se representan mediante una lnea o
con un par de puntos, y se colocan alrededor de los tomos a los que
pertenece.
Este modelo fue propuesto por Gilbert N. Lewis quien lo introdujo por
primera vez en 1916 en su artculo La molcula y el tomo.
Molculas
Las molculas ms simples, entre las cuales se encuentran las molculas
orgnicas, deben presentar un tomo central, en algunos casos el tomo
central es el carbono debido a su baja electronegatividad, luego ste queda
rodeado por los dems tomos de las otras molculas. En molculas
compuestas por varios tomos de un mismo elemento y un tomo de otro
elemento distinto, ste ltimo se utiliza como el tomo central, lo cual se
representa en este diagrama con 4 tomos de hidrgeno y uno de silicio. El
hidrgeno tambin es un elemento exceptuante, puesto que no debe ir
como tomo central.
Modelo de barras y esferas
Modelos computarizados del benceno (C6H6) y el ciclohexano (C6H12).
En qumica, el modelo de barras y esferas es un modelo molecular de
una sustancia qumica en el que se muestra la posicin tridimensional de los
tomos y los enlaces entre ellos. Los tomos son tpicamente representados
por esferas, conectadas por las barras que representan los enlaces. Los
enlaces dobles y triples son generalmente representados respectivamente
por dos y tres barras curvas. En un modelo ideal, los ngulos entre las
barras deberan ser los mismos entre los ngulos entre los enlaces, y las
distancias entre los centros de las esferas deberan ser proporcional a las
distancias correspondientes entre los ncleos atmicos. A menudo el
elemento qumico de cada tomo es representado por diferentes colores de
esfera.
En un modelo de barras y esferas usualmente el radio de las esferas mucho
menor al tamao de las barras con el fin de lograr una perspectiva ms
clara de los tomos y enlaces representados. Como consecuencia, el modelo
no provee un visin clara del espacio ocupado por la sustancia. En esa
perspectiva, el modelo de barras y esferas es diferente del Modelo de
espacio lleno, donde el radio de las esferas es proporcional al radio atmico
y en la misma escala que las distancias atmicas, y por lo tanto muestran el
espacio ocupado pero no los enlaces.
Los modelos de barras y esferas pueden ser artefactos tangibles o digitales
a travs de grficos computacionales. El primero son usualmente
construidos por un kit de moledado molecular, consistente en un nmero de
resortes helicoidales barras flexibles de plstico, y un nmero de esferas
con agujeros taladrados. El color de las esferas normalmente siguen el
esquema de colores CPK. Algunas cursos universitarios de qumica requieren
que los estudiantes compren estos modelos como material didctico.
En 1865, el qumico alemn August Wilhelm von Hofmann fue el primero en
crear los modelos moleculares de barras y esferas. El us los modelos en
una conferencia en la Royal Institution.
Compaas especializadas manofacturan kits y modelos a pedido. Una de
las primeras compaas fue Woosters en Bottisham, Cambridgeshire, Reino
Unido. Junto a los agujeros tetra, tri y octo hdricos, existan esferas
multiuso de 24 perforaciones. Estos modelos permitieron la rotacin de los
enlaces, el cual poda ser a la vez una ventaja al mostrar la flexibilidad
molecular y una desventaja al ser modelos blandos. La escala aproximada
fue 5 cm per ngstrm (0.5 m/nm o 500 000 000:1), pero no fue consistente
en todos los elementos.
Electronegatividad
La electronegatividad es una medida de la capacidad de un tomo (o de
manera menos frecuente de un grupo funcional) para atraer a los
electrones, cuando forma un enlace qumico en una molcula.1 Tambin
debemos considerar la distribucin de densidad electrnica alrededor de
un tomo determinado frente a otros distintos, tanto en una especie
molecular como en sistemas o especies no moleculares. El flor es el
elemento con ms electronegatividad, el Francio es el elemento con menos
electronegatividad.
La electronegatividad de un tomo determinado est afectada
fundamentalmente por dos magnitudes: su masa atmica y la distancia
promedio de los electrones de valencia con respecto al ncleo atmico. Esta
propiedad se ha podido correlacionar con otras propiedades atmicas y
moleculares. Fue Linus Pauling el investigador que propuso esta magnitud
por primera vez en el ao 1932, como un desarrollo ms de su teora del
enlace de valencia.2 La electronegatividad no se puede medir
experimentalmente de manera directa como, por ejemplo, la energa de
ionizacin, pero se puede determinar de manera indirecta efectuando
clculos a partir de otras propiedades atmicas o moleculares.
Se han propuesto distintos mtodos para su determinacin y aunque hay
pequeas diferencias entre los resultados obtenidos todos los mtodos
muestran la misma tendencia peridica entre los elementos.
El procedimiento de clculo ms comn es el inicialmente propuesto por
Pauling. El resultado obtenido mediante este procedimiento es un nmero
adimensional que se incluye dentro de la escala de Pauling. Esta escala
vara entre 0,7 para el elemento menos electronegativo y 4,0 para el mayor.
Es interesante sealar que la electronegatividad no es estrictamente una
propiedad atmica, pues se refiere a un tomo dentro de una molcula 3 y,
por tanto, puede variar ligeramente cuando vara el "entorno" 4 de un mismo
tomo en distintos enlaces de distintas molculas. La propiedad equivalente
de la electronegatividad para un tomo aislado sera la afinidad electrnica
o electroafinidad.
Dos tomos con electronegatividades muy diferentes forman un enlace
inico. Pares de tomos con diferencias pequeas de electronegatividad
forman enlaces covalentes polares con la carga negativa en el tomo de
mayor electronegatividad.
Escalas de electronegatividad
Los diferentes valores de electronegatividad se clasifican segn diferentes
escalas, entre ellas la escala de Pauling anteriormente aludida y la escala de
Mulliken.
En general, los diferentes valores de electronegatividad de los tomos
determinan el tipo de enlace que se formar en la molcula que los
combina. As, segn la diferencia entre las electronegatividades de stos se
puede determinar (convencionalmente) si el enlace ser, segn la escala de
Linus Pauling:
Covalente no polar: Su escala de medicin es de 0.0-0.6
Covalente polar: su escala de medicin es de 0.6-1.7
Inico: Su escala de medicin es de 1.8 en adelante.
Cuanto ms pequeo es el radio atmico, mayor es la energa de ionizacin
y mayor la electronegatividad y viceversa, la electronegatividad es la
tendencia o capacidad de un tomo, en una molcula, para atraer hacia s
los electrones. Ni las definiciones cuantitativas ni las escalas de
electronegatividad se basan en la distribucin electrnica, sino en
propiedades que se supone reflejan la electronegatividad. La
electronegatividad de un elemento depende de su estado de oxidacin y,
por lo tanto, no es una propiedad atmica invariable. Esto significa que un
mismo elemento puede presentar distintas electronegatividades
dependiendo del tipo de molcula en la que se encuentre, por ejemplo, la
capacidad para atraer los electrones de un orbital hbrido
en un tomo
de carbono enlazado con un tomo de hidrgeno, aumenta en consonancia
con el porcentaje de carcter s en el orbital, segn la serie etano <
etileno(eteno) < acetileno(etino). La escala de Pauling se basa en la
diferencia entre la energa del enlace AB en el compuesto
de las energas de los enlaces homopolares AA y BB.
Tipos de enlaces
y la media
En el modelo inico de enlace el tomo que cede un electrn o mas
se convierte en catin y el que lo recibe, en anin. La unin persiste
por que los iones se atraen.
En el modelo covalente de enlace los electrones de valencia son
compartidos por los dos tomos que se enlazan. El enlace persiste
por que los electrones se sitan entre ambos ncleos y esto evita la
repulsin entre ellos.
En el modelo metlico los electrones se mueven libremente entre
iones (+). Precisamente esta propiedad ocasiona que los metales
conduzcan la corriente elctrica.
También podría gustarte
- ResistividadDocumento5 páginasResistividadVladimir NogalesAún no hay calificaciones
- CancioneroDocumento10 páginasCancioneroVladimir NogalesAún no hay calificaciones
- CancioneroDocumento10 páginasCancioneroVladimir NogalesAún no hay calificaciones
- Horno Solar CaseroDocumento2 páginasHorno Solar CaseroVladimir NogalesAún no hay calificaciones
- RECETASDocumento6 páginasRECETASVladimir NogalesAún no hay calificaciones
- Ejercicio 3-MatematicasDocumento2 páginasEjercicio 3-MatematicasVladimir NogalesAún no hay calificaciones
- Trabajo LegisDocumento10 páginasTrabajo LegisVladimir NogalesAún no hay calificaciones
- Trabajo LegisDocumento10 páginasTrabajo LegisVladimir NogalesAún no hay calificaciones
- Calculos de Errores Medidas Directas e Indirectas PDFDocumento50 páginasCalculos de Errores Medidas Directas e Indirectas PDFChristian Cueva100% (1)
- GlossaryDocumento33 páginasGlossaryDiego A. ZurosiAún no hay calificaciones
- Plan de Estudio 125-1Documento2 páginasPlan de Estudio 125-1Vladimir NogalesAún no hay calificaciones
- Tipos de SueloDocumento1 páginaTipos de SueloVladimir NogalesAún no hay calificaciones
- ADEREZOSDocumento5 páginasADEREZOSVladimir NogalesAún no hay calificaciones
- Los de SiempreDocumento5 páginasLos de SiempreVladimir NogalesAún no hay calificaciones
- FisiografíaDocumento3 páginasFisiografíaVladimir NogalesAún no hay calificaciones
- GUANABANADocumento3 páginasGUANABANAVladimir NogalesAún no hay calificaciones
- Aloe VeraDocumento1 páginaAloe VeraVladimir NogalesAún no hay calificaciones
- Planta de Tratamiento de Aguas Residuales Trasportables oDocumento6 páginasPlanta de Tratamiento de Aguas Residuales Trasportables oVladimir NogalesAún no hay calificaciones
- Informe de AguaDocumento5 páginasInforme de AguaVladimir NogalesAún no hay calificaciones
- Geometría molecular ICl4- y NH4Documento4 páginasGeometría molecular ICl4- y NH4Orlando AlvarezAún no hay calificaciones
- Unidad 2. Estructura Atómica y Enlaces IIDocumento29 páginasUnidad 2. Estructura Atómica y Enlaces IIperezlobito2.0Aún no hay calificaciones
- Clase0 RepasoDocumento112 páginasClase0 RepasoCarolina VazquezAún no hay calificaciones
- Práctica Cap 1Documento4 páginasPráctica Cap 1Wendy VargasAún no hay calificaciones
- Cuestionario de Química 1 Del 2 ParcialDocumento2 páginasCuestionario de Química 1 Del 2 Parcialguillermo edmundo chuquitarco cañizares50% (2)
- 1-2-4 Enlaces QuímicosDocumento5 páginas1-2-4 Enlaces Químicosfelipe95007Aún no hay calificaciones
- Configuración Electrónica y Propiedades PeriódicasDocumento22 páginasConfiguración Electrónica y Propiedades PeriódicasRocio CerutiAún no hay calificaciones
- Ejerc (1) IippDocumento7 páginasEjerc (1) IippaestayAún no hay calificaciones
- Química orgánica títulosDocumento70 páginasQuímica orgánica títulosjunior niolas ñuñuvera vargasAún no hay calificaciones
- Actividad de QuimicaDocumento4 páginasActividad de QuimicaAlexander BedoyaAún no hay calificaciones
- 13 de Junio Taller Enlaces Químicos PDFDocumento5 páginas13 de Junio Taller Enlaces Químicos PDFjhon wilver buitrago VillavicencioAún no hay calificaciones
- Actividad Enlace QuímicoDocumento3 páginasActividad Enlace QuímicoSora HaikoAún no hay calificaciones
- 08 Enlace I Nico PDFDocumento4 páginas08 Enlace I Nico PDFCM TSAún no hay calificaciones
- Mapa Conceptual Enlace QuímicoDocumento1 páginaMapa Conceptual Enlace Químicomanrey4875% (4)
- Enlace Químico CienciasDocumento7 páginasEnlace Químico CienciasJuana Valentina Perdomo RinconAún no hay calificaciones
- Estructura de La Materia SOLUCIONESDocumento25 páginasEstructura de La Materia SOLUCIONESJose Santiago Gonzales CoronelAún no hay calificaciones
- Escribir estructuras de Lewis de manera sistemáticaDocumento5 páginasEscribir estructuras de Lewis de manera sistemáticaMena Diaz Luz ValeriaAún no hay calificaciones
- Unidad 3 - Enlace QuimicoDocumento71 páginasUnidad 3 - Enlace QuimicoJulietaAún no hay calificaciones
- QuimiDocumento80 páginasQuimiJose Guillermo SRAún no hay calificaciones
- GUÍA No.2Documento6 páginasGUÍA No.2Kike PadillaAún no hay calificaciones
- Química Semana 01: Elementos, Propiedades Periódicas y Configuraciones ElectrónicasDocumento10 páginasQuímica Semana 01: Elementos, Propiedades Periódicas y Configuraciones ElectrónicasPAULO GUERREROAún no hay calificaciones
- Guía química enlaces químicos estructuras de LewisDocumento11 páginasGuía química enlaces químicos estructuras de LewisJulio TiradoAún no hay calificaciones
- Informe ExperimentoDocumento6 páginasInforme ExperimentoMateo VerdesotoAún no hay calificaciones
- 7° Ciencias - G4-P3-Enlaces Quimicos (1) 2020Documento4 páginas7° Ciencias - G4-P3-Enlaces Quimicos (1) 2020florma rodriguezAún no hay calificaciones
- Quimica - Sem4 - Enlace QuímicoDocumento3 páginasQuimica - Sem4 - Enlace QuímicoDarwin da silva riveraAún no hay calificaciones
- Previo P7Documento5 páginasPrevio P7GIsAún no hay calificaciones
- GuiaDocumento8 páginasGuiaFrancisca Aravena MéndezAún no hay calificaciones
- Indicadores de DesempeñoDocumento20 páginasIndicadores de DesempeñoOLIVIA MARIA PEREZ CONTRERASAún no hay calificaciones
- Ejercicios de Propiedades PeriodicasDocumento2 páginasEjercicios de Propiedades PeriodicasfrankiefitzAún no hay calificaciones
- V-La Regla Del OcteteDocumento40 páginasV-La Regla Del Octeteangelo cruz gomezAún no hay calificaciones