Documentos de Académico
Documentos de Profesional
Documentos de Cultura
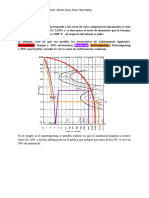
Practica I Cono. Mate. 67.13
Cargado por
German Chiesa DocampoDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica I Cono. Mate. 67.13
Cargado por
German Chiesa DocampoCopyright:
Formatos disponibles
Trabajo Practico N1
"Estructura Cristalina".
Alumno: Eriel A. Fernandez Galvan.
Padrn: 79071
Observaciones:........................................................
................................................................................
................................................................................
................................................................................
................................................................................
Trabajo Practico N1: "Estructura Cristalina".
1) La estructura fue establecida en la forma que hoy se acpta, por Hay y Bravais y luego,
demostrada en 1912 por M. Von Laue que emple los cristales como redes de difraccin.
El estudio de la distribucin de las manchas producidas por la difraccn de rayos X,
permiti calcular las posiciones que adoptan las particulas del cristal: tomos, molculas o
inoes, que ocupan en el espacio nos nudos o nodos de una red denominada retculo
espacial. Los elementos de Simetria son:
- Centro de Simetria: Es el punto, tal que, toda la recta que pase por l, determina en
el cristal dos puntos simetricos. (fig 1)
C
Fig. 1
Eje de Simetria: Es la linea imaginaria que pasa poe el centro de simetria, tal que, al
girar el cristal alrederor de ella 360, ocupa varias posiciones anlogicas. Si en un
giro de 360, el cristal ocupa dos posiciones anlogicas, el eje se denomina binario;
si ocupa tres ternario o trigonal; ocupando cuatro, cuaternario o tetragonal y si ocupa
seis se llama senario o hexagonal. (fig 2)
Eje de simetria
Fig. 2
Plano de simetria: Es el plano imaginario, que, pasando por el centro de simetria
divide al cristal es dos partes, tales que una sea imagen especular de la otra. (fig 3).
Fig. 3
Plano de simetria
Pag. 1
Trabajo Practico N1: "Estructura Cristalina".
Tabla de los Siete Sistemas de Cristales:
Nombre del
Sistema
Angulos de los
ejes
Ejes de Simetria
I
Cbico
===90
a=b=c
Oro, plata,
platino,
sal.
a=bc
Estao,
ferrocianu
ro de
potasio.
abc
Azufre,
nitrato de
potasio,
argonita.
abc
Azufre,
yeso,
borx.
II
===90
Tetragonal o
Piramidal
III
Rombico o ===90
Ortorrombic
IV
==90
Monoclinico
V
Triclnico
90
VI
Hexagonal
==90
=120
VII
Rombodro ==90
o Trigonal
abc
Geometria de la Celda
Ejemplos
(Dicromat
o,
ferrocianuro) de
potasio,
a=bc
Apatita,
zincita,
berilo,
cuarzo.
a=b=c
Calcita,
magnesita
,
hematita.
Pag. 2
Trabajo Practico N1: "Estructura Cristalina".
Dentro de las siete formas unitarias nicas que pueden agruparse para llenar el espacio
tridimensional, pero ahora debemos considerar como los atomos pueden agruparce dentro
de la celda unitaria dada.
Los catorce retculos de cristal (Bravais):
Cubo Simple.
Tetragonal Simple.
Ortorrmbico Centrado
En la Base
Cubo Centrado
en el Cuerpo.
Tetragonal Centrada
en el cuerpo
Ortorrmbico
Simple
Ortorrmbico Centrado
en la Cara
Monoclinico Simple
Cubo Centrado
en las caras.
Romboedrico
Monoclinico Centrado
en la Base.
Pag. 3
Ortorrmbico Centrado
en el Cuerpo
Hexagonal
Triclinico
Trabajo Practico N1: "Estructura Cristalina".
Conociendo las estructuras, podemos dar el sistema cristalisacion de la mayoria de los
metales.
La mayoria de los metales a temperatura ambiente se encuetran en una de tres
estructuras de cristales.
1- Cubica Centrada en el cuerpo (BCC): Existe un atomo en el centro, y un octavo en
cada verticeo esquinas de la celda unitaria.
2- Cubica Centrada en la Cara (FCC): Existe medio atomo en cada cara, y un octavo
en cada verticeo esquinas de la celda unitaria.
3- Hexagonal Compacto: Existe dos atomos asocuiados con cada punto de la red de
Bravais, hay un atomo centrado dentro de la celda unitaria con varios atomos
fraccionados en las esquinas de la celda unitario.
Pag. 4
Trabajo Practico N1: "Estructura Cristalina".
2) El factor de empaquetamiento F.E.A = V(atomos)
V(Celda)
- Cubica Centrada en las Caras (fcc):
Calculo primero el Volumen de los atomos:
Volumen de las esferas seria:
V (esferas) = 4/3. r3
La cantidad de atomos:
1/8 por cada vertice, 1 en el centro, seria: 1/8.8(lados) + 1/2.6(caras) = 4 Atomos
V(atomos) = 4.4/3. r3 = 16/3. r3
Calculo segundo el volumen de la celda:
4.r
(4.r)2 = a2 + a2
16.r2 = 2a2
4.r.(2)-1/2 = a
a
El volumen de la celdar:
a3 = (64.r.(2)-1/2 )3
a3 = 32.r3.(2)-1/2
V(celda) = 32.r3.(2)-1/2
El factor de empaquetamiento para la celda fcc:
F.E.A = V(atomos)
V(Celda)
F.E.A =
16/3..r3 = 0,74
32.r3.(2)-1/2
F.E.A = 0,74 de la celda fcc.
Pag. 5
Trabajo Practico N1: "Estructura Cristalina".
- Cubica Centrada en el Cuerpo (bcc):
Calculo primero el Volumen de los atomos:
Volumen de las esferas seria:
V (esferas) = 4/3. r3
La cantidad de atomos:
1/8 por cada vertice, 1 en el centro, seria: 1/8.8(lados) + 1 (centro) = 2 Atomos
V(atomos) = 2.4/3. r3 = 8/3. r3
Calculo segundo el volumen de la celda:
4. r
16.r2 = a2 + a2 + a2
4.r = (3)1/2 a
4.r. (3)-1/2 = a
El volumen de la celda:
a3 = (4.r.(3)1/2 )3
a3 =64.r3.3-1(3)1/2
V(celda) = 64.r3.3-1.(3)-1/2
El factor de empaquetamiento para la celda bcc:
F.E.A = V(atomos)
V(Celda)
F.E.A = 8/3..r3 = 0,68
64.r3.3-1.(3)-1/2
F.E.A = 0,68 de la celda bcc.
Pag. 6
Trabajo Practico N1: "Estructura Cristalina".
- Hexagonal compacta (hcp):
Calculo primero el Volumen de los atomos:
Volumen de las esferas seria:
V (esferas) = 4/3. r3
La cantidad de atomos seria:
1/6 c/u vert., 3 centro, 1/2 c/u base: 1/6.12(vert.)+1/2.2(base)+3(centro)=6 Atomos
V(atomos) = 6.4/3. r3 = 24/3. r3
Calculo segundo el volumen de la celda:
El factor de empaquetamiento para la celda fcc:
F.E.A = V(atomos)
V(Celda)
F.E.A =
16/3..r3 = 0,74
F.E.A = 0,74 de la celda fcc.
Pag. 7
Trabajo Practico N1: "Estructura Cristalina".
3)
La notacin empleada para describir las direcciones reticulares estan dadas por,
aquellas que correspondan a una direccin, se coloca entre parentesis cuadrados.
Mientras que a los planos con un parentesis, y los enteros representan el inverso de
las intersecciones axiales, y son conocidos como los indices de Miller.
Para nuestra figura, tenemos las direcciones y planos dados por:
Direccin 1: [ x= 2 ; y= -1 ; z= 2]
[ 2 1 2 ], Dirrecin 1
(Aclaracin: el guion de arriba significa negativo)
Direccin 2: [ x= 1 ; y= 0 ; z= 2]
[ 1 0 2 ], Dirrecin 2
Plano 1: [ x= 1/(1/2) ; y= 1/1 ; z= 1/1]
( 2 1 1 ), Plano 1
Plano 2: [ x= 1/ ; y= 1/1 ; z= 1/]
( 0 1 0 ), Plano 2
Pag. 8
Trabajo Practico N1: "Estructura Cristalina".
4) Como muestrs en la figura, tenemos las direcciones dadas por:
Direccin A: [ x= -1 ; y= 1 ; z= 0]
[ 1 1 0 ], Dirrecin A
Direccin B: [ x= 1/2 ; y= 1 ; z= 1/2]
[ 1 2 1 ], Dirrecin B
Direccin C: [ x= 0 ; y= -1/2 ; z= -1]
[ 0 1 2 ], Dirrecin C
Direccin D: [ x= 1/2 ; y= -1 ; z= 1/2]
[ 1 2 1 ], Dirrecin D
Pag. 9
Trabajo Practico N1: "Estructura Cristalina".
5) Como muestras en la figura, tenemos Los
indices de Miller son:
Plano A: [ x= 1/(1/2) ; y= -1/(1/2) ; z= 1/]
( 2 2 0 ), Plano A
Plano B: [ x= 1/1 ; y= 1/(1/2) ; z= 1/(1/2)]
( 1 2 2 ), Plano B
Pag. 10
Trabajo Practico N1: "Estructura Cristalina".
6) La notacin general par alos indices de Miller (hkl), y puede usarse para cualquiera
de los siete sistemas de cristal. Debido a que el sistema hexagonal puede representarse
convenientemente mediante cutro ejes, se puede definir un conjunto de cuatro dgitos de
indices de Miller - Bravais (hkil).
Ya que solamente son necesarios tres ejes para definir la geometria tridimensional de
un cristal, uno de los enteros es redundante, por lo que cuando tenemos que uno de los
planos intersepta cualquiera de los dos ejes en el plano basal (a 1, a2, a3), se determina la
interseccion con el tercer plano basal, como resultado, puede demostrarse que h + k = -i
para cualquier plano en el sistema hexagonal.
Plano A: [ 1/1 ; 1/ ; 1/-1 ; 1/1 ]
h + k = - i i = - h - k - 1 - 1 = -2
( 1 2 1 1 ), Plano A
Plano B: [ 1/(1/2) ; 1/ ; 1/(-1/2) ; 1/(1/2) ] h + k = - i 2 + 0 = -2
( 2 0 2 2 ), Plano B
Pag. 11
Trabajo Practico N1: "Estructura Cristalina".
7) La densidad de la plata esta dada por:
Ag (plata) R(atomico) = 0,144 nm
M(atomico) = 107,87 g
La forma del crista de plata es: Cubica Centrada en la caras (fcc)
Datos sacados del: (Tabla de datos Fisicos y Quimicos) "ciencia de los materiales para
ingenieros" - Shackelford a = 4.r(atomico).(2)-1/2
a = 4.0,144.(2)-1/2 nm
a = 0,407 nm
La densidad de una celda unitaria (de 4 atomos) es:
= Cant Atom . Masa Atom . 1021 nm3 =
4 atom. . 107,87 g . 1021 nm3
a3 . N Abogadro
cm3
0,067 nm3 . 6,023x1023 atom.cm3
= 10,692 g / cm3
que es aproximado al valor de tabla: 10,50 g/cm 3
Pag. 12
Trabajo Practico N1: "Estructura Cristalina".
8) La densidad de la plata esta dada por:
Cr (cromo) R(atomico) = 0,125 nm
M(atomico) = 52 g
La forma del crista de plata es: Cubica Centrada en el Cuerpo (bcc)
Datos sacados del: (Tabla de datos Fisicos y Quimicos) "ciencia de los materiales para
ingenieros" - Shackelford a = 4.r(atomico).(3)-1/2
a = 4.0,125.(3)-1/2 nm
a = 0,289 nm
La densidad de una celda unitaria (de 2 atomos) es:
= Cant Atom . Masa Atom . 1021 nm3 =
2 atom. 52 g . 1021 nm3
a3 . N Abogadro
cm3
0,024 nm3 . 6,023x1023 atom.cm3
= 7,195 g / cm3
que es aproximado al valor de tabla: 7,19 g/cm 3
Bibliografia utilizada:
1- "Qimica" - Hector Fernandez Serventi - Losada.
2- "Ciencia de los materiales para ingenieros" - James F. Sackelford - PHH.
Pag. 13
También podría gustarte
- Paper Múltiple de EscapeDocumento155 páginasPaper Múltiple de EscapeGerman Chiesa Docampo100% (1)
- TP MaterialesDocumento4 páginasTP MaterialesGerman Chiesa DocampoAún no hay calificaciones
- Analisis Numérico, Gradiente de TemperaturasDocumento13 páginasAnalisis Numérico, Gradiente de TemperaturasGerman Chiesa DocampoAún no hay calificaciones
- Guia Fisica 2Documento31 páginasGuia Fisica 2German Chiesa DocampoAún no hay calificaciones
- Trabajo 123425709287Documento3 páginasTrabajo 123425709287Mario VillamilAún no hay calificaciones
- Ramos Sedano Mapa Conceptual MetalurgiaDocumento2 páginasRamos Sedano Mapa Conceptual MetalurgiaDANIA RAMOS SEDANOAún no hay calificaciones
- LEY DE CO (1) ..TrabajoDocumento23 páginasLEY DE CO (1) ..TrabajoAlberto Ricardo100% (1)
- Tabla PeriodicaDocumento2 páginasTabla Periodicajacobito24Aún no hay calificaciones
- Examen AsmeDocumento12 páginasExamen AsmeAndrea FPresaAún no hay calificaciones
- Lab4 JoseCalderon20110373Documento12 páginasLab4 JoseCalderon20110373JoséCalderónAún no hay calificaciones
- Resumen Ceramicos Brandon RoblesDocumento1 páginaResumen Ceramicos Brandon RoblesBcrtAún no hay calificaciones
- Dry Glazes PDFDocumento5 páginasDry Glazes PDFdiana100% (1)
- Numeración de ElectrodosDocumento17 páginasNumeración de Electrodoshectorarenas100% (1)
- Usos Del Feldespato IngemmetDocumento54 páginasUsos Del Feldespato IngemmetJosé Miguel Cuadros NietoAún no hay calificaciones
- Practica 6 Analisis y Evaluacion de Muestras MetalograficasDocumento3 páginasPractica 6 Analisis y Evaluacion de Muestras MetalograficasAndres AlvarezAún no hay calificaciones
- Tarea 1. Ensayo, Historia de La Metalurgia y Su Relación Con Otras CienciasDocumento28 páginasTarea 1. Ensayo, Historia de La Metalurgia y Su Relación Con Otras CienciasKaren SierraAún no hay calificaciones
- Album de NazaretDocumento8 páginasAlbum de NazaretnoemiAún no hay calificaciones
- 03 02 Juntas - 034 A 090 CEISDocumento57 páginas03 02 Juntas - 034 A 090 CEISSebastian MartinezAún no hay calificaciones
- Hoja Excel para Analisis Fisico-Quimico Del AguaDocumento8 páginasHoja Excel para Analisis Fisico-Quimico Del AguaEscobar Soto FrankAún no hay calificaciones
- Memoria de Calculo TijeralDocumento31 páginasMemoria de Calculo TijeralAndre NavarroAún no hay calificaciones
- 32 Ventanas SP PDFDocumento5 páginas32 Ventanas SP PDFLucas DevesaAún no hay calificaciones
- 11.0 Mineralogía FísicaDocumento18 páginas11.0 Mineralogía FísicaMax Cabana SotoAún no hay calificaciones
- Aimur Catálogo de Productos 2014Documento180 páginasAimur Catálogo de Productos 2014VEMATELAún no hay calificaciones
- Tipos de AlteracionesDocumento5 páginasTipos de AlteracionesJordan Jeremy Miranda De la cruzAún no hay calificaciones
- Fundición de Cobre-Clase 9Documento114 páginasFundición de Cobre-Clase 9freddy.sucuytanaAún no hay calificaciones
- Exatub E71t-1 PDFDocumento2 páginasExatub E71t-1 PDFdietersimaAún no hay calificaciones
- Hojas de ProcesoDocumento6 páginasHojas de ProcesoSteven Ortegon SolanoAún no hay calificaciones
- Semana 4Documento24 páginasSemana 4ana belen aguilera casasAún no hay calificaciones
- Guion de Laboratorio Prácticas I y II (Para Imprimir) - 2022-23Documento20 páginasGuion de Laboratorio Prácticas I y II (Para Imprimir) - 2022-23Sergi Royo TroAún no hay calificaciones
- 1B. UNIDAD 1 Estructura Cristalina de Los Materiales Cerámicos 2020 (Copia en Conflicto de ALONSO 2022-02-10)Documento24 páginas1B. UNIDAD 1 Estructura Cristalina de Los Materiales Cerámicos 2020 (Copia en Conflicto de ALONSO 2022-02-10)Iraíz Aranzazú López GarcíaAún no hay calificaciones
- Melt SpinningDocumento3 páginasMelt SpinningLuis SanchezAún no hay calificaciones
- Astm e 340Documento8 páginasAstm e 340jesus medinaAún no hay calificaciones
- Materiales Entregable 2Documento2 páginasMateriales Entregable 2artynskuAún no hay calificaciones
- Unidad 2. La Madera y Otros MaterialesDocumento11 páginasUnidad 2. La Madera y Otros MaterialesDario MoralesAún no hay calificaciones