Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Trabajo Quimica
Cargado por
Hectorin Diaz ChavezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Trabajo Quimica
Cargado por
Hectorin Diaz ChavezCopyright:
Formatos disponibles
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
QUIMICA INORGANICA
Catedrtica:
Ing. Amb. Alma Delia Verezaluces
Villalobos
Alumno:
Hctor Daz Chvez
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
.d o
REACCIONES QUIMICAS
.c
m
o
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Reacciones Qumicas
Una reaccin qumica es un cambio o fenmeno que modifica la
composicin qumica de las sustancias, para formar sustancias de
composicin diferente. Tambin podemos decir que es un paso de un
sistema de condiciones iniciales a finales.
En toda reaccin qumica resaltamos dos etapas:
La inicial (llamado reactantes), antes del cambio
La final (llamado productos), despus del cambio.
La definicin de reactantes suele modificarse cuando se refiere a las
reacciones qumicas que se manejan en gran escala en campos
especializados. As por ejemplo, en los procesos industriales se les llama
materia prima, en procesos metalrgicos se llaman minerales o menas.
Adems segn la ley de conservacin de la masa, en una reaccin
qumica la masa del sistema en condiciones iniciales y finales es la misma;
segn la teora atmica diremos que durante una reaccin qumica solo
hay un reacomodo de tomos, lo que indica que el tipo y nmero de
tomos que contiene el sistema inicial y final es el mismo, slo que se
encuentran enlazados o unidos de manera diferente.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Reaccin de adicin o combinacin (sntesis)
Consiste en que dos o ms reactantes forman un solo producto. En este
tipo de reacciones generalmente se libera calor, es decir que son
exotrmicas. Es tpica en la formacin de un compuesto por combinacin
directa de sus elementos (sntesis).
Esquema general:
Ejemplos:
Sntesis de Lavoisier: mediante chispa elctrica el hidrogeno se combina
con el O2 para formar agua.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
2 H2 + O2
2 H2O(l)
Sntesis de Haber Bosh: a temperatura y presin alta se forma el
amoniaco a partir de H2 y N2 gaseosos.
N2(g) + 3 H2(g)
2 NH3(g)
Formacin del xido frrico
4 Fe(s) + 3 O2(g)
2 Fe2O3(s)
Formacin del cloruro de amonio
NH3(g) + HCl
NH4Cl(s)
Formacin de hidrxido de calcio
CaO(s) + CO2(s)
Ca (OH)2(s)
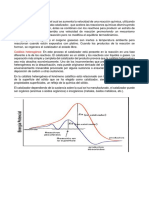
Reaccin de descomposicin
En este tipo de reacciones qumicas partimos de un solo reactante para
descomponerlo en dos o ms productos, por medio de un agente
energtico externo o un catalizador:
Si la energa es calorfica se llama pirlisis, es la descomposicin por
calentamiento a altas temperaturas.
Si la descomposicin es por accin de la luz se llama fotlisis
Si la descomposicin es por accin de un catalizador se llama
catlisis.
Si la descomposicin es por medio de la corriente elctrica, se llama
electrlisis.
Esquema general:
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Reacciones de pirolisis.
Dnde:
= smbolo de energa calorfica
Reacciones de electrlisis.
El sodio se obtiene lquido porque la electrlisis de la sal comn fundida
(NaCl lquido) se ha realizado a temperatura muy alta.
Reaccin de fermentacin alcohlica.
Esta reaccin se lleva a cabo por medio de una enzima, que es una
protena biocatalizadora.
Reaccin de catlisis
Se observa que en la catlisis, la sustancia que acta como catalizador no
aparece en los productos, ya que solo vara la rapidez con que se
desarrolla la reaccin o hace posible la reaccin.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Reaccin de desplazamiento o de sustitucin simple
En general se presenta cuando un elemento qumico ms activo o ms
reactivo desplaza a otro elemento menos reactivo que se encuentra
formando parte de un compuesto; el elemento que ha sido desplazado
queda en forma libre.
En el caso de los metales, los ms activos son los metales alcalinos y
metales alcalinos trreos.
En el caso de los no metales, los ms reactivos son algunos halgenos:
Fl2 , Cl2 , Br2 ; adems del oxgeno y el fsforo.
Esquema de una Reaccin de Desplazamiento:
Donde el elemento A es ms activo o de mayor reactividad que el
elemento B
1. Desplazamiento de hidrgeno
Todos los metales alcalinos y algunos metales alcalino-trreos (Ca , Sr , Ba),
que son los ms reactivos de los elementos metlicos, desplazan al
hidrgeno del agua fra.
2. Desplazamiento de metal
Un metal de un compuesto tambin puede ser desplazado por otro metal
en estado libre.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Una forma sencilla de predecir si en realidad va a ocurrir una reaccin de
desplazamiento de un metal o de hidrgeno, es referirse a una serie de
actividad (algunas veces llamada serie electroqumica)
Una serie de actividad es bsicamente un resumen conveniente de los
resultados de muchas posibles reacciones de desplazamiento a las ya
descritas.
De acuerdo con esta serie, cualquier metal que se ubique arriba del
hidrgeno lo desplazar del agua o de un cido, pero los metales situados
abajo del hidrgeno no reaccionaran ni con agua ni con cidos. De
hecho, cualquier especie de la serie reaccionar con cualquier otra
especie que se encuentre debajo de ella. Por ejemplo, el Zn est arriba del
Cu, entonces el zinc metlico desplazar a los iones del cobre.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Las reacciones de desplazamiento de metal tienen muchas aplicaciones
en los procesos metalrgicos, en los cuales interesa separar metales puros
a partir de sus minerales. Por ejemplo, el vanadio se obtiene por
tratamiento de xido de vanadio con calcio metlico:
De igual manera, el titanio se obtiene del cloruro de titanio de acuerdo
con la reaccin:
3. Desplazamiento de halgeno
Los halgenos son los elementos que se encuentran en el grupo VIIA de la
tabla peridica.
El comportamiento de halgenos en reacciones de desplazamiento de
halgenos se puede resumir en otra serie de actividad:
F2 > Cl2 > Br2 > I2
La fuerza de estos elementos como agentes oxidantes disminuye conforme
se avanza del flor al yodo en el grupo VIIA, as el flor puede reemplazar a
los iones cloruro (ya que tiene ms reactividad).
Las ecuaciones de desplazamiento son:
Las reacciones de desplazamiento de halgeno tienen una aplicacin
industrial directa. Los halgenos como grupo, son los elementos no
metlicos ms reactivos; todos ellos son agentes oxidantes fuertes, en
consecuencia se encuentran en la naturaleza en forma combinada (con
metales) como halogenuros pero nunca como elementos libres.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
De los 4 halgenos, el cloro es con mucho la sustancia qumica industrial
ms importante. En 1995 su produccin anual fue de 25 millones de libras,
con lo cual ocup el dcimo lugar entre los reactivos qumicos industriales
ms importantes. La produccin anual del bromo es de slo la centsima
parte de la del cloro, y la produccin de flor y de yodo es an menor.
Reacciones Redox
Tambin llamados reacciones de reduccin y oxidacin. Son aquellas que
ocurren mediante transferencia de electrones, por lo tanto hay sustancias
que pierden electrones (se oxidan) y otras que ganan electrones (se
reducen)
La gran mayora de reacciones que son de inters, en qumica son
reacciones de reduccin y oxidacin, como ejemplos tenemos: la
combustin de los hidrocarburos, la accin de los agentes blanqueadores
de uso domstico, la obtencin de los metales a partir de sus minerales, el
proceso de respiracin, proceso de digestin, reaccin que ocurre en la
pila seca y bateras, etc..
Oxidacin. Es el fenmeno mediante el cual una especie qumica pierde
electrones, por lo tanto el nmero de oxidacin (N.O.) aumenta
algebraicamente porque pierde carga negativas.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Reduccin. Es el fenmeno mediante el cual una especie qumica gana
electrones, por lo tanto el nmero de oxidacin (N.O.) disminuye
algebraicamente porque gana carga negativas.
Ejemplos:
El agente oxidante, es la sustancia qumica que al reducirse provoca la
oxidacin de otro; por lo tanto la sustancia que se reduce es agente
oxidante.
El agente reductor, es la sustancia quimia que al oxidarse provoca o causa
la reduccin de otro; por lo tanto la sustancia que se oxida es agente
reductor.
A continuacin se ilustra en forma resumida una reaccin redox:
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Descripcin del Proceso:
El tomo neutro del Zn (Zn0) pierde 2 electrones y se convierte en ion cinc
(Zn+2) segn la siguiente reaccin: Zn0
Zn+2 + 2e- .
semireaccin de oxidacin
Los dos tomos que pierde el Zn es ganado por el in ferroso (Fe+2) para
convertirse en tomo neutro (Fe0) Fe+2 + 2eFe0 ..
Semireaccin de reduccin
El in Zn+2 es forma oxidada del Zn0 y el Fe0 es la forma reducida del Fe+2
El sulfuro ferroso FeS, se llama oxidante porque contiene al in Fe+2 , que al
reducirse provoca la oxidacin del Zn. Al sulfuro de Zinc, ZnS, se le llama
forma oxidada porque contiene al Zn+2 que es la forma oxidada del Zn0
Como usted puede apreciar en la ilustracin anterior, para reconocer que
una sustancia se oxida o se reduce, solo basta analizar como varia el
nmero de oxidacin de una especie qumica al pasar de reactantes a
productos. En toda reaccin redox se cumple:
El fenmeno de reduccin y oxidacin es simultneo, es decir la oxidacin
y reduccin no se presenta en forma aislada
#e- (ganados) = #e- (perdidos)
La igualdad justifica la ley de conservacin de carga elctrica.
Las reacciones redox pueden ser clasificadas en tres grupos:
1 Reaccin Redox Intermolecular: Son las ms comunes, se caracterizan
porque el elemento que se oxida y el elemento que se reduce se
encuentran en sustancias qumicas diferentes, por lo tanto el agente
oxidante y el agente reductor son sustancias tambin diferentes.
2 Reaccin Redox Intramolecular: En este caso, el elemento que se oxida y
el elemento que se reduce se encuentran en el mismo compuesto, por lo
tanto el agente oxidante y el agente reductor es la misma sustancia
3 Reaccin Redox de dismutacin o desproporcin: Llamada tambin de
autoreduccin - oxidacin, es aquella donde un mismo elemento se oxida
y se reduce. Por lo tanto una misma sustancia qumica es oxidante y
reductora.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
.d o
.c
m
o
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
BALANCEO DE REACCIONES
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Balanceo de ecuaciones qumicas
Una reaccin qumica es la manifestacin de un cambio en la materia y la
isla de un fenmeno qumico. A su expresin grfica se le da el nombre de
ecuacin qumica, en la cual, se expresan en la primera parte los reactivos
y en la segunda los productos de la reaccin.
A+BC+D
Reactivos Productos
Para equilibrar o balancear ecuaciones qumicas, existen diversos
mtodos. En todo el objetivo que se persigue es que la ecuacin qumica
cumpla con la ley de la conservacin de la materia.
Balanceo de ecuaciones por el mtodo de Tanteo
El mtodo de tanteo consiste en observar que cada miembro de la
ecuacin se tengan los tomos en la misma cantidad, recordando que en
a) H2SO4 hay 2 Hidrgenos 1 Azufre y 4 Oxgenos
b) 5H2SO4 hay 10 Hidrgenos 5 azufres y 20 Oxgenos
Para equilibrar ecuaciones, solo se agregan coeficientes a las frmulas que
lo necesiten, pero no se cambian los subndices.
Ejemplo: Balancear la siguiente ecuacin
H2O + N2O5 NHO3
a) Aqu apreciamos que existen 2 Hidrgenos en el primer miembro (H2O).
Para ello, con solo agregar un 2 al NHO3 queda balanceado el Hidrogeno.
H2O + N2O5 2 NHO3
b) Para el Nitrgeno, tambin queda equilibrado, pues tenemos dos
Nitrgenos en el primer miembro (N2O5) y dos Nitrgenos en el segundo
miembro (2 NHO3)
c) Para el Oxgeno en el agua (H2O) y 5 Oxgenos en el anhdrido ntrico
(N2O5) nos dan un total de seis Oxgenos. Igual que (2 NHO3)
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Balanceo de ecuaciones por el mtodo de Redox (Oxidoreduccin)
En una reaccin si un elemento se oxida, tambin debe existir un elemento
que se reduce.
Recordar que una reaccin de xido reduccin no es otra cosa que una
perdida y ganancia de electrones, es decir, desprendimiento o absorcin
de energa (presencia de luz, calor, electricidad, etc.)
Para balancear una reaccin por este mtodo, se deben considerar los
siguiente pasos
1) Determinar los nmeros de oxidacin de los diferentes compuestos que
existen en la ecuacin.
Para determinar los nmeros de oxidacin de una sustancia, se tendr en
cuenta lo siguiente:
a) En una formula siempre existen en la misma cantidad los nmeros de
oxidacin positivos y negativos
b) El Hidrogeno casi siempre trabaja con +1, a excepcin los hidruros de los
hidruros donde trabaja con -1
c) El Oxigeno casi siempre trabaja con -2
d) Todo elemento que se encuentre solo, no unido a otro, tiene nmero de
oxidacin 0
2) Una vez determinados los nmeros de oxidacin, se analiza elemento
por elemento, comparando el primer miembro de la ecuacin con el
segundo, para ver que elemento qumico cambia sus nmeros de
oxidacin
0 0 +3 -2
Fe + O2 Fe2O3
Los elementos que cambian su nmero de oxidacin son el Fierro y el
Oxgeno, ya que el Oxigeno pasa de 0 a -2 Y el Fierro de 0 a +3
3) se comparan los nmeros de los elementos que variaron, en la escala de
Oxido-reduccin
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
0 0 +3 -2
Fe + O2 Fe2O3
El fierro oxida en 3 y el Oxigeno reduce en 2
4) Si el elemento que se oxida o se reduce tiene nmero de oxidacin 0, se
multiplican los nmeros oxidados o reducidos por el subndice del elemento
que tenga nmero de oxidacin 0
Fierro se oxida en 3 x 1 = 3
Oxigeno se reduce en 2 x 2 = 4
5) Los nmeros que resultaron se cruzan, es decir el nmero del elemento
que se oxido se pone al que se reduce y viceversa
4Fe + 3O2 2Fe2O3
Los nmeros obtenidos finalmente se ponen como coeficientes en el
miembro de la ecuacin que tenga ms trminos y de ah se continua
balanceando la ecuacin por el mtodo de tanteo.
Balanceo de ecuaciones por el mtodo algebraico
Este mtodo est basado en la aplicacin del lgebra. Para balancear
ecuaciones se deben considerar los siguientes puntos
1) A cada formula de la ecuacin se le asigna una literal y a la flecha de
reaccin el signo de igual. Ejemplo:
Fe + O2 Fe2O3
ABC
2) Para cada elemento qumico de la ecuacin, se plantea una ecuacin
algebraica
Para el Fierro A = 2C
Para el Oxigeno 2B = 3C
3) Este mtodo permite asignarle un valor (el que uno desee) a la letra que
aparece en la mayora de las ecuaciones algebraicas, en este caso la C
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Por lo tanto si C = 2
Si resolvemos la primera ecuacin algebraica, tendremos:
2B = 3C
2B = 3(2)
B = 6/2
B=3
Los resultados obtenidos por este mtodo algebraico son
A=4
B=3
C=2
Estos valores los escribimos como coeficientes en las frmulas que les
corresponden a cada literal de la ecuacin qumica, quedando
balanceada la ecuacin
4Fe + 3O2 2 Fe2O3
Balance ecuaciones. Mtodo in - electrn (medio cido)
Es el mtodo de balance de ecuaciones ms difcil de aplicar pero en
ocasiones es el nico posible.
En principio se debe identificar qu especie se oxida y cul se reduce
para plantear las dos semi reacciones. En segundo lugar se indica
cuantos electrones se estn perdiendo y cuntos se estn ganando.
Dependiendo de cul sea el medio se balancea la carga con H+ u OH-.
Luego se realiza el balance de masa con agua.
Finalmente se balancean los electrones de manera que los que se pierdan
sean igual a los que se ganan
Se halla la ecuacin final sumando las dos semi reacciones.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Ejemplo
Dada la reaccin del permanganato de potasio con agua oxigenada en
medio cido.
MnO4- + H2O2
Mn+2 + O2
El permanganato pasa a Mn+2 y el agua oxigenada a O2
Variacin de los nmeros de oxidacin
5 e - + MnO4-
Mn+2
El manganeso en el permanganato tiene nmero de oxidacin +7 (x + (2).4 = -1) y en el producto +2, es decir que ha disminuido en 5 su nmero
de oxidacin lo que implica la ganancia de 5 electrones. Esta es la
reaccin de reduccin.
El oxgeno del agua oxigenada ha pasado de -1 (nmero de oxidacin del
oxgeno en los perxidos a 0 correspondiente al oxgeno elemental). Es
decir que ha perdido un electrn por tomo de oxgeno. Esta es la
reaccin de oxidacin.
H2O2
2 e- + O2
Para balancear las cargas se utiliza H+ porque el medio es cido.
En la reaccin de reduccin se observa que la carga del lado de los
reactivos es -6 y del lado de los productos es +2. Como se debe balancear
con carga positiva se colocan los H+ del lado de los reactivos. En este caso
8 para que la carga total sea +28 H+ + 5 e- + MnO4-
Mn+2
En la reaccin de oxidacin se tiene 0 del lado de los reactivos y -2 en los
productos por lo que se balancea de ese lado con 2 H+H2O2
2 H+ + 2 e- + O2
Una vez realizado el balance de carga se realiza el de masa con agua.
8 H+ + 5 e- + MnO4H2O2
Mn+2 + 4 H2O
2 H+ + 2 e- + O2
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
Para igualar la cantidad de electrones es necesario multiplicar la primera
semi-reaccin por 2 y la segunda por 52. (8 H+ + 5 e- + MnO4-
Mn+2 + 4 H2O)
5(H2O2
2 H+ + 2 e- + O2
Si se realiza la suma de las dos semi-reacciones.
16 H+ + 10 e- + 2 MnO4- + 5 H2O2
2 Mn+2 + 8 H2O + 10 H+ + 10 e- +5 O2
Simplificando se tiene:
6 H+ + 2 MnO4- + 5 H2O2
2 Mn+2 + 8 H2O + 5 O2
Si se deseara plantear la ecuacin molecular, por ejemplo con cido
sulfrico, el procedimiento sera el mismo, el anin sulfato y el potasio no
interviene en la reaccin y finalmente se tendra:
3 H2SO4 + 2 KMnO4 + 5 H2O2
2 MnSO4 + 5 O2 + 8 H2O + K2SO4
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
ESTEQUIOMETRIA
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
ESTEQUIOMETRIA
Se entiende por Estequiometria al estudio de las proporciones entre los
reactivos y productos que participan en una reaccin qumica. Por
ejemplo para una reaccin hipottica:
A+2B
C+D
Siempre van a reaccionar 1 mol de A por cada 2 moles de B para que se
pueda formar 1 mol de C y otro de D.
La reaccin qumica balanceada es una ecuacin algebraica con todos
los reaccionantes en el primer miembro y todos los productos en el
segundo miembro. Dado que la estequiometria implica el uso de smbolos,
frmulas y ecuaciones qumicas, es necesario definir algunos conceptos,
leyes y procedimientos antes de adentrarnos en su estudio. Estos
conceptos son los de: peso atmico; smbolo qumico; frmula qumica;
peso molecular entre otros. As mismo debemos conocer las leyes
Ponderales y los procedimientos de Clculo de moles y balanceo de
ecuaciones.
LEYES DE LA COMBINACION QUMICA O LEYES PONDERALES.
Las leyes ponderales o de las combinaciones qumicas son las que rigen la
proporcin en masa y en volumen para formar compuestos. Para
determinar dichas proporciones se llevan a cabos los llamados clculos
estequiomtricos. La estequiometria por tanto, trata de la composicin de
las sustancias en masa y en volumen, es decir, de las relaciones de
combinacin qumica.
Las tres leyes Ponderales son:
1.- Ley de la Conservacin de la materia.
2.- Ley de las Proporciones definidas o Ley de Proust.
3.- Ley de las Proporciones mltiples o Ley de Dalton.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
LEY DE LA CONSERVACIN DE LA MATERIA.
Antonio Lorenzo Lavoisier estableci experimentalmente esta ley: En toda
reaccin qumica, la masa total permanece constante antes y despus de
la reaccin. Dicho de otro modo la materia no se crea ni se destruye, solo
se transforma. Esto lo constatamos al ver que la suma de las masas de los
reactantes es igual a la suma en masa de los productos.
Ejemplo:
Masas atmicas: K=39,1; I=127; Pb=207; N=14; O=16
Masa de los reactivos:
2KI = 2(39,1) = 78,2; 2(127) = 254 lo que indica que 2KI = 78,22 + 254 = 332,2
Pb = 207
(NO3)2 = (14)2 = 28; (163)2 = 96 lo que indica que (NO3)2 = 124
Total = 332,22 + 207 + 124 = 663,2 g/mol
Masa de los productos:
PbI2 = 207; I2= (127)2 = 254 lo que indica que PbI2 = 207 + 254 = 461
2KNO3 = 2(39,1) = 78,2; 2(14) = 28; 2(16)3 = 96 lo que indica que 2KNO3 =
78,2 + 28 +
96 = 202,2
Total = 461 + 202,2 = 663,2 g/mol
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
PROPORCIONES DEFINIDAS O LEY DE PROUST.
Cuando un elemento se une a otro para formar un compuesto, lo hace
siempre en una proporcin fija e invariable, que no se modifica por exceso
de alguno de ellos. Esto mismo lo podemos expresar diciendo que todo
compuesto qumico contiene siempre la misma proporcin de cada uno
de sus constituyentes.
Por ejemplo: 32 gramos de oxgeno se combinan con 4 gramos de
hidrgeno para formar 36 gramos del compuesto llamado agua. Si
efectivamente esa es la proporcin en masa, se puede representar as:
La relacin en masa en que se encuentran estos elementos para formar el
compuesto H2O, es la siguiente:
Y siempre van a reaccionar estas cantidades independientemente de que
una de ellas o las dos se encuentren en exceso o proporciones diferentes.
La proporcin en moles de ambos reactivos es 1:2, es decir, 1 mol de
oxgeno por dos moles de hidrgeno, para producir dos moles de agua.
Esta proporcin es fija independientemente del origen o de las condiciones
en que se de la reaccin.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
F -X C h a n ge
F -X C h a n ge
c u -tr a c k
N
y
bu
to
k
lic
LEY DE LAS PROPORCIONES MLTIPLES O DE DALTON.
Al explicar la Ley de Proust, la ilustramos con en el ejemplo del agua, en la
que la proporcin oxgeno y hidrgeno es 1:2. Pues bien, el hidrgeno y el
oxgeno tambin forman otro compuesto llamado perxido de hidrgeno
o agua oxigenada, solamente que en ste la relacin de hidrgeno y
oxgeno es de 1:1. Esto se explica mediante la siguiente reaccin:
En este caso la relacin en masa de los reactivos es la siguiente:
Gramos de oxgeno = 32/2 = 16/1
Gramos de hidrgeno
Mientras que la relacin de moles es 1:1. Esto segn Dalton se explica a
travs del siguiente enunciado: Al combinarse un elemento con otro para
formar un compuesto, puede hacerlo en diferentes proporciones, dando
origen a varios compuestos que guardan una relacin sencilla en nmeros
enteros, generalmente mltiplos el uno del otro. Es decir, en relacin de
1:1, 1:2, 2:1, 2:3, etctera.
.d o
.c
.d o
lic
to
bu
O
W
!
PD
O
W
!
PD
c u -tr a c k
.c
También podría gustarte
- Positive DisciplineDocumento108 páginasPositive DisciplineEdgard Hernandez100% (5)
- Mapa de AlgoritmoDocumento4 páginasMapa de AlgoritmoHectorin Diaz ChavezAún no hay calificaciones
- Supervisión GestálticaDocumento4 páginasSupervisión GestálticaHectorin Diaz ChavezAún no hay calificaciones
- Rutas de EvacuacionDocumento34 páginasRutas de EvacuacionTerceroAún no hay calificaciones
- Aprendizaje de La FelicidadDocumento15 páginasAprendizaje de La FelicidadHectorin Diaz ChavezAún no hay calificaciones
- Ámbitos Profesionales de La Terapia GestaltDocumento4 páginasÁmbitos Profesionales de La Terapia GestaltHectorin Diaz ChavezAún no hay calificaciones
- Empalmes Electricos PDFDocumento16 páginasEmpalmes Electricos PDFAlfredo Canahualpa50% (6)
- Emociones ArteviaDocumento4 páginasEmociones Arteviasusi20Aún no hay calificaciones
- 27 FormacionDocumento11 páginas27 FormacionHectorin Diaz ChavezAún no hay calificaciones
- Gestalt y El PerdónDocumento32 páginasGestalt y El PerdónDaniela FernándezAún no hay calificaciones
- Una Introducción A La Terapia GestaltDocumento2 páginasUna Introducción A La Terapia GestaltHectorin Diaz ChavezAún no hay calificaciones
- Historia de La Terapia GestaltDocumento5 páginasHistoria de La Terapia GestaltHectorin Diaz Chavez100% (1)
- Clave XPDocumento1 páginaClave XPHectorin Diaz ChavezAún no hay calificaciones
- Modulo Escuela Sindical Historia Del SindicalismoDocumento68 páginasModulo Escuela Sindical Historia Del SindicalismoHectorin Diaz ChavezAún no hay calificaciones
- Tipos de CalderaDocumento3 páginasTipos de CalderaHectorin Diaz ChavezAún no hay calificaciones
- La CalderaDocumento1 páginaLa CalderaHectorin Diaz ChavezAún no hay calificaciones
- Rotulos Tableros ElectricosDocumento1 páginaRotulos Tableros ElectricosHectorin Diaz ChavezAún no hay calificaciones
- Nomenclatura TV3Documento1 páginaNomenclatura TV3Hectorin Diaz ChavezAún no hay calificaciones
- Manual de Procedimientos CalderasDocumento16 páginasManual de Procedimientos CalderasHectorin Diaz ChavezAún no hay calificaciones
- Sistema de Agua HospitalDocumento3 páginasSistema de Agua HospitalHectorin Diaz ChavezAún no hay calificaciones
- El AguaDocumento8 páginasEl AguaHectorin Diaz ChavezAún no hay calificaciones
- Caldera de CondensaciónDocumento3 páginasCaldera de CondensaciónHectorin Diaz ChavezAún no hay calificaciones
- Tipos de CalderaDocumento3 páginasTipos de CalderaHectorin Diaz ChavezAún no hay calificaciones
- ProgramacionDocumento8 páginasProgramacionHectorin Diaz ChavezAún no hay calificaciones
- Características de Tipos de FamiliaDocumento1 páginaCaracterísticas de Tipos de FamiliaHectorin Diaz ChavezAún no hay calificaciones
- CalderaDocumento3 páginasCalderaHectorin Diaz ChavezAún no hay calificaciones
- El Término de Sector Informal Fue Hecho Popular en Los Círculos de Desarrollo Académico InternacionalDocumento3 páginasEl Término de Sector Informal Fue Hecho Popular en Los Círculos de Desarrollo Académico InternacionalHectorin Diaz ChavezAún no hay calificaciones
- Promulgacion de LeyesDocumento3 páginasPromulgacion de LeyesHectorin Diaz ChavezAún no hay calificaciones
- Fluidos y Sus ComponentesDocumento3 páginasFluidos y Sus ComponentesHectorin Diaz ChavezAún no hay calificaciones
- La Revolución Mexicana Fue Un Conflicto Armado Que Tuvo Lugar en MéxicoDocumento1 páginaLa Revolución Mexicana Fue Un Conflicto Armado Que Tuvo Lugar en MéxicoRaul GarciaAún no hay calificaciones
- Halógenos PROPIEDADESDocumento13 páginasHalógenos PROPIEDADESValeria RogoszAún no hay calificaciones
- Catalizador de Platino Soportado en Carbon Activado para Adsorcion de GasesDocumento9 páginasCatalizador de Platino Soportado en Carbon Activado para Adsorcion de GasesLuis Ramón GómezAún no hay calificaciones
- Estequiometria EjerciciosDocumento17 páginasEstequiometria EjerciciosleyderAún no hay calificaciones
- CatálisisDocumento3 páginasCatálisislaurarimaAún no hay calificaciones
- Atención de Emergencias Que Involucren GLPDocumento29 páginasAtención de Emergencias Que Involucren GLPJavier Carazas VariAún no hay calificaciones
- Operaciones 1111Documento11 páginasOperaciones 1111Paty ChiluisaAún no hay calificaciones
- Destilacion Diferencialp4Documento16 páginasDestilacion Diferencialp4Zzoomm ConectAún no hay calificaciones
- Práctico 2 2021 AgregadoDocumento18 páginasPráctico 2 2021 AgregadoDiego AlfonsoAún no hay calificaciones
- Tarea Van Deemter-Knox PDFDocumento9 páginasTarea Van Deemter-Knox PDFSergio Davila GonzalesAún no hay calificaciones
- Propiedades ColigativasDocumento8 páginasPropiedades ColigativasMARIAAún no hay calificaciones
- GTL PresentacionDocumento23 páginasGTL PresentacionJaén Carola Callejas PeñaAún no hay calificaciones
- Petroquimica ArialDocumento22 páginasPetroquimica ArialAcua Tellez Ian EmanuelAún no hay calificaciones
- Labo OrganigramaDocumento3 páginasLabo OrganigramaNeisa Merino BustamanteAún no hay calificaciones
- Evidencia 3 Química 2 - Primer ParcialDocumento4 páginasEvidencia 3 Química 2 - Primer ParcialServidor JuzzAún no hay calificaciones
- Power Plant PrimerDocumento16 páginasPower Plant PrimerLydi MerlinAún no hay calificaciones
- Taller OxigenoterapiaDocumento6 páginasTaller Oxigenoterapiamariavaletina torresfloresAún no hay calificaciones
- Cálculo Vaporización Estanque 42.000Documento7 páginasCálculo Vaporización Estanque 42.000maikolAún no hay calificaciones
- 1º Reacciones QuimicasDocumento35 páginas1º Reacciones QuimicasCarolinaAún no hay calificaciones
- 4.hdpe PFD Isbl + Osbl G3Documento2 páginas4.hdpe PFD Isbl + Osbl G3Daniela Almonacid MunozAún no hay calificaciones
- Sopa de Letras de Etileno - 3Documento1 páginaSopa de Letras de Etileno - 3Enrique AvilaAún no hay calificaciones
- Balanceo Por TanteoDocumento7 páginasBalanceo Por TanteoSamuel CarrilloAún no hay calificaciones
- Curso Básico de Procesos - DV3: Aldo Quaglia LusaresDocumento150 páginasCurso Básico de Procesos - DV3: Aldo Quaglia LusaresAlexis SánchezAún no hay calificaciones
- S14 S37 Electroquimica 2 2022Documento26 páginasS14 S37 Electroquimica 2 2022Ruth Valentina V - PAún no hay calificaciones
- LibroObraTurpial19 31Documento12 páginasLibroObraTurpial19 31Santiago LeónAún no hay calificaciones
- DESHIDRATACION No Convencional PDFDocumento80 páginasDESHIDRATACION No Convencional PDFErick Jhonhatan Limon0% (1)
- Guía Nº1 de Redox PDFDocumento8 páginasGuía Nº1 de Redox PDFKaren Martín Rozas SanAún no hay calificaciones
- Ejercicios Balance de Materia Sin Reaccion QuímicaDocumento4 páginasEjercicios Balance de Materia Sin Reaccion QuímicaleidyAún no hay calificaciones
- Acido MaleicoDocumento4 páginasAcido MaleicoAdrian Lopez LopezAún no hay calificaciones
- Evaluativo 2 - Primer Corte Corte RPDocumento6 páginasEvaluativo 2 - Primer Corte Corte RPSilvia SlimeAún no hay calificaciones
- Evaluacion de 10 BalanceoDocumento2 páginasEvaluacion de 10 BalanceoJulián Mesüt GöAún no hay calificaciones