Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Constante de Acidez
Cargado por
Evelyn J. HernandezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Constante de Acidez
Cargado por
Evelyn J. HernandezCopyright:
Formatos disponibles
"Constante de Acidez"
por:
Esmeralda Contreras Filio
En este proyecto experimental se determin la constante de acidez del cido actico (Ka=1.81*10 5 del HC2H3O2) en vinagre. La determinacin de la constante se realiz con una lata de chiles en vinagre, caso particular de los chiles de la comercial mexicana los cuales resultaron ser los mas cidos (se determin un pH de 3.15) en comparacin con varias marcas ms, la constante obtenida fue de: Ka = 4.27*10 7 la cual, comparada con la esperada fue muy alejada, en este caso, podramos argumentar que se debi a los condimentos que contienen los chiles y que pudieron influir en el resultado, y finalmente se realizaron varias pruebas organolpticas para identificar los gustos del publico consumidor.
Las concentraciones que existen cuando un sistema qumico alcanza su equilibrio reflejan tendencia intrnseca de los tomos a existir bien sea como molculas de reaccionantes o bien como molculas de productos. Por eso, al aprender a describir cuantitativamente el estado de equilibrio, seremos capaces de reemplazar razonamientos cualitativos acerca de la tendencia de una reaccin a proseguir por expresiones definidas y numricas del grado de conversin de reaccionantes a productos. Antes de abordar cualquier estudio cualitativo sobre los equilibrios qumicos, es imprescindible conocer qu es un equilibro qumico y por qu se produce. Los equilibrios qumicos son consecuencia de la reversibilidad de las reacciones: mientras los reaccionantes reaccionan dando lugar a los productos de la reaccin, estos productos tambin reaccionan simultneamente dando lugar a los reaccionantes. La reaccin avanza mientras que la velocidad a. la que se forman los productos es mayor a la velocidad inversa de formacin de reaccionantes. Finalmente, se llega a un estado de la mezcla en donde parece que la reaccin no avance por cuanto la composicin de la misma permanece constante. Este estado se denomina EQUILIBRIO QUMICO. Es importante notar que el equilibrio se establece no por el hecho de que la reaccin haya cesado sino como resultado del desarrollo simultneo y con igual velocidad de las reacciones directa e indirecta. Hay factores que van a afectar de manera indirecta o directa una reaccin dentro de las cuales son: 1.- Temperatura 2.- Presin 3.- volumen 4.- concentracin Es evidente que para que las velocidades tiendan a igualarse la velocidad directa disminuye y la velocidad inversa, por contra, aumenta a medida que transcurre la reaccin. Esto ocurre porque la velocidad de una reaccin es funcin de la concentracin de sus reaccionantes: a medida que transcurre la reaccin, la concentracin de los reaccionantes va disminuyendo (y, por tanto, su velocidad directa) y la concentracin de productos va aumentando (y, por tanto, su velocidad inversa). La velocidad de una reaccin, y por tanto el equilibrio qumico, tambin es funcin de la
temperatura. Efectivamente, una variacin de temperatura afecta de forma desigual a las velocidades directa e inversa en funcin si dichas reacciones son endotrmicas o exotrmicas: frente a un incremento de calor la velocidad de una reaccin endotrmica aumenta ms rpidamente que la de una exotrmica (esto ltimo constituye, en definitiva, una aplicacin del Principio de Le Chtelier. Supongamos la reaccin exotrmica: A + B C + D + q; siendo q el desprendimiento de calor. Al suministrar calor la reaccin se desplaza hacia la izquierda). El siguiente paso consiste en traducir al lenguaje matemtico lo expuesto hasta ahora de forma cualitativa. Para ello, supongamos la reaccin: a A+b B c C+d D La condicin de equilibrio, tal como hemos definido en los prrafos anteriores, es aquella en que las velocidades de reaccin en un sentido y otro son iguales, por tanto: K1[A]a [B]a = K2[C]c [D]d en donde [A], [B], [C] y [D] son las concentraciones en el equilibrio de los reactivos y los productos. Reordenando convenientemente los trminos de la anterior expresin matemtica, resulta que: K1 / K2 = [C]c [D]d / [A]a [B]a La relacin K1 / K2 es una constante (siempre que se trabaje a la misma temperatura; esto es, a 20C esta relacin tiene un valor y a 80C tiene otro) que nos puede servir como criterio cualitativo de equilibrio. A esta relacin le daremos el nombre de Keq (Constante de Equilibrio); por tanto, K1 / K2 = Keq. En funcin del tipo de reaccin de la que tratemos: cido-base, redox o de formacin de complejos; hablaremos de un tipo de equilibrio o de otro, y el aparato matemtico con el cual se abordan cuantitativamente Con respecto a lo anterior, el problema consisti en la determinacin experimental, de la constante de acidez. La hiptesis planteada fue que al hacer la determinacin de la constante del cido actico en vinagre estara en el rango de 1.81*10 -5 .
El conocimiento del equilibrio as como su manejo resulta de importancia fundamental para el ingeniero qumico para determinar el momento preciso del final de una reaccin y por consiguiente conocer los tiempos de residencia en un reactor. Hay infinidad de procesos industriales que tienen lugar a un pH determinado. Un ejemplo del manejo del pH, es en el control de los deshechos de subproductos industriales en las corrientes de las aguas residuales de la industria jabonera, de las industrias fabricantes de acumuladores de plomo, etc.
MATERIAL: 1. Matraz mL aforado 250
REACTIVOS: 1. NaOH
2. 3. 4. 5. 6.
Soporte universal Bureta Pipeta volumtrica Potencimetro Embudo de tallo corto 7. Parrilla de agitacin 8. Magneto
METODOLOGA: Estandarizacin de NaOH
2. Vinagre 3. Agua destilada
4.
ftalato de sodio
Se hierven 200 ml de agua para eliminar el dixido de carbono-libre disuelto en el agua en un matraz de fondo plano y se enfra el matraz bajo el chorro de agua, teniendo el cuidado de no agitar el agua innecesariamente lo que permitira al anhdrido carbnico disolverse nuevamente. En un matraz con tapn se agregan el agua fra, y 20 mL de solucin 6M de NaOH libre de carbonato, y se mezcla tapando para prevenir la absorcin de anhdrido carbnico. La solucin del hidrxido de sodio diluida debe estandarizarse; es decir, su concentracin exacta debe determinarse. Se obtienen varias muestras secas y puras de patrn primario (potassium
hydrogen phthalate (KHP), KHC8H4O4) para la titulacin de la solucin de NaOH. Disuelva el slido en aproximadamente 40 mL de agua destilada recientemente hervida. Se prepara de la misma manera la segunda y la terceras muestras. se agregan 2 gotas de Fenolftaleina a cada vaso y se titula Se limpia, enjuaga, y llena una bureta de la solucin de NaOH diluida. Al titular se usan incrementos de 1 mL de solucin cada 10 segundos por ver la coloracin. Asegurndose de agitar para lograr el mezclando completo de la NaOH con la solucin cida. Se agrega NaOH para que el pH vare (y se presente el vire del indicador rosa) y finalmente se agrega 1-2 mL ms NaOH. Se guardan los datos para el Anlisis Grfico. Se repite la operacin anterior con la segunda y terceras muestras. Titulacin de cido actico Se titularon tres muestras de 10.00 mL del vinagre con la solucin de NaOH recientemente estandarizada. Se omiti el indicador de la Fenolftaleina, para determinar con la computadora el grfico de la titulacin.
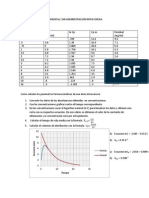
Titulacin del cido actico en un vinagre
Dentro de los resultados podemos observar que la constante fue muy lejana a la esperada dentro de los factores que intervinieron pudieron ser que cuando se titul no se deseco el ftalato y por lo tanto no se pudo obtener la molaridad 0 .1N que se tenia contemplada, otro factor pudo ser que los chiles en vinagre contienen muchos condimentos y no se realiz una separacin adecuada de los ingredientes que contena el vinagre.
A pesar de que se intent tener los menores errores posibles, la experimentacin no estuvo exenta de ellos. Como se mencion lneas arriba las fallas pudieron ser de diversa ndole, pero a nuestro parecer las que pudieron influir ms es la de la medicin potenciomtrica (en especial del cido actico) y la de contaminacin del vinagre por otros componentes.
Se propone para evitar estos errores, llevar a cabo las siguientes recomendaciones: Para evitar el error de contaminacin del cido actico se recomienda realizar una extraccin lquido - liquido, para la separacin del aceite contenido por el vinagre y una filtracin meticulosa para la separacin de los restos orgnicos procedentes de los sazonadores. Seguramente que estas recomendaciones ayudaran a una mejor experimentacin y un resultado ms preciso, que como consecuencia nos dejara ms satisfechos.
AYRES, G. H. Anlisis qumico cuantitativo. Harla. Mxico 1978. OROZCO, D. F. Anlisis qumico cuantitativo, Porra. Mxico, 1978 Mahan B. H. Qumica curso universitario, Fondo Educativo Interamericano, EUA., 1977
HIPOTESIS Conociendo la cantidad del cido actico podremos determinar experimentalmente el punto de equivalencia de la reaccin con una base de molaridad conocida. Se espera que el punto de equivalencia quede entre un pH de 8 y 10.
Repasar el concepto de neutralizacin. Determinar experimentalmente la concentracin de un cido dbil en un producto comercial mediante su neutralizacin con una base fuerte, utilizando dos tcnicas distintas de valoracin: mediante un indicador y por potenciometra. Conocer las ventajas e inconvenientes de cada una de las tcnicas. Determinar, a partir de datos experimentales, el punto de equivalencia de la valoracin y el pKa del cido valorado. FUNDAMENTO TERICO Existen muchos sistemas qumicos y biolgicos en los que aparecen cidos dbiles o bases dbiles, cuya concentracin es necesario determinar en muchas ocasiones. Para ello se recurre a realizar una valoracin cido-base, utilizando un agente valorante, que es una disolucin de concentracin bien conocida, que se hace reaccionar con una muestra problema, hasta alcanzar el punto de equivalencia, que puede determinarse mediante un indicador cido-base o por una tcnica instrumental
También podría gustarte
- La BibliaDocumento13 páginasLa BibliaJesús100% (1)
- SILVERADO InmovilizadorDocumento67 páginasSILVERADO InmovilizadorClaudio BravoAún no hay calificaciones
- Modeleria y FundiciónDocumento9 páginasModeleria y FundiciónJared CruzAún no hay calificaciones
- Filosofia y EticaDocumento22 páginasFilosofia y EticaJean Franco Lazo VillalvaAún no hay calificaciones
- Sistema Monitor Del 330d CatDocumento3 páginasSistema Monitor Del 330d CatLois Alarcon Canales100% (1)
- Cuentoscasa PDFDocumento56 páginasCuentoscasa PDFLū HërAún no hay calificaciones
- Art 05Documento7 páginasArt 05Laura Paola Corredor NietoAún no hay calificaciones
- Carismas espirituales extraordinariosDocumento13 páginasCarismas espirituales extraordinariosEvelyn J. Hernandez100% (1)
- INTRODUCCION GranulopoyesisDocumento10 páginasINTRODUCCION GranulopoyesisEvelyn J. HernandezAún no hay calificaciones
- Agonistas AdrenérgicosDocumento5 páginasAgonistas AdrenérgicosEvelyn J. HernandezAún no hay calificaciones
- Charla3 PDFDocumento24 páginasCharla3 PDFEvelyn J. HernandezAún no hay calificaciones
- Arenas MicologiaMedica 4a Capitulo MuestraDocumento17 páginasArenas MicologiaMedica 4a Capitulo MuestraDonny TorresAún no hay calificaciones
- Informe de AglutinacionDocumento2 páginasInforme de AglutinacionEvelyn J. HernandezAún no hay calificaciones
- Pipetas Practica 2Documento3 páginasPipetas Practica 2Evelyn J. HernandezAún no hay calificaciones
- Pipetas de Mohr y SerológicasDocumento2 páginasPipetas de Mohr y SerológicasEvelyn J. Hernandez100% (2)
- WWW - BVS.HN RHP PDF 1977 PDF Vol6-5-1977-7Documento3 páginasWWW - BVS.HN RHP PDF 1977 PDF Vol6-5-1977-7Evelyn J. HernandezAún no hay calificaciones
- 8aACIDOS NUCLEICOS 2010Documento11 páginas8aACIDOS NUCLEICOS 2010LeonelAún no hay calificaciones
- Conteo de LeucocitosDocumento7 páginasConteo de LeucocitosEvelyn J. HernandezAún no hay calificaciones
- INSCRIPCIONESDocumento2 páginasINSCRIPCIONESEvelyn J. HernandezAún no hay calificaciones
- Aportaciones de Armand V. FeigenbaumDocumento3 páginasAportaciones de Armand V. FeigenbaumEvelyn J. HernandezAún no hay calificaciones
- 2Documento1 página2Evelyn J. HernandezAún no hay calificaciones
- Ciclo de Fabricacion de Un MedicamentoDocumento2 páginasCiclo de Fabricacion de Un MedicamentoEvelyn J. HernandezAún no hay calificaciones
- 2Documento1 página2Evelyn J. HernandezAún no hay calificaciones
- Medida de HumedadDocumento3 páginasMedida de HumedadEvelyn J. HernandezAún no hay calificaciones
- Absorción sulfacetamida conejo vías administraciónDocumento6 páginasAbsorción sulfacetamida conejo vías administraciónVikodinnHigueraAún no hay calificaciones
- Cuestionarios de EvaLDocumento11 páginasCuestionarios de EvaLNeftali Rivera33% (3)
- FOTOFOSFORILACIONDocumento1 páginaFOTOFOSFORILACIONEvelyn J. HernandezAún no hay calificaciones
- Ejemplo EfmDocumento2 páginasEjemplo EfmEvelyn J. HernandezAún no hay calificaciones
- Diagrama para Analisis NACLDocumento1 páginaDiagrama para Analisis NACLEvelyn J. HernandezAún no hay calificaciones
- Consideraciones Farmacocinéticas en El Paciente CríticoDocumento8 páginasConsideraciones Farmacocinéticas en El Paciente CríticoEvelyn J. Hernandez100% (1)
- Cuestionarios de EvaLDocumento11 páginasCuestionarios de EvaLNeftali Rivera33% (3)
- Coloracion A La Flama, EveDocumento2 páginasColoracion A La Flama, EveEvelyn J. HernandezAún no hay calificaciones
- Coloracion A La Flama, EveDocumento2 páginasColoracion A La Flama, EveEvelyn J. HernandezAún no hay calificaciones
- Ejemplo Efm (1) EveDocumento2 páginasEjemplo Efm (1) EveEvelyn J. HernandezAún no hay calificaciones
- Diagrama para Analisis NACLDocumento1 páginaDiagrama para Analisis NACLEvelyn J. HernandezAún no hay calificaciones
- DefinicionesDocumento2 páginasDefinicionesEvelyn J. HernandezAún no hay calificaciones
- SOLIDWORKSDocumento6 páginasSOLIDWORKSAndrea RodriguezAún no hay calificaciones
- Lego Mindstorms AvanzadoDocumento8 páginasLego Mindstorms AvanzadoSofia100% (1)
- Caso Proyecto Empresa de Arriendo de Vehículos GDP1463 (1) - TaggedDocumento7 páginasCaso Proyecto Empresa de Arriendo de Vehículos GDP1463 (1) - TaggedGONZALO JACOB PROVOSTE MASIASAún no hay calificaciones
- Aborto DiferidoDocumento30 páginasAborto DiferidoCecy GuerraAún no hay calificaciones
- Viscosidad de La HarinaDocumento4 páginasViscosidad de La HarinaOliver RochaAún no hay calificaciones
- HBP CA Próstata Litiasis UrinariaDocumento2 páginasHBP CA Próstata Litiasis UrinariaBrandon Miguel Gaytan CaychoAún no hay calificaciones
- Dificultad Respiratoria Aguda en El NiñoDocumento18 páginasDificultad Respiratoria Aguda en El NiñoMeliSsa DanielaAún no hay calificaciones
- Sueroterapia RiesgosDocumento10 páginasSueroterapia RiesgosAnita Rodriguez SalgadoAún no hay calificaciones
- 2 - Exposicion Gestion Del RiesgoDocumento35 páginas2 - Exposicion Gestion Del RiesgorlmcAún no hay calificaciones
- Ostedyn para Bebés Mayores de 1 AñoDocumento2 páginasOstedyn para Bebés Mayores de 1 AñoGiulliana PaolaAún no hay calificaciones
- Clase 2 Enero 27 20222 Recursos HidricosDocumento55 páginasClase 2 Enero 27 20222 Recursos HidricosRafael Emilio Chacon GalanAún no hay calificaciones
- Bioquímica Humana (ENFERMERÍA)Documento5 páginasBioquímica Humana (ENFERMERÍA)Hugo LauAún no hay calificaciones
- Ortiz FragolaDocumento23 páginasOrtiz FragolaAndy MartínezAún no hay calificaciones
- Proyecto 2 Primer GradoDocumento38 páginasProyecto 2 Primer GradoFireXXXAún no hay calificaciones
- Tecno V Sistema Contra IncendiosDocumento31 páginasTecno V Sistema Contra IncendiosYariana BetancourtAún no hay calificaciones
- Reconoce Tu Necesidad de DiosDocumento2 páginasReconoce Tu Necesidad de DioszuvalpaAún no hay calificaciones
- Organismos de La Administración Del Transporte TerrestreDocumento5 páginasOrganismos de La Administración Del Transporte TerrestreCristian GuayanayAún no hay calificaciones
- 1. Periodo Pre-Hispánico 1.1 Antigüedad humana en Panamá 1.2 Lugar de tránsito e intercambio entre aborígenes. 2. Periodo Colonial 2.1. Europa y España a fines del siglo XV 2.2. Conquista hispánica en el Istmo 2.2.1Documento11 páginas1. Periodo Pre-Hispánico 1.1 Antigüedad humana en Panamá 1.2 Lugar de tránsito e intercambio entre aborígenes. 2. Periodo Colonial 2.1. Europa y España a fines del siglo XV 2.2. Conquista hispánica en el Istmo 2.2.1Lillian GordonAún no hay calificaciones
- Analis Ultimos 8 Capitulos Libro Educar para SerDocumento10 páginasAnalis Ultimos 8 Capitulos Libro Educar para SerJean Carlos CompresAún no hay calificaciones
- Operaciones Con El Ábaco para Primero de PrimariaDocumento4 páginasOperaciones Con El Ábaco para Primero de PrimariaArturo Miquiorena RuizAún no hay calificaciones
- GARCÍA JURADO ARENAS - La Fonética Del Español (Pp. 11-17 y 117-123)Documento13 páginasGARCÍA JURADO ARENAS - La Fonética Del Español (Pp. 11-17 y 117-123)Luca TrifilettiAún no hay calificaciones
- Evaluación Ciencias Naturales Primer Año Basico - Formularios de GoogleDocumento66 páginasEvaluación Ciencias Naturales Primer Año Basico - Formularios de GoogleLeticia GarcesAún no hay calificaciones
- Normas LegalesDocumento9 páginasNormas LegalesAngieOjedaAún no hay calificaciones
- La Edad de Los CambiosDocumento12 páginasLa Edad de Los CambiosKate Hernández.Aún no hay calificaciones