Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Gases
Cargado por
isjuankrlos0 calificaciones0% encontró este documento útil (0 votos)
5 vistas3 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
5 vistas3 páginasGases
Cargado por
isjuankrlosCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
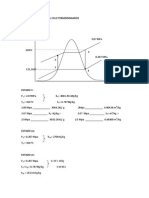
Ley de Boyle-Mariotte
A temperatura constante, los volmenes de una masa gaseosa son inversamente
proporcionales a las presiones que soporta
[2.17]
esquema de la ley de boyle para un gas
Isoterma. Grfico PV
Ley de Charles y Gay-Lussac
a presin constante, los volmenes de una masa de gas son directamente proporcionales
a las respectivas temperaturas absolutas
Gay-Lussac obtuvo experimentalmente:
o bien
[2.18]
Ley de Avogadro
Volmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones
de presin y temperatura, contienen el mismo nmero de partculas"
La cantidad de material se describe en funcin del nmero de moles. Esta unidad de materia
se corresponde a un nmero de partculas dado por la constante de Avogadro
N = 6.022 x 10
23
mol
-1
[2.19]
Simblicamente la Ley de Avogadro se describe como:
V n [2.20]
De acuerdo con la Ley de Avogadro, el volumen ocupado por un mol de cualquier gas es el
mismo a una temperatura y presin fijas. Cuando T = 0C y P = 1 atm, este volumen es de
22.4 L. Las condiciones antes mencionadas, T = 0C y P = 1 atm, se denominan
condiciones estndar, y se representa como PTE (presin y temperatura estndar).
El volumen de 1 mol de gas se representa como el volumen molar (Vm). Por lo tanto, la
Ley de Avogadro se representa por la siguiente igualdad:
V
m
= 22.4 lts a PTE [2.21]
Si denominamos n al nmero de moles de un cierto gas, entonces el volumen ocupado por
esta cantidad ser:
V = n.V
m
[2.22]
Al igual que con las otras leyes, la Ley de Avogadro slo se cumple para un gas poco
denso.
Conclusin
Las observaciones anteriores generalizan un comportamiento para los gases poco densos.
Estos gases poco densos y que cumplen con las leyes de Boyle, Charles y Avogadro se
denominan gases perfectos.
Combinando las conclusiones de las leyes que describen al gas perfecto:
V 1/P o PV = CTE Ley de Boyle
V T Ley de Charles
V n Ley de Avogadro
se puede concluir que
PV nT [2.23]
Para poner esta expresin como una igualdad, es necesario definir una constante de
proporcionalidad, que llamaremos constante molar del gas perfecto o, como se la conoce
usualmente, constante de los gases, simbolizada por R. El valor de R es independiente de la
naturaleza del gas, y vale 0.082 L atm mol
-1
K
-1
.
Con esta definicin, llegamos a una ecuacin que describe el comportamiento del gas
perfecto:
PV = nRT [2.24]
Obsrvese que la expresin [2.24] es equivalente a la [2.16]
También podría gustarte
- Encuesta CCsaneamietoDocumento6 páginasEncuesta CCsaneamietoisjuankrlosAún no hay calificaciones
- Analisis de Costos y Cantidades en Materiles para EdificacionesDocumento206 páginasAnalisis de Costos y Cantidades en Materiles para EdificacionesWalter Balcazar Montenegro100% (1)
- Ciclo de Transporte de Roca PaltoDocumento1 páginaCiclo de Transporte de Roca PaltoisjuankrlosAún no hay calificaciones
- HidrologiaDocumento18 páginasHidrologiaisjuankrlosAún no hay calificaciones
- Eje AGRICULTURADocumento2 páginasEje AGRICULTURAEdilberto Gálvez BarrientosAún no hay calificaciones
- Ejercicios Photoshop 2Documento48 páginasEjercicios Photoshop 2PichiskyAún no hay calificaciones
- Flujo MRRDocumento1 páginaFlujo MRRisjuankrlosAún no hay calificaciones
- Costos San IgDocumento23 páginasCostos San IgisjuankrlosAún no hay calificaciones
- Efect OsDocumento41 páginasEfect OsisjuankrlosAún no hay calificaciones
- Mercantilism oDocumento46 páginasMercantilism oisjuankrlosAún no hay calificaciones
- Redfistribucin AguaDocumento10 páginasRedfistribucin AguaisjuankrlosAún no hay calificaciones
- Problemas Resueltos de Programacion LinealDocumento20 páginasProblemas Resueltos de Programacion LinealCristina Cevallos HAún no hay calificaciones
- Eficiencia Termoca Del Cclo TermodinamicoDocumento3 páginasEficiencia Termoca Del Cclo TermodinamicoisjuankrlosAún no hay calificaciones
- TDRnutri 1Documento18 páginasTDRnutri 1isjuankrlosAún no hay calificaciones
- Analisis Precios Unitarios FinalDocumento73 páginasAnalisis Precios Unitarios FinalRafael BerrocalAún no hay calificaciones
- FORMATO05 Ay 05 BPIPDocumento2 páginasFORMATO05 Ay 05 BPIPisjuankrlosAún no hay calificaciones
- FORMATO05 Ay 05 BPIPDocumento2 páginasFORMATO05 Ay 05 BPIPisjuankrlosAún no hay calificaciones
- Microsoft Project - Cronograma Gantt - Canal San JoseDocumento2 páginasMicrosoft Project - Cronograma Gantt - Canal San JoseisjuankrlosAún no hay calificaciones
- Gandules FinalDocumento41 páginasGandules FinalisjuankrlosAún no hay calificaciones
- Data CaseriosDocumento6 páginasData CaseriosisjuankrlosAún no hay calificaciones
- Costos UnitariosDocumento8 páginasCostos UnitariosJhon Burga LlaxaAún no hay calificaciones
- Ley 29571 Código de Protección y Defensa Del ConsumidorDocumento48 páginasLey 29571 Código de Protección y Defensa Del ConsumidorJorge GarcíaAún no hay calificaciones
- Principales Indicadores INEIDocumento2 páginasPrincipales Indicadores INEIisjuankrlosAún no hay calificaciones
- El Ciclo EconomicoDocumento2 páginasEl Ciclo EconomicoisjuankrlosAún no hay calificaciones
- Indices UnificadosDocumento8 páginasIndices UnificadosJesus Cordova CoronadoAún no hay calificaciones
- LibroDocumento159 páginasLibroGuillermo Sacachipana ChuquicallataAún no hay calificaciones
- Polisa CarDocumento10 páginasPolisa CarisjuankrlosAún no hay calificaciones
- E 050Documento18 páginasE 050Johannes Angel Seas SolisAún no hay calificaciones
- Lab 5 - Analisis Granulometrico y Limites de AtterbergDocumento8 páginasLab 5 - Analisis Granulometrico y Limites de AtterbergKetsmy DesrosiersAún no hay calificaciones