Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Laboratorio de Problemas 1ra Ley
Cargado por
Mary Cielo LlerenaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Laboratorio de Problemas 1ra Ley
Cargado por
Mary Cielo LlerenaCopyright:
Formatos disponibles
LABORATORIO DE PROBLEMAS – PRIMERA LEY TERMODINAMICA
1. Cinco moles de N2 se expanden desde un estado 1 de 3 bar y 88 °C hasta un estado 2 de 1 bar y 88 °C.
Considere el N2 se comporta como un gas ideal. a) El primer proceso es una expansión isotérmica. a.1)
Dibuje el proceso en un diagrama PV; a.2) calcule W, Q, ∆U y ∆H. b) El segundo proceso es un
calentamiento a presión constante seguido por un enfriamiento a volumen constante. b.1) Dibuje la
trayectoria en un diagrama PV; b.2) calcule W, Q, ∆U y ∆H. Sol. b) W= 6000 J/mol.
2.- Un mol de un gas ideal, se expande isotérmicamente desde (P 1, V1, T) hasta (P2, V2,T) en una
etapa, frente a una P de oposición constante e igual a P 2. Si P1= 10 atm, P2=5 atm y T=300K,
¿Cuál es el trabajo realizado por el sistema? Sol. W=- 1243 J
3.- Si se lleva a cabo la misma expansión isotérmica, pero en 2 etapas, (P 1, V1, T) → (P’, V’,T) →
(P2,V2,T), formular la expresión para el trabajo producido en términos de T, P 1, P2 y P’. ¿Para qué
valor de P’ es máximo el trabajo de expansión que se puede obtener en estas dos etapas? Si el
estado inicial y final del sistema es el mismo que en el problema anterior, ¿Cuál es el trabajo
máximo producido? Sol. W=-1456 J
4.- Se lleva a cabo la misma expansión isotérmica, pero de forma reversible (infinitas etapas).
¿Cuál es ahora el trabajo producido por el sistema? Sol. W=-412 cal
5.- Calcular el trabajo producido por el medio sobre el sistema si el gas de los tres casos anteriores
se comprime desde (P2,V2,T) a (P1,V1,T), en una etapa, en dos etapas y de forma reversible.
Sol. 1 etapa W= -594cal, 2 etapas W=-493 cal reversible W=- 412 cal
6.- Calcular el trabajo efectuado cuando 50g de Fe se disuelven en ácido HCl. en a) un recipiente
cerrado y b) en un vaso de precipitados abierto a la atmósfera a 25ºC.
Sol. a) W= 0 J b) W=-2.2KJ
7.- Calcular el W realizado para evaporar 1 mol de H 2O a 100ºC, suponiendo la idealidad del vapor
de agua a esa temperatura. El volumen molar del agua líquida a 100ºC es 0,018 L/mol.
Sol. W= -3,10 K J
8.- Un gas ideal se comprime isotérmica y reversiblemente desde 10L hasta 1,5 L a 25ºC. El trabajo
ejecutado por el recipiente térmico es de 2250 cal ¿Cuántos moles de gas se hayan presentes
en el sistema? Sol: n= 2
9.- Calcúlese el trabajo desarrollado por 1 mol de gas que tiene la ecuación de estado:
PV = RT + APT – BP, cuando se expande según un proceso isotérmico reversible, desde el
volumen molar, V1 al volumen molar V2 . A y B son constantes características del gas.
V 2 −AT + B
Sol . W =−RT ln [ ]
V 1 −AT + B
10.- A temperatura constante, el efecto de la presión en el volumen de un líquido se describe por la
ecuación: V = Vo [1− β (P − P0 ]. Para el sistema el factor de compresibilidad es βT =
0,69x10−4bar−1 . Determinar el cambio de volumen y el trabajo que se realiza cuando el
sistema de 0,28m3 se somete a un cambio de presión desde 1 a 50 bares de manera
reversible. Dar el resultado en Julios. Sol ΔV=-1l W=2417,14 J.
11.- Un cilindro al que va ajustado un pistón sin rozamiento contiene 3 moles de He gaseoso a
P=1at, está introducido en un baño grande a la T constante de 400K. Calcular el Q, W, ΔU y
ΔH para el proceso: a) si la P aumenta reversiblemente a 5 at. b) si se alcanza el mismo
estado final pero el proceso ocurre de forma irreversible. Sol a) proceso reversible ΔU= 0J ,
ΔH=0 , W=16 KJ, Q=-16 KJ b) proceso irreversible ΔU= 0J, ΔH=0, W=39,9 KJ Q=-39,9 KJ.
12.- Una muestra de Ar de 1 at de presión y 25ºC, se expande reversible y adiabáticamente desde
0,5 dm3 a 1 dm3. Calcular la Tfinal del gas, el trabajo efectuado durante la expansión, el cambio
en la energía interna, la presión final del gas y el cambio de la entalpía durante la expansión.
Cv=12, 48 J K-1 mol-1 . Sol. TF= 188 K; W=-28J; ΔU=-28 J; PF=0,32 atm. ΔH=-47 J.
13.- Una muestra de 2 moles de Ar, en un cilindro de 5cm 2 de área transversal, a una P de 5 at, se
expande adiabáticamente contra una P externa de 1 at. Durante la expansión, empuja al
Pistón 46,3m. Si la Tinicial es 300K, ¿cuál es la Tfinal del gas? ( Cv)Ar =12,48 J/Kmol
Sol. TF= 206 K.
14.- ¿Qué cantidad de calor se necesita para elevar la temperatura de 1 mol de O 2 gaseoso desde
27ºC hasta 127ºC a la presión de 1 atm? Considérese que: Cp(O 2)=6,095+3,253x10-3 T -
1,017 x10-6 T2 (cal/K mol) . Sol. QP=ΔH=710 cal
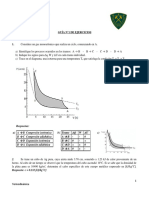
15.- Supóngase que 0,1 moles de un gas perfecto con Cv= 1,50 R , independiente de la temperatura,
sufre el proceso cíclico 1→2→3→4→1 que muestra la figura. Calcular el Q, W y ΔU en cada
etapa y para el ciclo completo.
16.- Una mol de gas ideal monoatómico Cv=3/2. R, que se encuentra inicialmente a 2 atm y 273 K
sufre una transformación reversible hasta un estado con una presión de 4 atm. El proceso se
caracteriza por P/V = const. Calcular V1, V2 y T2, además de ΔU, ΔH, Q y W (en calorías).
Sol. V1 = 11,2 L; V2 = 22,4L ; T2 = 1092,6K; ΔU = 2432,4 cal ΔH = 4054 cal W=-808,7 cal
Q=3241cal.
17.- Una mol de gas monoatómico ideal que se encuentra a una presión de 1 atm y una
temperatura de 273 K sufre un proceso reversible en el cual el volumen se duplica. aunque no
se especifica la naturaleza del proceso, se sabe que ΔH=500 cal y Q= 400 cal.
a) Calcular la temperatura y presión finales, así como ΔU y W en el proceso.
b) En caso de que el sistema llegase a las condiciones finales mediante un proceso que
Implicase un cambio isocoro y un cambio isotermo, ambos reversibles, calcular:
ΔH, ΔU, Q y W. Tómese CV= 3R/2.
18.- Se mezclan adiabáticamente y a P constante 20gr de hielo a –5ºC y 100gr de H 2O a 21ºC.
¿Cuál será la Tfinal del sistema? , Sabiendo que ΔH= 6009 fus KJ/mol y que Cp, H2O(s)= 37,7
J/ mol K , y Cp, H2O(l)= 75,3 J/ mol.K . ¿Habrá hielo en el sistema?. Sol. No habrá hielo, Tf
liquido =3,8ºC.
19.- Un calorímetro de latón de 125 gr. contiene un bloque de hielo de 250 gr y todo ello a –15ºC.
Calcular la cantidad de vapor de agua a 100ºC que se necesita añadir para que todo el
sistema llegue a la temperatura a 15ºC.
20.- Diga Verdadero o Faso:
a) ΔH es una función de estado.
b) CV es independiente de T en un gas perfecto.
c) ΔU=Q+W para todo sistema termodinámico en reposo en ausencia de campos externos.
d) Un proceso termodinámico se especifica al especificar el estado inicial y final del
proceso.
e) Para un sistema cerrado en reposo en ausencia de campos externos V=Q+W.
f) U permanece constante en todo proceso isotérmico en un sistema cerrado.
g) Q=0 en todo proceso cíclico.
h) ΔU=0 en todo proceso cíclico.
i) ΔT=0 para todo proceso adiabático en un sistema cerrado.
j) En un sistema cerrado que sólo realiza trabajo P-V, un proceso a presión constante con
Q>0 debe implicar que ΔT>0.
k) Cuando un gas real se expansiona contra el vacío en un recinto aislado térmicamente
su variación de energía interna es distinta de cero.
l) Dado que, en la fusión del hielo, la T se mantiene constante ΔU=0.
m) Para que haya transferencia de calor de una sustancia a otra tiene que haber una
diferencia de calor entre ambas.
n) La capacidad calorífica de un sistema puede ser negativa.
o) Para un gas real de ecuación de estado P(V-b) =RT, el cociente α/β es igual a R/(V-b).
21.- Demostrar que para un proceso adiabático de un gas ideal se cumple
[( ) ]
γ −1
γ P2 γ
H 2−H 1= RT 1 −1
γ−1 P1
, siendo T1 y P1 las coordenadas iníciales y T 2 y P2 las
finales.
22.- Un gas ideal que se encuentra dentro de un cilindro con pistón pasa por un ciclo compuesto de
tres procesos. Primero, el gas se expande a presión constante, donde se añaden 40 kJ de
calor y el trabajo de salida es de 10 kJ. Luego, es enfriado a volumen constante eliminando 50
kJ de calor. Finalmente, un proceso adiabático lleva al gas a su estado inicial.
a.- Haga un esquema P-V del proceso.
b.- Calcule los cambios de entalpía y energía interna de cada etapa y del ciclo completo, así
como el calor y el trabajo involucrado. Tabule sus resultados en kJ.
23.- Una sustancia hipotética cumple la ecuación de estado PV 2=BT, siendo B una constante. La
sustancia lleva a cabo un cambio de estado entre ( T 1, V1) a (T2, V2) a través de una trayectoria
en la que T varía linealmente con V. Según T= C 1V + C2. a) Obtenga una expresión del trabajo
del trabajo W en términos de B, C 1, C2, V1 y V2. b) Exprese C1 y C2 en función de T1, T2, V1 y
V2.
24.-18 g de agua líquida está encerrada bajo la acción de un pistón sin peso ni fricción a 100 ºC y 1
atm de presión. La presión disminuye suavemente debajo de 1 atm, de manera que el agua se
vaporiza isotérmicamente hasta total vaporización. Para este proceso q = 40711,3 J. El volumen
específico del agua a 100 ºC es 1,043 cm 3 y el volumen específico del vapor de agua es 1677
cm3 a 100ºC y 1 atm. Calcular el trabajo W debido a la vaporización, E y H para este proceso.
25.- Un aparato de cilindro y pistón sin fricción, rodado de la atmósfera, contiene un determinado
gas. Inicialmente la presión del gas es de 800 kPa y el volumen es 0,010 m 3 . Si el gas se
expande hasta un volumen final de 0,020 m 3, calcule el trabajo desempeñado, en Joules. La
presión atmosférica es de 100 kPa. Suponga que el proceso que conecta a los estados inicial y
final corresponde al tipo siguiente: a)la presión es constante, b)el producto PV es constante y c)
el producto PV2 es constante, d)compare los tres procesos reversibles mediante un diagrama PV.
Rptas. A) –7000, b) –4545, c) –3000.
26.- Se expande una cierta cantidad de dióxido de azufre gaseoso (SO 2), en el interior de un aparato
de pistón y cilindro. Se obtuvieron los siguientes datos:
P(bar) 3,45 2,75 2,07 1,38 0,69
V(m3/kg) 0,125 0,150 0,187 0,268 0,474
Calcule el trabajo de expansión por kilogramo de SO 2, en kilojulios. Rpta. 17,100
27.- La compresibilidad isotérmica para el agua líquida a 60 C puede obtenerse mediante :T=
0,125/[V(P+2740)], con :T en bares y V en cm3/g. Determine el trabajo requerido en Joules, para
comprimir 2,5 kg de agua isotérmicamente, de 1 a 600 bar. Rpta. 0,362
28. Se mantiene un aparato de pistón y cilindro que contiene 1,4 kg de gas a una presión constante
de 7 bar. En el curso del proceso el gas pierde 59 kJ de calor, en tanto que el volumen cambia de
1,5 a 0,09 m3. Determine el cambio de energía interna, en kJ/kg.
29. Una persona que vive en un cuarto de 4m x 5m x 5m enciende un ventilador de 100 Watts, antes
de salir del cuarto que se encuentra caluroso a 100 kPa y 30ºC. El espera que esté más frío
cuando regrese luego de 5 horas. Despreciando cualquier transferencia de calor, determine la
temperatura que encontrará cuando regrese. ¿Cuál sería el resultado si la potencia del ventilador
fuese de 50 W?
30. Un tanque rígido aislado se divide en dos partes iguales mediante una membrana. Al principio,
una parte contiene 3 kg de Nitrógeno a 500 kPa, 50 oC, y la otra parte está completamente vacía.
La membrana es perforada y el gas se expande hasta ocupar todo el tanque. Determine la
presión y temperatura finales. ¿Cuál sería el resultado si la sección llena contuviera 3 kg de
nitrógeno a 300 kPa?
31.- Un dispositivo de cilindro-émbolo tiene un anillo para limitar su carrera de expansión.
Inicialmente, como se muestra en la figura 1, la masa de aire es 2 kg a 500 kPa, 30 oC. Ahora se
transfiere calor hasta que el émbolo toca el anillo, punto en el cual el volumen es dos veces el
volumen original. Se sigue transfiriendo calor hasta que la presión en el interior llega al doble.
Determine la cantidad de calor transferido y la temperatura final.
También podría gustarte
- Laboratorio de Problemas 1ra LeyDocumento4 páginasLaboratorio de Problemas 1ra LeyVicente TitoAún no hay calificaciones
- Quimica Física2Documento22 páginasQuimica Física2Luis Galarreta LedesmaAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Termodinámica I: Serie de primera ley en sistemas cerradosDocumento2 páginasTermodinámica I: Serie de primera ley en sistemas cerradossabineAún no hay calificaciones
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- TermodinamicaDocumento2 páginasTermodinamicaAlexisAún no hay calificaciones
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Termodinámica problemas gases idealesDocumento2 páginasTermodinámica problemas gases idealesMiguel A. Aguilar VeraAún no hay calificaciones
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAún no hay calificaciones
- TemodinámicaDocumento12 páginasTemodinámicaMario Flores SalazarAún no hay calificaciones
- Tema 1.problemas Primer Principio (2016-2017)Documento4 páginasTema 1.problemas Primer Principio (2016-2017)Raquel Suárez López100% (1)
- Problemas Abril 2009Documento9 páginasProblemas Abril 2009María Milagros Irenesther Ríos MendozaAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Ejercicios Termodinamica BasicaDocumento13 páginasEjercicios Termodinamica BasicaNicolas Vasquez36% (11)
- Guía 1 PDFDocumento3 páginasGuía 1 PDFDaniel Andres Roa UmañaAún no hay calificaciones
- Taller Primera Ley 2018-1Documento6 páginasTaller Primera Ley 2018-1santiAún no hay calificaciones
- Problemario de TermodinamicaDocumento3 páginasProblemario de TermodinamicaAdal Sebastián Rodríguez LunaAún no hay calificaciones
- Term Odin A MicaDocumento23 páginasTerm Odin A MicaDiego NavarroAún no hay calificaciones
- ProbCap 2 TermAvDocumento5 páginasProbCap 2 TermAvHiram LsAún no hay calificaciones
- NNNMDocumento13 páginasNNNMredyz huamanAún no hay calificaciones
- Práctica de Termodinámica.Documento8 páginasPráctica de Termodinámica.ariadna mora sandiAún no hay calificaciones
- Guia 1 Fscoquimica PDFDocumento3 páginasGuia 1 Fscoquimica PDFjuanannaAún no hay calificaciones
- Problemario de TermodinamicaDocumento3 páginasProblemario de TermodinamicaVianey FloresAún no hay calificaciones
- Tablas de GasesDocumento26 páginasTablas de GasesSamuelSanAún no hay calificaciones
- Term Odin A MicaDocumento5 páginasTerm Odin A MicaLauraPaez15100% (1)
- Problemas - Termodinamica - Introduccion - Principio Cero y Primer PrincipioDocumento5 páginasProblemas - Termodinamica - Introduccion - Principio Cero y Primer Principioestuardo201212600Aún no hay calificaciones
- Problemario QeaDocumento8 páginasProblemario QeaJesus Escalera GuerraAún no hay calificaciones
- Guia 10Documento5 páginasGuia 10gomalapidolucianoAún no hay calificaciones
- Problemas de TermodinámicaDocumento33 páginasProblemas de Termodinámicakillerkool666Aún no hay calificaciones
- Física 2 - Guía 7 - 1er Principio TermoDocumento4 páginasFísica 2 - Guía 7 - 1er Principio TermoTamara FigueroaAún no hay calificaciones
- Ejercicios para El ParcialDocumento30 páginasEjercicios para El ParcialSharon Hernandez50% (2)
- Serie 1º LeyDocumento2 páginasSerie 1º LeyZúñiga Romero Ximena KaabAún no hay calificaciones
- Primera ley termodinámica: ejercicios de calor, trabajo y energía internaDocumento7 páginasPrimera ley termodinámica: ejercicios de calor, trabajo y energía internaOleggValVilAún no hay calificaciones
- Ejercicios Capitulo 1 y 2Documento4 páginasEjercicios Capitulo 1 y 2jhanrataAún no hay calificaciones
- Taller FisicoDocumento4 páginasTaller FisicoAndres MorenoAún no hay calificaciones
- Termo Prob Tema 3 22-23Documento3 páginasTermo Prob Tema 3 22-23Maria BallesterosAún no hay calificaciones
- Pr醕tico 3 - 2014 - Primera Ley de La Termodin醡icaDocumento2 páginasPr醕tico 3 - 2014 - Primera Ley de La Termodin醡icaBelen LilianAún no hay calificaciones
- Problem As MinasDocumento17 páginasProblem As MinasDaniel GaeteAún no hay calificaciones
- 1 Ley TermoDocumento2 páginas1 Ley TermoDiego Garzon GilAún no hay calificaciones
- Primera Ley de TermodinamicaDocumento6 páginasPrimera Ley de TermodinamicaEdgar Briceño100% (1)
- Procesos termodinámicosDocumento18 páginasProcesos termodinámicosMinerva Mine0% (1)
- Ejercicios de TermoDocumento4 páginasEjercicios de TermoMinato44100% (1)
- Ejercicios Teoría Aplicada Examen 120200317Documento6 páginasEjercicios Teoría Aplicada Examen 120200317María Menéndez MarínAún no hay calificaciones
- 07-1 - Práctica Primer PpioDocumento3 páginas07-1 - Práctica Primer PpioEmilia TamantiniAún no hay calificaciones
- PROBLEMAS DE TERMODINÁMICA APLICADADocumento2 páginasPROBLEMAS DE TERMODINÁMICA APLICADACandi Garcia BarberaAún no hay calificaciones
- Entropía y cambios de estado en sistemas termodinámicosDocumento4 páginasEntropía y cambios de estado en sistemas termodinámicosJose Vásquez GómezAún no hay calificaciones
- Problemas de Termotecnia sobre sistemas cerrados y abiertos con agua y gases idealesDocumento17 páginasProblemas de Termotecnia sobre sistemas cerrados y abiertos con agua y gases idealesClaudio Pincheira RozasAún no hay calificaciones
- Primera ParcialDocumento12 páginasPrimera ParcialCRISTHIAN NUÑEZ LIMACHEAún no hay calificaciones
- Ejercicios 1ra Ley UNALM 2014-IIDocumento2 páginasEjercicios 1ra Ley UNALM 2014-IIEduardo L. DíazAún no hay calificaciones
- Ejercicios TermodinamicaDocumento5 páginasEjercicios TermodinamicaDavid NaviaAún no hay calificaciones
- Xdoc - MX Termodinamica Guzlop EditorasDocumento10 páginasXdoc - MX Termodinamica Guzlop Editorasnewton bardajesAún no hay calificaciones
- Boletin Tema 2Documento7 páginasBoletin Tema 2franchantadaAún no hay calificaciones
- Guía5 Ejerc Termodinamica 4os DifDocumento4 páginasGuía5 Ejerc Termodinamica 4os DifalxcalixAún no hay calificaciones
- Guía de TermodinámicaDocumento9 páginasGuía de TermodinámicaJavier CortésAún no hay calificaciones
- Gua N1 Termodinmica 2015Documento9 páginasGua N1 Termodinmica 2015Elías Raphael Rubilar BugueñoAún no hay calificaciones
- Tarea Preexamen de Fisicoquímica IDocumento15 páginasTarea Preexamen de Fisicoquímica IAlexis Cisneros100% (1)
- Termodinámica Clase 2Documento15 páginasTermodinámica Clase 2Juana Claudia Panique PomaAún no hay calificaciones
- Leyes de La TermodinmicaDocumento3 páginasLeyes de La TermodinmicaAndreita ContrerasAún no hay calificaciones
- Cuestionario de CalorimetriaDocumento3 páginasCuestionario de CalorimetriaL.54Aún no hay calificaciones
- Agujeros Blancos WikiDocumento2 páginasAgujeros Blancos WikiYamunaque ElizabethAún no hay calificaciones
- Teoría Cinética Con Relación A Los Gases IdealesDocumento3 páginasTeoría Cinética Con Relación A Los Gases IdealesJessicaAún no hay calificaciones
- Tema 4.termodinamica QuímicaDocumento17 páginasTema 4.termodinamica QuímicaDiana Diez PrietoAún no hay calificaciones
- Fiqui EjerciciozDocumento13 páginasFiqui EjerciciozCamilo muñoz rimachiAún no hay calificaciones
- Guia TermodinamicaDocumento5 páginasGuia TermodinamicaNicolás Adrián MuñizAún no hay calificaciones
- Ley de Los Gases PDFDocumento14 páginasLey de Los Gases PDFAndrea HenaoAún no hay calificaciones
- ECOLOGÍADocumento11 páginasECOLOGÍAJIMENAAún no hay calificaciones
- Practica 1. Matrices y DeterminantesDocumento5 páginasPractica 1. Matrices y DeterminantesDK C Reynaldo Poma QuispeAún no hay calificaciones
- Regla de La Cadena ResueltosDocumento14 páginasRegla de La Cadena ResueltosJOSUE ROLANDO ROSARIO JARAMILLOAún no hay calificaciones
- Taller 3 (Segunda Ley de La Termodinamica)Documento3 páginasTaller 3 (Segunda Ley de La Termodinamica)Jessika Julieth Siachoque SuarezAún no hay calificaciones
- Tarea 5Documento6 páginasTarea 5Robert VD100% (1)
- Tippens FisicaTippens - Fisica - 7e - Diapositivas - 38b.ppt 7e Diapositivas 38bDocumento23 páginasTippens FisicaTippens - Fisica - 7e - Diapositivas - 38b.ppt 7e Diapositivas 38bjosegyssaAún no hay calificaciones
- 1ra Prueba Cálculo IIDocumento5 páginas1ra Prueba Cálculo IIAnimalshtAún no hay calificaciones
- Mecánica Racional G5 2020 PDFDocumento4 páginasMecánica Racional G5 2020 PDFSilvio StrajmanAún no hay calificaciones
- Experimento de Joule demostró calentamiento por trabajoDocumento2 páginasExperimento de Joule demostró calentamiento por trabajoandreal94Aún no hay calificaciones
- Masa Molar de Un Gas IdealDocumento8 páginasMasa Molar de Un Gas IdealGabriel RiosAún no hay calificaciones
- Ejeercicios Primera LeyDocumento10 páginasEjeercicios Primera LeyEli MejiaAún no hay calificaciones
- Problemas de gases resueltos paso a pasoDocumento3 páginasProblemas de gases resueltos paso a pasoTeresa CastilloAún no hay calificaciones
- GAS NATURAL I. Bernal SilvaDocumento36 páginasGAS NATURAL I. Bernal SilvaEdwin Arce ClaureAún no hay calificaciones
- Clase 10 - Semana 6Documento23 páginasClase 10 - Semana 6Mery QuezadaAún no hay calificaciones
- Modelo de IsingDocumento13 páginasModelo de IsingramonpablosAún no hay calificaciones
- Ecuaciones Navier StokesDocumento5 páginasEcuaciones Navier Stokesjuanpalomo19990925Aún no hay calificaciones
- Calculo ExamenDocumento14 páginasCalculo ExamenJavier MuñozAún no hay calificaciones
- Termodinamica Gal 19Documento4 páginasTermodinamica Gal 19A Jhonatan EspinoAún no hay calificaciones
- Grupo #4 Ejercício 4.17Documento6 páginasGrupo #4 Ejercício 4.17Celeste PonceAún no hay calificaciones
- Wa0009Documento23 páginasWa0009Adbiel Almanza HerreraAún no hay calificaciones
- Metodos de La Fisica MatematicaDocumento3 páginasMetodos de La Fisica MatematicaEnzo Montalvan CortesAún no hay calificaciones
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Nunca fuimos modernos: Ensayos de antropología simétricaDe EverandNunca fuimos modernos: Ensayos de antropología simétricaAún no hay calificaciones
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Estoicismo y dureza mental: Descubre los secretos psicológicos de la filosofía estoica en la vida moderna. Construir una autodisciplina inquebrantable y hábitos diarios que garanticen el éxitoDe EverandEstoicismo y dureza mental: Descubre los secretos psicológicos de la filosofía estoica en la vida moderna. Construir una autodisciplina inquebrantable y hábitos diarios que garanticen el éxitoCalificación: 4 de 5 estrellas4/5 (23)
- Borges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonDe EverandBorges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonCalificación: 5 de 5 estrellas5/5 (4)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Cálculo infinitesimal: El lenguaje matemático de la naturalezaDe EverandCálculo infinitesimal: El lenguaje matemático de la naturalezaCalificación: 5 de 5 estrellas5/5 (3)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Investigación de operaciones: Conceptos fundamentalesDe EverandInvestigación de operaciones: Conceptos fundamentalesCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Desastres y emergencias. Prevención, mitigación y preparaciónDe EverandDesastres y emergencias. Prevención, mitigación y preparaciónCalificación: 4 de 5 estrellas4/5 (5)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Estadística básica: Introducción a la estadística con RDe EverandEstadística básica: Introducción a la estadística con RCalificación: 5 de 5 estrellas5/5 (8)
- En busca de la mente: El largo camino para comprender la vida mental (y lo que aún queda por descubrir)De EverandEn busca de la mente: El largo camino para comprender la vida mental (y lo que aún queda por descubrir)Calificación: 4.5 de 5 estrellas4.5/5 (3)