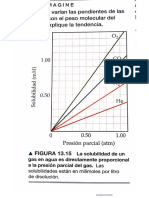
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Actividad 1-Equilibrio Químico
Cargado por
Ailin Gamarra0 calificaciones0% encontró este documento útil (0 votos)
11 vistas2 páginas5to cs nat
Título original
ACTIVIDAD 1-EQUILIBRIO QUÍMICO
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documento5to cs nat
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
11 vistas2 páginasActividad 1-Equilibrio Químico
Cargado por
Ailin Gamarra5to cs nat
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF o lea en línea desde Scribd
Está en la página 1de 2
10,3 Se introdujeron hidrégeno y bromo en itn recipiente cerrado de 5,00 du? a
1000 K.-Una vez aleanzado elequilibrio se determiné Ia presencia de 0,0100 mol
de Ha(g), 0, ,00200 mol de Bra(g) y 0, 872 mol de BBx(g),segin: .
Fa(g) + Bro(g) —= 2HBr(g)
a) Escribir la expresin de Ke.
De Calcular el valor de’K, a 1000 Kk
40.4 En un zecipiente cerrado de 5,00 dm? a 350 K estén en n equilibrio 0,100.mol de
CO(g), 0,200 mol de O2(g) y 0,0500 mol de CO2(g). Calcular el valor de Ke ~
para. la reaccién representada por:
2CO(g) + O2(g) == 2CO2(g)
10.5 En un recipiente cerrado de 8,00 dm? a 700 K estén en ciao 25,4 g de In(g)
y 0,400 g de Ho(g), segtin:
Ho(g) + In(g) == 2HI(g) K,(700 K) = 54,1 -
Caleular la concentraci6n molar de HI(g) en el equilibrio.
10.6 En un recipiente cerrado de 4,00 dm? a 25 °C se encuentran en equilibrio 50,0 g
de PCls(g) y 20,0 g de Cla(g).
a) Cénsiderando que ocurre la reaccién representada por:
BCls(g) = PCls(g) +Cla(e) —-Ke(298 K)= 5,50
calcular la cantidad de PCIs(g) en equilibrio. :
b) iCambiaria, el resultado del {tem anterior si el recipiente tuviera un volumen
de 3,00 dm??
c) 4Cambiarfa el valor de K; si a la misma temperatura el recipiente tuviera un
volumen distinto de 4,00 dm??
40.7 En un recipiente rigido de 15,0 dm®-a 1500 K, se introdujeron 6,00 mol de
S02(g) y 3,00 mol de On(g), produciéndose la reacci6n representada por: *
2802(g) + O2(g) == 280s(g)
Alcanzado el equilibrio, se determiné que la concentraci6n de SO3 era 0, 0560 M.
Calcular:
a) Jas concentraciones de SQ2 y de Op en el equilibrio,”
b) el valor de K, a 1500 K;
c) el valor de K; a 1500 K para la reacci6ni: 2803(g) + 2S02(g) + O2(2).
d) Indicar en un gréfico los valores de las cantidades de reactivos y producto
iniciales ¥y en el equilibrio, dibujando cualitativaniente ja evolucién de las
“jnismas énire ambos estados en funcién del tiempo,
10,8 Uni téolpicnte rigido de 20,0,dm" a 350°C contiene 2,00 mol de Op(g);,Man-
‘teniendo la temperatura constante se ‘agregan 2,00 mol de COp(g), Se aguarda
hhasta que la reacei6n alcance el equilibrio:
* 2C0(g) + 0118) = 2C0x(6) ©
En ese momento, la coticentfacién de CO; es 0,0480 M.
a) Calcular el valor de Xe dé la renccién a 350°C.
») Representargréfcamsénie la ovolucién de lab concentraciones de Jos tres gases
ai funcién del tempo : :
10.9 En un revipiente rigido de 4,00,dm® se introdujeron 2,00 mol de N2O«(g) a
500 K. Dada Ja reacci6n representada por:
°, NjOi(@)=+2NO2(2) - K-(500 K) = 0,530
Tndicar en tin gréfico 1os.valores de las concentraciones molares de reactivo y
producto‘en el-estado inicial y en el estado de equilibrio, dibujandé ademas en
forma cualitatva el cambio dé las mismas entre ambos estas.
‘Las reacciones en fase gascosa siguientes se Ilevaron a cabo dentro de recipientes
cerrados y-rigidos de 5,00 dm? a las temperaturas que se indican junto:a los
valores cortespondientes de Ke, Debajo de cada sistancia se informa la cantidad
inicia! introdncida, Pare cada cular las cantidades de reactivos ¥
productos una vez alcanzado él equilibrio.
a) COz(g) + Hol(g) == CO(g) +,Hz0(g) K-(500 °C) = 0,137
1,00 mol 2,00mol 0,00 mol 0,00 mel
b) PCls(g) + Chaig) © == PCls(g) K-(25.°C) = 0,182
1,00mel’ 0,00mol ‘1,00 mot
©) 2HIg): —=+ Fh). + b6)
0,00 mol 1,00.mol 2,00,mol
10.10
K-(698 K) = 0,0184
10.11 Para Ia reacci6n representada por:
2NO(g) +2Ha(g) —Na(g) + 2H20(g)
1) Bséribir las expresiones de las constantes Kp y Kz.
) Establecér la relacién que existe entre Kp Y Ke.
10.12. El PCls(g) se descompone segtin la reaccién representada por:
PCIs(g) = PC (g)#Cla(g)~ Kp(600K) = 2,15
Partiendo de PCls(g) puro en un recipiente cerrado y rfgido, calcular la presién
parcial del Cla(g) en equilibrio a 600 K si:
2) la presi6n inicial del PCls(g) es de 1,00 atm.
») la presién total en el équilibrio es de 1,00 atm.
10.13 El COCI(¢),se descompone segtin la reaccién representada poi:
COCK (g) ++ CO(g) + Clg) Ky (1000 °C) = 0,320
artiéndo de COCIn(g) puro en un recipiente cerrado y rigido, catcular la fraccisn
molar en equi io del CO(g) a 1000 °C si:
4) la presién inicial del COCI(g) es de 1,00 atm,
b) la presi6n total en el equilibrio es dle 1,00 atm.
10.14 El carbamato de amonio se descompone segiin la reaccidn representada por:
NHyNH2CO2(s) == 2NH3(g) + CO2(g)
Si la prési6n parcial de COx(g) es 0,300 atm’ después de que una muestra de
ccarbaruato de amonio puro alcanza el equilibrio en ua recipiente rigido cerrado a
500 K, zeudl es el valor dex; a dicha temperatura?
li ia ia ia ai
También podría gustarte
- Antigua GreciaDocumento4 páginasAntigua GreciaAilin GamarraAún no hay calificaciones
- El DeshieloDocumento8 páginasEl DeshieloAilin GamarraAún no hay calificaciones
- Difusión SimpleDocumento1 páginaDifusión SimpleAilin GamarraAún no hay calificaciones
- Cohen - La Teoría de La Historia de Marx, PP 40 A 44Documento6 páginasCohen - La Teoría de La Historia de Marx, PP 40 A 44Ailin GamarraAún no hay calificaciones
- 1.° CONTENIDO. Práctica de BIOMOLÉCULASDocumento7 páginas1.° CONTENIDO. Práctica de BIOMOLÉCULASAilin GamarraAún no hay calificaciones
- Ambiente Hardin, Etc1Documento4 páginasAmbiente Hardin, Etc1Ailin GamarraAún no hay calificaciones
- Revolucion 25 de MayoDocumento2 páginasRevolucion 25 de MayoAilin GamarraAún no hay calificaciones
- Trabajo de Investigacion: Trabajo Y Ciudadania 6to Naturales Parish RobertsonDocumento1 páginaTrabajo de Investigacion: Trabajo Y Ciudadania 6to Naturales Parish RobertsonAilin GamarraAún no hay calificaciones
- Mi UAI - Universidad Abierta InteramericanaDocumento1 páginaMi UAI - Universidad Abierta InteramericanaAilin GamarraAún no hay calificaciones
- Intercambios: Con Universidades Del MundoDocumento8 páginasIntercambios: Con Universidades Del MundoAilin GamarraAún no hay calificaciones
- FDQ 2022 - Solubilidad - Clase 3 de MayoDocumento5 páginasFDQ 2022 - Solubilidad - Clase 3 de MayoAilin GamarraAún no hay calificaciones
- Resumen D La Guerra FríaDocumento2 páginasResumen D La Guerra FríaAilin GamarraAún no hay calificaciones
- Respuesta A Los Ejercicios de Equilibrio QuímicoDocumento1 páginaRespuesta A Los Ejercicios de Equilibrio QuímicoAilin GamarraAún no hay calificaciones
- Estimulos en AnimalesDocumento1 páginaEstimulos en AnimalesAilin GamarraAún no hay calificaciones
- Problemas AmbienalesDocumento1 páginaProblemas AmbienalesAilin GamarraAún no hay calificaciones
- Ramas de La BiologiaDocumento2 páginasRamas de La BiologiaAilin GamarraAún no hay calificaciones
- Trabajo Integrador MultinacionalesDocumento11 páginasTrabajo Integrador MultinacionalesAilin GamarraAún no hay calificaciones
- Mision y VisionDocumento1 páginaMision y VisionAilin GamarraAún no hay calificaciones
- Actividad I Ley de Ohm .20Documento1 páginaActividad I Ley de Ohm .20Ailin GamarraAún no hay calificaciones
- Cómo Formar El Tercer CondicionalDocumento1 páginaCómo Formar El Tercer CondicionalAilin GamarraAún no hay calificaciones
- Unificación de Italia ActividadDocumento2 páginasUnificación de Italia ActividadAilin GamarraAún no hay calificaciones
- La Piramide Organizacional - EstructuraDocumento2 páginasLa Piramide Organizacional - EstructuraAilin GamarraAún no hay calificaciones
- Libro Mitos y RecuerdosDocumento37 páginasLibro Mitos y RecuerdosAilin GamarraAún no hay calificaciones
- The Way Up To HeavenDocumento1 páginaThe Way Up To HeavenAilin GamarraAún no hay calificaciones
- Unificacion Alemana Resumen para EstudiarDocumento2 páginasUnificacion Alemana Resumen para EstudiarAilin GamarraAún no hay calificaciones
- 1 TP BioDocumento1 página1 TP BioAilin GamarraAún no hay calificaciones
- Petroleo 5touDocumento2 páginasPetroleo 5touAilin GamarraAún no hay calificaciones
- Apunte 9 - Corriente EléctricaDocumento25 páginasApunte 9 - Corriente EléctricaAilin GamarraAún no hay calificaciones