Documentos de Académico
Documentos de Profesional
Documentos de Cultura
EVALUACIÓN DE Termodinamica SEMESTRE 2021
EVALUACIÓN DE Termodinamica SEMESTRE 2021
Cargado por
Ambar QuezadaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
EVALUACIÓN DE Termodinamica SEMESTRE 2021
EVALUACIÓN DE Termodinamica SEMESTRE 2021
Cargado por
Ambar QuezadaCopyright:
Formatos disponibles
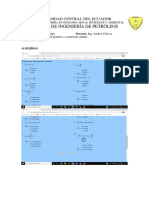
EVALUACIÓN DE FISICO QUIMICA SEMESTRE 2021-2021
NOMBRE:
1.- Cuatro gramos por mol de un gas ideal están confinados en un cilindro térmicamente
aislado a 6 atm y 27C. El pistón es soltado repentinamente, permitiendo una expansión del gas
contra la presión atmosférica (1 atm). Determinar la temperatura final y los cambios de
energía interna y entalpia, el calor transferido y el trabajo realizado.
2.- un cilindro contiene 3 moles de gas helio a temperatura de 300K. Calcular:
a) El calor que se debe transferir al gas para aumentar su temperatura hasta 500K si se calienta
a volumen constante
b) El calor que se debe transferir al gas a presión constante para aumentar su temperatura
hasta 500K
c) El trabajo realizado por el gas
e) Interprete todas las respuestas.
3.- Si se tiene agua en ebullición a 100C y atm, para el proceso de vaporización de 1 mol de
agua cuyo calor latente de vaporización es de 539 cal/g, calcúlese los valores de trabajo y de
variación de energía interna, interprete las respuestas.
4.- a) Un trozo de 100g de Aluminio a 122 F se introducen en un recipiente con 120 g de agua a
268 F. Determinar la temperatura del equilibrio alcanzada, sabiendo que las capacidades
caloríficas del aluminio y agua son 0.212 y 1 cal/g K respectivamente.
b) supóngase que el trozo de aluminio tiene una masa tres veces mayor que la indicada y su
temperatura inicial es de 300 C. Manténgase la hipótesis de ausencia de pérdidas caloríficas. El
calor latente de vaporización del agua es de 9630 cal/g mol
5.- Calcular ΔH a 298 K para la siguiente reacción
CaSO4(s) + H2O (g) = CaSO4.H2O
Sabiendo que:
CaSO4(s) + 400 H2O(l) = CaSO4 en 400 H2O ΔH= -109.8Kcal
CaSO4 en 400 H2O = CaSO4.H2O(s) +399 H2O (l) ΔH= 6095 cal
H2O(l) = H2O (g) ΔH= 9717 cal
También podría gustarte
- Aprende HaciendoDocumento7 páginasAprende HaciendoAmbar QuezadaAún no hay calificaciones
- Carrera de Ingeniería de Petróleos: Universidad Central Del EcuadorDocumento5 páginasCarrera de Ingeniería de Petróleos: Universidad Central Del EcuadorAmbar QuezadaAún no hay calificaciones
- Carrera de Ingeniería de Petróleos: Universidad Central Del EcuadorDocumento4 páginasCarrera de Ingeniería de Petróleos: Universidad Central Del EcuadorAmbar QuezadaAún no hay calificaciones
- Aplicaciones de Los AldehídosDocumento7 páginasAplicaciones de Los AldehídosAmbar QuezadaAún no hay calificaciones
- Aplicaciones de Los AlcanosDocumento8 páginasAplicaciones de Los AlcanosAmbar QuezadaAún no hay calificaciones
- La Importancia Y Problemática Del Turbo Combustible en La AviaciónDocumento43 páginasLa Importancia Y Problemática Del Turbo Combustible en La AviaciónAmbar QuezadaAún no hay calificaciones
- Encuesta de Relaciones ComunitariasDocumento3 páginasEncuesta de Relaciones ComunitariasAmbar QuezadaAún no hay calificaciones
- Encuesta ComunidadDocumento1 páginaEncuesta ComunidadAmbar QuezadaAún no hay calificaciones
- Encuesta Habitantes Comunidad - Relaciones ComunitariasDocumento4 páginasEncuesta Habitantes Comunidad - Relaciones ComunitariasAmbar QuezadaAún no hay calificaciones
- Metales Ferrosos 19 - 20Documento39 páginasMetales Ferrosos 19 - 20Ambar QuezadaAún no hay calificaciones
- 1 5111787230075027851Documento37 páginas1 5111787230075027851Ambar QuezadaAún no hay calificaciones
- CLASE VIRTUAL MECANICA DE FLUIDOS5Mayo2020NVDocumento170 páginasCLASE VIRTUAL MECANICA DE FLUIDOS5Mayo2020NVAmbar QuezadaAún no hay calificaciones
- Paredes Dipson Petróleos Artcuantitativo02Documento3 páginasParedes Dipson Petróleos Artcuantitativo02Ambar QuezadaAún no hay calificaciones
- Comportamiento Ético Del HinduismoDocumento6 páginasComportamiento Ético Del HinduismoAmbar QuezadaAún no hay calificaciones
- Lab. Fuerzas Concurrentes 2Documento3 páginasLab. Fuerzas Concurrentes 2Ambar QuezadaAún no hay calificaciones