Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Bimestral - Segundo Periodo - Septimo.quimica
Bimestral - Segundo Periodo - Septimo.quimica
Cargado por
Julian VargasTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Bimestral - Segundo Periodo - Septimo.quimica
Bimestral - Segundo Periodo - Septimo.quimica
Cargado por
Julian VargasCopyright:
Formatos disponibles
INSTITUCIÓN EDUCATIVA ASIGNATURA: QUÍMICA
COLEGIO INTEGRADO JUAN ATALAYA PERIODO: SEGUNDO
En COLIJA, “Todos sumamos para la excelencia” GRADO: SEPTIMO
Docente: Lic. Nohora A. Buendía G. FECHA: 05-06-2019
BIMESTRAL 7°
NOMBRE_________________________________________ 6. Cada nivel de energía de un átomo está constituido por uno o más
subniveles, debido a que los electrones que se hallan en el mismo
CODIGO_____CURSO_______AUTOEVALUACIÓN _______ nivel se diferencian ligeramente en la energía que poseen. Los
subniveles se designan por las letras s, p, d y f y cada uno tiene una
capacidad fija para alojar electrones. Esta capacidad es
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA
A. 2, 4, 6 y 8
RESPUESTA (TIPO I).
B. 2, 8, 18 y 32
C. 2, 4, 8 y 18
1. Según esta teoría, del físico James Clerk Maxwell, si el modelo
D. 2, 6, 10 y 14
atómico de Rutherford fuera cierto el electrón que gira debe emitir
energía en forma continua hasta caer sobre el núcleo y en
7. Los estudios de Schrödinger demostraron que existen distintos tipos
consecuencia, el átomo solo tendría un período de “vida” muy corto
de orbitales que se identifican con las letras: s, p, d y f. La forma y el
tamaño de un orbital dependen del nivel y del subnivel de energía en
A. los espectros de radiación
que se encuentra. El subnivel s está constituido por un solo orbital s, el
B. cuántica de la luz
subnivel p por tres orbitales p, el subnivel d formado por cinco orbitales
C. electromagnética
y el subnivel f está formado por
D. efecto fotoeléctrico
A. 5 orbitales
2. En 1900, el físico Max Planck estudió la radiación que emitían los
B. 4 orbitales
cuerpos cuando se calentaban a una temperatura suficientemente alta
C. 7 orbitales
y, a partir de sus resultados, enunció la teoría
D. 6 orbitales
A. de los espectros
8. El principio de la mínima energía establece que los electrones van
B. electromagnética
llenando los orbitales de menor energía; es decir, los que están más
C. del efecto fotoeléctrico
cerca al núcleo. Es importante recordar que el orden de energía de los
D. cuántica de la luz
orbitales no coincide con el de los niveles; para recordarlo se aplica
3. “Fenómeno que consiste en la producción de una corriente eléctrica
A. las secuencias
por parte de un metal cuando la luz incide sobre él”, lo anterior hace
B. los orbitales
referencia a
C. los niveles
D. la regla de las diagonales o diagrama de Môeller
A. teoría cuántica de la luz
B. teoría electromagnética
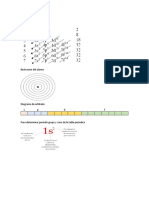
9. El diagrama de Môeller (figura) es muy útil para realizar la
C. efecto fotoeléctrico
configuración electrónica de un átomo. El sentido de las flechas se
D. los espectros de radiación
debe seguir puesto que indica el orden de energía creciente para los
orbitales atómicos. La configuración electrónica para un átomo de
4. En 1926, el físico Erwin Schrödinger consideró que la trayectoria
oxígeno Z= 8 es
definida por Bohr para el electrón debía sustituirse por la “probabilidad
de encontrarlo en una región especial llamada orbital”. En otras
palabras, por medio de esta ecuación se delimitan regiones en el
espacio que corresponden más o menos a los orbitales establecidos
por Bohr, pero que designan las zonas en las cuales la probabilidad de
hallar un electrón, en un momento dado, es muy alta. Lo anterior se
refiere a
A. postulados de Bohr
B. postulados de Broglie
C. los espectros de radiación
D. la ecuación de onda
5. Con los aportes hechos por Heisenberg, Schrödinger y de Broglie;
se estableció un nuevo modelo atómico constituido por dos zonas: el
núcleo y la nube electrónica (figura). Este modelo se conoce como
A. 1s3, 2s3, 3s2,
B. 1s2, 2s2, 2p2, 3s2
C. 1s2, 2s2, 2p4
D. 1s3, 2s3, 2p2
A. de órbitas
B. de electrones
C. mecánico-cuántico 10. La configuración electrónica para un átomo del elemento
D. de protones Z = 46 es
A. 1s2, 2s2, 2p8, 3p8, 4d10, 6d10, 6p6
B. 1s2, 2s8, 3p18, 4d10, 5p8
C. 1s2, 2s2, 3s2, 4s2, 2p6, 3p6, 4p6, 5d10, 6d10
D. 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d8
También podría gustarte
- Prueba Diagnostica Biologia NovenoDocumento2 páginasPrueba Diagnostica Biologia NovenoJulian VargasAún no hay calificaciones
- Planes de Destreza QuimicaDocumento40 páginasPlanes de Destreza QuimicaCarlos Oswaldo García Paredes100% (1)
- Guía Biología 10 Preguntas ICFESDocumento2 páginasGuía Biología 10 Preguntas ICFESJulian VargasAún no hay calificaciones
- Guía Biología 10 06052020Documento3 páginasGuía Biología 10 06052020Julian VargasAún no hay calificaciones
- Guía Biología 10 06052020 FotosintesisDocumento3 páginasGuía Biología 10 06052020 FotosintesisJulian VargasAún no hay calificaciones
- Guía Biología 10 25-01-2021 FotosintesisDocumento3 páginasGuía Biología 10 25-01-2021 FotosintesisJulian VargasAún no hay calificaciones
- Evaluación Tipo ICFES 27AGO2020Documento2 páginasEvaluación Tipo ICFES 27AGO2020Julian Vargas100% (1)
- TALLER 1 10 GRADO QUÉ ES HISTORIA DEL ARTE Taller 1 para EntregarDocumento13 páginasTALLER 1 10 GRADO QUÉ ES HISTORIA DEL ARTE Taller 1 para EntregarJulian VargasAún no hay calificaciones
- Guía 3 Artistica Decimo MARZODocumento5 páginasGuía 3 Artistica Decimo MARZOJulian VargasAún no hay calificaciones
- Guía #2.biología - Noveno.2PDocumento3 páginasGuía #2.biología - Noveno.2PJulian VargasAún no hay calificaciones
- Taller 2 Grado 11° Artística 24AGO2020Documento2 páginasTaller 2 Grado 11° Artística 24AGO2020Julian VargasAún no hay calificaciones
- Presentación2 - QU 281Documento50 páginasPresentación2 - QU 281franklin.g.c196Aún no hay calificaciones
- Quimica ADocumento59 páginasQuimica Aevert german mamani mermaAún no hay calificaciones
- Guia 2TP Aula 2017 PDFDocumento55 páginasGuia 2TP Aula 2017 PDFNahuel OcañaAún no hay calificaciones
- Evaluacion de QuimicaDocumento4 páginasEvaluacion de Quimicamprm2579Aún no hay calificaciones
- 2.2 Propiedades Atómicas y Su Variación PeriódicaDocumento6 páginas2.2 Propiedades Atómicas y Su Variación PeriódicaJavi Armstrong HurtadoAún no hay calificaciones
- Examen Bimestral de Cta 4 SecundariaDocumento4 páginasExamen Bimestral de Cta 4 Secundariasergio ato friasAún no hay calificaciones
- Pca Quimica 1ero. Bgu Elsita-CorregidoDocumento8 páginasPca Quimica 1ero. Bgu Elsita-CorregidoEduardo FajardoAún no hay calificaciones
- Números Cuánticos - CLASE DE QUIMICADocumento49 páginasNúmeros Cuánticos - CLASE DE QUIMICASEGECSACAún no hay calificaciones
- 002-SEMANA 2-Tema Configuración Electrónica Est - 0Documento8 páginas002-SEMANA 2-Tema Configuración Electrónica Est - 0alirio santanderAún no hay calificaciones
- Apuntes Química General Modulo 1Documento128 páginasApuntes Química General Modulo 1sreigtiAún no hay calificaciones
- Unidad 2 Físico-QuímicaDocumento26 páginasUnidad 2 Físico-QuímicabetianaAún no hay calificaciones
- Quimica A Química Inorgánica I Celeste Baldetti PDFDocumento4 páginasQuimica A Química Inorgánica I Celeste Baldetti PDFArmando UriasAún no hay calificaciones
- 10 Tarea Reglas de Hund en Orbitales FDocumento4 páginas10 Tarea Reglas de Hund en Orbitales FSelenaAún no hay calificaciones
- Cap3b El Atomo Mecano-Cuantico y Sist Periodico Valido - 1Documento70 páginasCap3b El Atomo Mecano-Cuantico y Sist Periodico Valido - 1VilelaGuevaraFiorellaAún no hay calificaciones
- Ficha 1 Bgu - Química Configuración ElectrónicaDocumento2 páginasFicha 1 Bgu - Química Configuración ElectrónicaJorge Granados100% (1)
- Ejercicios Resueltos de QuimicaDocumento15 páginasEjercicios Resueltos de QuimicaLuis Enrique Bautista DavidAún no hay calificaciones
- Quimica Cuestiones SelectividadDocumento119 páginasQuimica Cuestiones SelectividadJuana Quesada MorenoAún no hay calificaciones
- Quimic REINERDocumento2 páginasQuimic REINERAnthony TrianaAún no hay calificaciones
- Numeros Cuanticos y Configuracion ElectronicaDocumento19 páginasNumeros Cuanticos y Configuracion ElectronicaGuillermo Guerrero RiosAún no hay calificaciones
- TERCERODocumento13 páginasTERCEROFre EdisonAún no hay calificaciones
- Unidad 1. Naturaleza Electrica de La MateriaDocumento23 páginasUnidad 1. Naturaleza Electrica de La MateriaOscar QuinteroAún no hay calificaciones
- Teoría - Modelo Actual y Configuraciones ElectrónicasDocumento3 páginasTeoría - Modelo Actual y Configuraciones ElectrónicascarolinaAún no hay calificaciones
- PogilDocumento6 páginasPogilErick Lazo ValdiviaAún no hay calificaciones
- 03-Numeros CuanticosDocumento53 páginas03-Numeros CuanticosChristian GuillmarAún no hay calificaciones
- Configuración Electrónica (PresentaciónDocumento12 páginasConfiguración Electrónica (Presentaciónkevin moralesAún no hay calificaciones
- El ÁtomoDocumento4 páginasEl ÁtomoMarianaGarcíaAún no hay calificaciones
- Regla Del Serrucho para Segundo de SecundariaDocumento3 páginasRegla Del Serrucho para Segundo de SecundariaNazareth Narvasta AntonioAún no hay calificaciones
- 1 Átomos y Elementos 1 El Experimento de Rutherford EDocumento9 páginas1 Átomos y Elementos 1 El Experimento de Rutherford EJhenyferr Ramos RiveraAún no hay calificaciones
- 3.-TPM S-SMDocumento3 páginas3.-TPM S-SMAnthony PeredaAún no hay calificaciones