Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Propiedades Del Atomo de Carbono
Cargado por
yuraima bolivar0 calificaciones0% encontró este documento útil (0 votos)
9 vistas3 páginasTítulo original
Propiedades-Del-Atomo-de-Carbono
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
9 vistas3 páginasPropiedades Del Atomo de Carbono
Cargado por
yuraima bolivarCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
PROPIEDADES DEL ÁTOMO DE CARBONO
1. Tetravalencia del carbono
Es la capacidad que tiene el átomo de carbono de formar cuatro enlaces
covalentes cuando se une con otros átomos. Así, el carbono adopta la forma
de un tetraedro regular.
El carbono natural o basal presenta la configuración electrónica 1s 2 2s2 2p2.
Los dos primeros electrones ocupan el primer nivel de energía con sus
espines apareados 1s2, mientras que los cuatro restantes ocupan el
segundo nivel. En este último nivel, dos electrones están en los orbitales s
con espines apareados 2s2, y los otros dos, en orbitales p con espines
desapareados 2p2: 2px2 2py2.
El átomo de carbono solo debería formar dos enlaces covalentes. Sin
embargo, tiene la capacidad de formar cuatro enlaces covalentes. Este
fenómeno se explica por la propiedad de hibridación.
2. Autosaturación del carbono
Es la capacidad que tiene el átomo de carbono de compartir sus electrones
de valencia consigo mismo y formar cadenas carbonadas. Esta propiedad es
fundamental en el carbono y lo diferencia del resto de elementos químicos.
Cuando comparte sus electrones con otros átomos de carbono, puede
originar enlaces simples, dobles o triples; según comparta uno, dos o tres
pares de electrones.
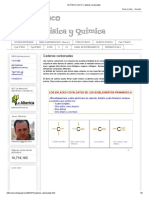
Enlace simple Enlace doble Enlace triple
Dos átomos de En este tipo de enlace, Se forma cuando los
carbono comparten un los átomos de carbono átomos de carbono
par de electrones. Es el comparten dos pares comparten tres pares
enlace más fuerte. La de electrones. Es más de electrones. Es el
geometría de la débil que el anterior y más débil de todos. Su
molécula con enlace tiene geometría plana geometría es lineal,
simple es tetraédrica, triangular. pues sus enlaces están
ya que cada átomo de dispuestos en línea
carbono tiene sus recta.
cuatro enlaces
dirigidos hacia los
vértices de un
tetraedro regular.
3. Hibridación del carbono
Es la mezcla de dos orbitales atómicos diferentes, pero del mismo nivel,
para formar nuevos orbitales apropiados mediante un reordenamiento de
electrones. Esta propiedad permite que el átomo de carbono se una a otro
átomo de carbono u otro elemento. La hibridación se presenta de varias
formas, las cuales dependen de que el orbital s se mezcle con 3, 2 o 1 de los
orbitales p. Así se generan los orbitales híbridos tipo sp 3, sp2 y sp.
Hibridación sp3
Es la mezcla de un orbital s con tres
orbitales p (px, py y pz) para formar cuatro
orbitales híbridos sp3 con un electrón cada
uno. De esta manera, cada uno de los
cuatro orbitales híbridos sp3 del carbono
puede enlazarse a otro átomo, es decir, el
carbono podrá enlazarse a otros cuatro
átomos. Se explica así la tetravalencia del
átomo de carbono.
Hibridación sp2
Este tipo de hibridación se da en casos donde el
carbono participa de un doble enlace, ya sea con otro
átomo de carbono u otro elemento. Si la hibridación
se genera entre el orbital s y dos orbitales p, se
formarán tres orbitales híbridos sp2.
Hibridación sp
Este tipo de hibridación se encuentra en
moléculas donde el carbono participa de un
enlace triple con otro átomo de carbono o un
átomo de otro elemento. Si la hibridación
ocurre entre el orbital s y un orbital p, se
formarán dos orbitales híbridos sp iguales
entre sí.
También podría gustarte
- Comunicación Efectiva y Afectiva Entre Padres y Hijos - Fundación BelénDocumento32 páginasComunicación Efectiva y Afectiva Entre Padres y Hijos - Fundación Belényuraima bolivarAún no hay calificaciones
- GHC Lo FaltanteDocumento1 páginaGHC Lo Faltanteyuraima bolivarAún no hay calificaciones
- DEPORTE Los Venezolanos Que Participarán en Los Juegos Olímpicos de TokioDocumento26 páginasDEPORTE Los Venezolanos Que Participarán en Los Juegos Olímpicos de Tokioyuraima bolivarAún no hay calificaciones
- Aspectos Positivos y Negativos de Las Redes SocialesDocumento18 páginasAspectos Positivos y Negativos de Las Redes Socialesyuraima bolivarAún no hay calificaciones
- Código Justicia Militar VenezuelaDocumento2 páginasCódigo Justicia Militar Venezuelayuraima bolivarAún no hay calificaciones
- Investigación (Mapa Mental)Documento1 páginaInvestigación (Mapa Mental)yuraima bolivarAún no hay calificaciones
- Tipos de Cadena 2Documento4 páginasTipos de Cadena 2yuraima bolivarAún no hay calificaciones
- El Origen Del Universo 221625 DownloableDocumento2 páginasEl Origen Del Universo 221625 Downloableyuraima bolivarAún no hay calificaciones
- EL FÍSICO LOCO - Cadenas CarbonadasDocumento9 páginasEL FÍSICO LOCO - Cadenas Carbonadasyuraima bolivarAún no hay calificaciones
- Deporte 3Documento1 páginaDeporte 3yuraima bolivarAún no hay calificaciones
- FISICA Línea Del Tiempo de Fisicos Mas ImportantesDocumento4 páginasFISICA Línea Del Tiempo de Fisicos Mas Importantesyuraima bolivarAún no hay calificaciones
- Gmail - 2 PremilitarDocumento2 páginasGmail - 2 Premilitaryuraima bolivarAún no hay calificaciones
- Qué es la metodología de investigaciónDocumento2 páginasQué es la metodología de investigaciónyuraima bolivarAún no hay calificaciones
- Gmail Quimica1Documento1 páginaGmail Quimica1yuraima bolivarAún no hay calificaciones
- Significado de BiologíaDocumento2 páginasSignificado de Biologíayuraima bolivarAún no hay calificaciones
- Apuntes de Todo Tipo - Química OrgánicaDocumento5 páginasApuntes de Todo Tipo - Química Orgánicayuraima bolivarAún no hay calificaciones
- Triptico Comunicacion Efectiva 1Documento3 páginasTriptico Comunicacion Efectiva 1yuraima bolivarAún no hay calificaciones
- Principios Del Liderazgo Militar - Documentos de Investigación - DorihanDocumento4 páginasPrincipios Del Liderazgo Militar - Documentos de Investigación - Dorihanyuraima bolivarAún no hay calificaciones
- Analisis Estructural y Literario de La Novela AngelinaDocumento2 páginasAnalisis Estructural y Literario de La Novela Angelinayuraima bolivarAún no hay calificaciones
- Gmail en QuimicaDocumento1 páginaGmail en Quimicayuraima bolivarAún no hay calificaciones
- Premilitar 4Documento41 páginasPremilitar 4yuraima bolivarAún no hay calificaciones
- 5 Aplicaciones de Biología en La Vida CotidianaDocumento26 páginas5 Aplicaciones de Biología en La Vida Cotidianayuraima bolivarAún no hay calificaciones
- Premilitar 3Documento41 páginasPremilitar 3yuraima bolivarAún no hay calificaciones
- Volumen - Wikipedia, La Enciclopedia LibreDocumento5 páginasVolumen - Wikipedia, La Enciclopedia Libreyuraima bolivarAún no hay calificaciones
- s13 Deba 3 4 Recurso Cts TextoDocumento4 páginass13 Deba 3 4 Recurso Cts TextoMartín Leonardo Lacuta VaraAún no hay calificaciones
- Gmail - GHC4Documento1 páginaGmail - GHC4yuraima bolivarAún no hay calificaciones
- Estructura novela IDocumento10 páginasEstructura novela Iyuraima bolivarAún no hay calificaciones
- ¿Cómo Se Originó El Universo - El Big Bang e Inflación CósmicaDocumento16 páginas¿Cómo Se Originó El Universo - El Big Bang e Inflación Cósmicayuraima bolivar0% (1)
- Medidas de Una Cancha de Baloncesto FIBADocumento7 páginasMedidas de Una Cancha de Baloncesto FIBAyuraima bolivarAún no hay calificaciones
- Tema - 2.5 - Orbitales Moleculares - CòpiaDocumento22 páginasTema - 2.5 - Orbitales Moleculares - CòpiaLaiaAún no hay calificaciones
- Configuración electrónica y números cuánticosDocumento16 páginasConfiguración electrónica y números cuánticosEdu AlaniaAún no hay calificaciones
- Problemas Enlace AeroUPM 2018 19Documento18 páginasProblemas Enlace AeroUPM 2018 19aeroespacio19Aún no hay calificaciones
- Teoría Orbitales MolecularesDocumento8 páginasTeoría Orbitales MoleculareslsoutusAún no hay calificaciones
- Taller N°4 Config Electr Grado 8°Documento4 páginasTaller N°4 Config Electr Grado 8°Ivan RiosAún no hay calificaciones
- Química Cuántica 2Documento2 páginasQuímica Cuántica 2Gloria SuazoAún no hay calificaciones
- Tipo de Numeros Cuanticos para Tercero de SecundariaDocumento7 páginasTipo de Numeros Cuanticos para Tercero de SecundariaKeytlin Garcia100% (1)
- Hibridaciones Luis CigarroaDocumento5 páginasHibridaciones Luis CigarroaMega DroidAún no hay calificaciones
- Lección 02 - Hibridación Del Carbono, Nitrógeno y OxígenoDocumento6 páginasLección 02 - Hibridación Del Carbono, Nitrógeno y OxígenoJholberth Isai Avalos GamboaAún no hay calificaciones
- Los Números CuanticosDocumento5 páginasLos Números CuanticosCristian CustodioAún no hay calificaciones
- Hibridación orbitales química orgánicaDocumento15 páginasHibridación orbitales química orgánicaDeysi ChavezAún no hay calificaciones
- Taller Sobre Teoria Del Orbital MolecularDocumento6 páginasTaller Sobre Teoria Del Orbital MolecularLeidy RamirezAún no hay calificaciones
- Tarea 6Documento4 páginasTarea 6Wendy JoselineAún no hay calificaciones
- 7 Unidad VII. QMA-103Documento10 páginas7 Unidad VII. QMA-103Omar SantosAún no hay calificaciones
- Química Cuántica: Números Cuánticos y Distribución ElectrónicaDocumento35 páginasQuímica Cuántica: Números Cuánticos y Distribución ElectrónicaElias De la CruzAún no hay calificaciones
- Métodos post-Hartree-FockDocumento7 páginasMétodos post-Hartree-FockJuan Carlos SantosAún no hay calificaciones
- Ejercicios Sem 2Documento2 páginasEjercicios Sem 2Juan Camilo CamachoAún no hay calificaciones
- 9° Sesión - CONFIGURACIÓN ELECTRÓNICADocumento2 páginas9° Sesión - CONFIGURACIÓN ELECTRÓNICAEliz0% (2)
- Q.I - Hibridación de OrbitalesDocumento9 páginasQ.I - Hibridación de OrbitalesaddymoshAún no hay calificaciones
- Mecanica Cuantica UpnfmDocumento27 páginasMecanica Cuantica Upnfmosman9011Aún no hay calificaciones
- Calculo Computacional de Estructuras MolecularesDocumento130 páginasCalculo Computacional de Estructuras MolecularesJuan Moises Gutierrez MesiasAún no hay calificaciones
- Ejerc Geometría Molecular TablaDocumento5 páginasEjerc Geometría Molecular TablaBrenda Juarez VilchezAún no hay calificaciones
- Tema 9Documento34 páginasTema 9Anahi MilagrosAún no hay calificaciones
- Orbitales y configuración electrónicaDocumento12 páginasOrbitales y configuración electrónicaAlondra PeraltaAún no hay calificaciones
- Ejercicios Enlaces en El CarbonoDocumento4 páginasEjercicios Enlaces en El CarbonoBelén PérezAún no hay calificaciones
- Equipo 2 PC 3 N17Documento7 páginasEquipo 2 PC 3 N17NATALIA BEATRIZ BRAVO REYESAún no hay calificaciones
- Similitudes y diferencias geomolecularesDocumento2 páginasSimilitudes y diferencias geomolecularesChristian RoncoAún no hay calificaciones
- Numeros Cuanticos Teoria y PracticaDocumento3 páginasNumeros Cuanticos Teoria y PracticaKennedy FloresAún no hay calificaciones
- Enlace CovalenteDocumento31 páginasEnlace Covalentehenry2392100% (5)
- 1° Medio - Química - Guía N°3 (Configuración Electrónica y Números Cuánticos)Documento7 páginas1° Medio - Química - Guía N°3 (Configuración Electrónica y Números Cuánticos)Rodrigo Andres González LlabresAún no hay calificaciones