Documentos de Académico
Documentos de Profesional
Documentos de Cultura
OBJETIVOS, Concluciones Informe7
Cargado por
Wendy Guaman MendozaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
OBJETIVOS, Concluciones Informe7
Cargado por
Wendy Guaman MendozaCopyright:
Formatos disponibles
OBJETIVOS:
Objetivo general:
determinar el calor de vaporación de una muestra de cloroformo.
Objetivo específico:
Determinar la composición de la muestra.
Observar y determinar que se cumple la ley de Clausius y clapeyron.
Ver las presiones de pavor del cloroformo a diferentes temperaturas.
CONCLUSIONES:
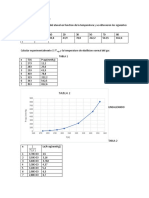
Al realizar el experimento nos dimos cuenta que al subir la temperatura bajaba la diferencia de alturas en el
manómetro, esto nos indica que la muestra tiene mayor presión de vapor al aumentar la temperatura.
Lo que no se pudo ver fue que para algún valor de temperatura la diferencia de alturas seria cero, como lo indicaba
la teoría, esto se debe a que la muestra no era muy concentrada en cloroformo como se pudo ver, es decir tiene más
agua que cloroformo.
Como se puede en la grafica de datos no están muy dispersos de la línea de ajuste, lo que nos permite determinar el
calor de vaporización con más exactitud, con más aproximación al valor teórico y por consiguiente con un error
pequeño.
CUESTIONARIO
2.-el punto de ebullición del etanol a una presión de 1 atm es de 78,3°C, y su entalpia de vaporización es de 39,3 KJ
¿Cuál será su presión de vapor a una temperatura de 46°C?
También podría gustarte
- t1 II.2020 FisicoquimicaDocumento3 páginast1 II.2020 FisicoquimicaWendy Guaman MendozaAún no hay calificaciones
- Informe 1 Elasticidad Guaman Mendoza Wendy A1Documento10 páginasInforme 1 Elasticidad Guaman Mendoza Wendy A1Wendy Guaman MendozaAún no hay calificaciones
- Bitacora Pendulo Simple. Guaman Mendoza WendyDocumento6 páginasBitacora Pendulo Simple. Guaman Mendoza WendyWendy Guaman MendozaAún no hay calificaciones
- Guaman Mendoza Wendy A1 Variacion de La Presion Con La ProfundidadDocumento6 páginasGuaman Mendoza Wendy A1 Variacion de La Presion Con La ProfundidadWendy Guaman MendozaAún no hay calificaciones
- Caratula de Laboratorio de FisicoquimicaDocumento1 páginaCaratula de Laboratorio de FisicoquimicaWendy Guaman MendozaAún no hay calificaciones
- AlcanosDocumento12 páginasAlcanosWendy Guaman MendozaAún no hay calificaciones
- Segundo Parcial de Fisicoquimic1 ModeloDocumento2 páginasSegundo Parcial de Fisicoquimic1 ModeloWendy Guaman MendozaAún no hay calificaciones
- Cuestionario Informe 7Documento2 páginasCuestionario Informe 7Wendy Guaman MendozaAún no hay calificaciones
- Practica 7 Lab de FisicoquimicaDocumento19 páginasPractica 7 Lab de FisicoquimicaWendy Guaman MendozaAún no hay calificaciones
- Guaman Mendoza Wendy. Elemento PaladioDocumento9 páginasGuaman Mendoza Wendy. Elemento PaladioWendy Guaman MendozaAún no hay calificaciones
- Pracitca 1 Lab de FisicoquimicaDocumento18 páginasPracitca 1 Lab de FisicoquimicaWendy Guaman Mendoza100% (1)
- Informe 1 Elasticidad Guaman Mendoza Wendy A1Documento11 páginasInforme 1 Elasticidad Guaman Mendoza Wendy A1Wendy Guaman MendozaAún no hay calificaciones
- Evolucion Del AtomoDocumento1 páginaEvolucion Del AtomoWendy Guaman Mendoza0% (1)
- Pracitca 1 Lab de FisicoquimicaDocumento19 páginasPracitca 1 Lab de FisicoquimicaWendy Guaman MendozaAún no hay calificaciones