0% encontró este documento útil (0 votos)
495 vistas33 páginasIng Reacciones
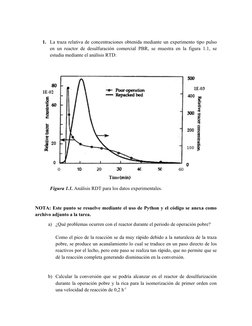
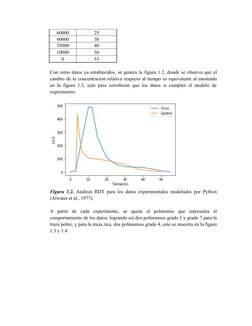
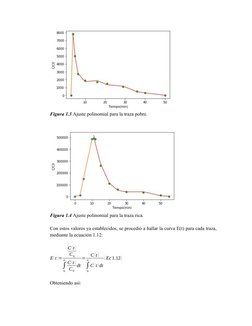
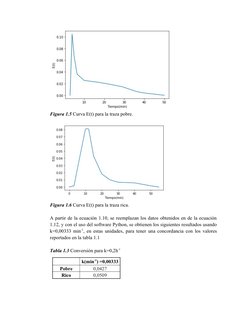
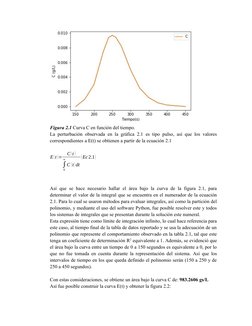
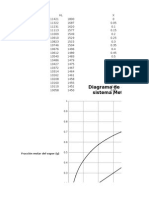
Este documento presenta los resultados de un análisis de trazado de residencia temporal (RTD) realizado en un reactor de desulfurización. Muestra la curva RTD obtenida experimentalmente y analiza los datos para calcular las conversiones que se podrían alcanzar con diferentes velocidades de reacción para operaciones pobres y ricas en el reactor, tanto para una reacción de primer orden isoterma como adiabática.
Cargado por
TATIANA CATALINA LÓPEZ ZAPATADerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
495 vistas33 páginasIng Reacciones
Este documento presenta los resultados de un análisis de trazado de residencia temporal (RTD) realizado en un reactor de desulfurización. Muestra la curva RTD obtenida experimentalmente y analiza los datos para calcular las conversiones que se podrían alcanzar con diferentes velocidades de reacción para operaciones pobres y ricas en el reactor, tanto para una reacción de primer orden isoterma como adiabática.
Cargado por
TATIANA CATALINA LÓPEZ ZAPATADerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd