Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Orgánica Informe
Orgánica Informe
Cargado por
Diego Bocanegra0 calificaciones0% encontró este documento útil (0 votos)
6 vistas2 páginasDeterminación de una muestra desconocida
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoDeterminación de una muestra desconocida
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
6 vistas2 páginasOrgánica Informe
Orgánica Informe
Cargado por
Diego BocanegraDeterminación de una muestra desconocida
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
RESUMEN: puede sintetizar fácilmente el ácido cinámico.
El siguiente esquema de reacción ofrece un
Para la práctica de obtención de (E)-2-ciano-
mecanismo posible de la condensación de
3-fenilacrilamida mediante la condensación
Knoevenagel:
de Knoevenagel que es una de las reacciones
más utilizadas en la síntesis de compuestos
orgánicos, se obtuvo un rendimiento de %.
También el punto de fusión experimental
dando °C, que con el reportado tiene una
variación relativa.
INTRODUCCIÓN:
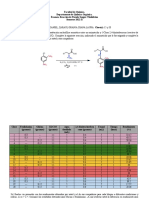
La condensación de Knoevenagel es una Imagen 1. Mecanismo de reacción de
reacción, en la que intervienen aldehídos y Knoevenagel.
cetonas por una parte, y por la otra, enlaces
Inicialmente, la amina secundaria se añade al
metilenos activos, influenciados por la
carbonilo. En condiciones deshidratantes se
participación de bases débiles. Los
podría obtener una enamina. Pero una de las
compuestos con hidrogeno activo se
ventajas de la reacción de Knoevenagel son
condensan con aldehídos y cetonas, estas
las condiciones suaves que requiere. De
reacciones son de tipo aldol. La síntesis
hecho, se puede realizar en un ambiente
consiste en la condensación de ácido
acuoso. El resultado es entonces una sal de
malónico con aldehídos y cetonas para dar
iminio, para la cual se escribe una fórmula de
productos intermedios de carácter aldólico,
resonancia con la carga positiva en el
de los cuales por pérdida de agua se forman
carbono. Al observar el producto de este
diácidos carboxílicos insaturados. Se
segundo paso, parece que el carbono α actúa
relaciona con las de adición aldólica,
como un carbanión. Pero estamos en un
condensación de Claisen y síntesis del éster
ambiente ácido, y la reacción no puede
malónico. La reacción de Knoevenagel puede
proceder a través de la formación de un
efectuarse de diversas maneras; el éster
carbanión (en general, el ambiente ácido
malónico, el éster acetilácético, el cianato de
estabiliza las cargas positivas, mientras que el
etilo u otra sustancia con un hidrógeno alfa
básico estabiliza las cargas negativas). El
reactivo, se condensan fácilmente con grupos
mecanismo propuesto es entonces
carbonilos de aldehídos o cetonas en
concertado, hecho posible por el carácter
presencia de una base, y la reacción da origen
electrófilo muy fuerte del carbono adyacente
a derivados etilénicos de dichos ésteres. Esta
al nitrógeno. El nitrógeno extrae un protón
reacción es importante en la química
del carbono en α (entre los dos carbonilos) y
orgánica, siendo un camino especial de la
simultáneamente los dos electrones de
misma, la variante Doebner. El procedimiento
enlace se mueven en el mismo carbono. Una
que sigue el mecanismo es que el aldehído o
vez formado el abducido, ya que se tiene un
cetona se hace reaccionar con ácido malónico
compuesto 1-3 dicarbonilo sustituido en α y
en piridina, en presencia de una amina como
se encuentra en un ambiente ácido, tiene una
catalizador (usualmente pirrolidina o
descarboxilación espontánea (-CO2). Se da
piperidina), originando así que el diácido
que la amina está protonada y, por lo tanto,
carboxílico insaturado se decarboxile en el
es un buen grupo saliente (dejaría como una
momento. Con este camino de reacción, se
amina neutra, base conjugada del ión
amonio), una molécula básica (la piperidina
en este caso) puede romper un protón al
carbono en α con la formación de un doble
enlace y salida de piperidina. El resultado es
un ácido carboxílico α, β insaturado. Esta
misma reacción de Knoevenagel puede
aplicarse a la síntesis del ácido cinámico, en la
cual se condensa benzaldehído con el éster
malónico para obtener éster benzalmalónico.
Para esta condensación resulta un buen
catalizador una amina secundaria, tal como la
dietilamina o la piperidina. Una reacción de
Knoevenagel que permiten generar enlaces
carbono-carbono la reacción ocurre entre un
aldeido o cetona con un compuesto que
posea metilenos activos en presencia de base
suave el resultado es la obtención de ácidos
insaturados.
REFERENCIAS:
Morrison, T. R.: Quimica Organica,
ED, Pearson, ed. 5ª, pp: 907-
908,1050-1051
Rakoff, “Química Orgánica” ED
Limusa, México D.F., 1982, Págs.:
341-342
Gálvez, R. C., Guevara, J., Ching, O.
Química de las Reacciones Orgánicas.
Editorial Alhambra, S. A.
España,1976; 210-212
También podría gustarte
- Los Aldehídos, Cetonas y Ácidos CarboxílicosDocumento13 páginasLos Aldehídos, Cetonas y Ácidos CarboxílicosAndrea Gabriela Panimboza HenaoAún no hay calificaciones
- Nucleofilicidad y Nucleofugacidad99998900Documento6 páginasNucleofilicidad y Nucleofugacidad99998900Carlos Cruz100% (1)
- s3 - Hidrocarburos Insaturados AlquinosDocumento21 páginass3 - Hidrocarburos Insaturados AlquinosEstefany Barrionuevo SalgadoAún no hay calificaciones
- Alcanos LinealesDocumento53 páginasAlcanos LinealesFernando Jacob Avila JiménezAún no hay calificaciones
- Examen de Alquenos y Alquinos 2022Documento4 páginasExamen de Alquenos y Alquinos 2022Juan Diego ArianoAún no hay calificaciones
- Grupos Funcionales BachilleratoDocumento8 páginasGrupos Funcionales BachilleratoUmq Preparatoria TsqAún no hay calificaciones
- Reconocimiento de BiomoleculasDocumento9 páginasReconocimiento de BiomoleculasWilson JaimesAún no hay calificaciones
- Introduccion A La QuimicaDocumento12 páginasIntroduccion A La QuimicaTamara EscurraAún no hay calificaciones
- Isomería 1 PDFDocumento6 páginasIsomería 1 PDFJhoan MillerAún no hay calificaciones
- Taller de Química - AlcoholesDocumento3 páginasTaller de Química - AlcoholesDaniela Reza LópezAún no hay calificaciones
- Alcanos QuimicaDocumento3 páginasAlcanos QuimicaJulio Andrés Campos VásquezAún no hay calificaciones
- Apuntes FormulacionDocumento14 páginasApuntes FormulacionRobertTurnerCoboAún no hay calificaciones
- EstereoquimicaDocumento6 páginasEstereoquimicaEdwin ValdesAún no hay calificaciones
- BiomoleculasDocumento2 páginasBiomoleculaskevin avendañoAún no hay calificaciones
- Quimica-Org Unad PDFDocumento266 páginasQuimica-Org Unad PDFviviAún no hay calificaciones
- Practica Lab 4 BromatologiaDocumento4 páginasPractica Lab 4 BromatologiaNayeliis ChavezAún no hay calificaciones
- Informe 1° de Quimica OrganicaDocumento3 páginasInforme 1° de Quimica Organicastiben novaAún no hay calificaciones
- GlucidosDocumento14 páginasGlucidosDuber chonlon GuevaraAún no hay calificaciones
- Halogenuros de AcidoDocumento13 páginasHalogenuros de AcidoSofia HerreraAún no hay calificaciones
- PB Nero LinaDocumento7 páginasPB Nero LinaEdwin TapiaAún no hay calificaciones
- Guia de Carbohidratos Primera ParteDocumento2 páginasGuia de Carbohidratos Primera ParteMaríaJoséCorreaAún no hay calificaciones
- Tabla Comparativa Aromáticos, Antiaromáticos, No AromáticosDocumento3 páginasTabla Comparativa Aromáticos, Antiaromáticos, No AromáticosMaría Isabel Zorrilla Certuche50% (2)
- Material Teorico de Quimica Organica - Tioles - Aldehidos y CetonasDocumento7 páginasMaterial Teorico de Quimica Organica - Tioles - Aldehidos y CetonasJose Carlos HernanadezAún no hay calificaciones
- Halogenuro de AlquiloDocumento9 páginasHalogenuro de AlquiloJairo Viloria EspitiaAún no hay calificaciones
- NumerosDocumento12 páginasNumerosAnonymous DNRmWLhyeAún no hay calificaciones
- Examen de Pseudo Sanger-NinhidrinaDocumento6 páginasExamen de Pseudo Sanger-NinhidrinaDaniel OlmosAún no hay calificaciones
- HIDROCARBUROSDocumento5 páginasHIDROCARBUROSDaniel SalcidoAún no hay calificaciones
- Quimica OrganicaDocumento5 páginasQuimica OrganicaMiroslava AlanisAún no hay calificaciones
- Resumen INTRODUCCION A LA QUIMICADocumento29 páginasResumen INTRODUCCION A LA QUIMICAfrancolucagianniniAún no hay calificaciones
- Tema 6 Reacciones en CadenaDocumento41 páginasTema 6 Reacciones en CadenaPepe PertíñezAún no hay calificaciones