Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Celda Electroquimica
Celda Electroquimica
Cargado por
7081700 calificaciones0% encontró este documento útil (0 votos)
8 vistas4 páginaseq
Título original
Celda electroquimica
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoeq
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
8 vistas4 páginasCelda Electroquimica
Celda Electroquimica
Cargado por
708170eq
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 4
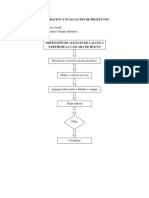
1.- Objetivo.
- Los objetivos de la prctica son:
- Estudiar el funcionamiento de una celda galvnica.
- Interpretar cada una de las reacciones que ocurre en los electrodos de
una celda electroltica.
2.- Marco terico.- Una celda electroqumica es un dispositivo
experimental para generar electricidad mediante una reaccin redox
espontanea. (Esta celda tambin se conoce como celda galvnica o
voltaica, en honor a los cientficos Luigi Galvani y Alessandro Volta,
quienes fabricaron las primeras celdas de este tipo).
Por ejemplo: Una barra de zinc metlico se sumerge en una disolucin
de sulfato de zinc (ZnSO4) y una barra de cobre se sumerge en una
disolucin sulfato de cobre (CuSO4). El funcionamiento de celda se basa
en el principio de que la oxidacin de Zn a Zn+2 y la reduccin de Cu+2 a
Cu se puede llevar a cabo simultneamente, pero en recipientes
separados, con la transferencia de electrones a travs de un alambre
conductor externo. Las barras de zinc y cobre serian los electrodos. Esta
distribucin particular de electrodos (Zn y Cu) y de disoluciones (ZnSO 4 y
CuSO4) se conoce como celda de Daniell. En una celda electroqumica, el
nodo es, por definicin, el electrodo en el que se lleva cabo la
oxidacin, y el ctodo es el electrodo donde se efecta la reduccin.
En la celda de Daniell, las reacciones de oxidacin y reduccin en los
electrodos, es decir, las reacciones de semicelda, son:
Electrodo de zinc (nodo):
Zn(s) Zn2+(ac) + 2e-
Electrodo de Cu (ctodo):
Cu2+(ac) + 2e- Cu(s)
Observe que los iones de Cu2+ reaccionan directamente con la barra de
zinc, a menos que las disoluciones estn separadas.
Cu2+(ac) + Zn(s) Cu(s) + Zn2+(ac)
Pero no se obtendra trabajo elctrico til.
Para completar el circuito elctrico, las disoluciones deben conectar
mediante un conductor por el que puedan pasar los cationes y aniones
desde un compartimiento al otro. Este requisito se cumple con un
puente salino, que en su forma ms simple es un tubo en forma de U
invertida lleno de una disolucin de un electrolito inerte como cloruro de
potasio (KCl) o nitrato de amonio (NH4NO3), cuyos iones no reaccionaran
con los iones de la disolucin o con los electrodos. Durante el curso de la
reaccin redox global, los electrones fluyen externamente desde el
nodo (electrodo de zinc) hacia el ctodo (electrodo de cobre) a traces
del alambre conductor y del voltmetro. En la solucin, los cationes
(Zn+2, Cu+2, K+) se mueven hacia el ctodo y los aniones (SO42- y Cl-) se
dirigen hacia el nodo. Sin el puente salino, pronto se acumularan
cargas positivas en el compartimiento del nodo (por la formacin de
iones Zn+2) y cargas negativas en el ctodo (cuando parte de los iones
Cu+2 se reduzcan a Cu), impidiendo que la celda funcione.
La corriente elctrica fluye del nodo al ctodo porque existe una
diferencia de energa potencial elctrica entre los electrodos. El flujo de
corriente elctrica es anlogo a la cada del agua en una cascada debido
a la diferencia de energa potencial gravitacional, o al flujo de gas desde
una zona de presin elevada a una de presin baja. La diferencia de
potencial elctrico entre el nodo y el ctodo se mide en forma
experimental con un voltmetro, donde la lectura (en voltios) es el
voltaje de celda.
3.- Procedimiento.- La prctica se la realizo primero para ver el
funcionamiento de una celda galvnica y luego para una celda
electroltica.
Para la celda galvnica; se preparo en dos vasos de precipitado
soluciones de sulfato de cobre y sulfato de zinc cada una con una
concentracin de uno molar en 25 mililitros.
Adems de preparar la solucin de cloruro de amonio a 0.1 molar con
5% de yoduro de potasio, esta solucin se la coloco en el tubo en forma
de U y se coloco pedazos de algodn en los extremos del tubo.
Se colocaron los electrodos de cobre y de zinc cada uno en su respectiva
solucin, luego se los conecto al voltmetro para poder medir la energa.
Se anota la cantidad de energa que marca el voltmetro y luego se
desconecto.
Se coloco el tubo en forma de U con la solucin de yoduro de potasio, en
los vasos de precipitado, se conecto el voltmetro y se anoto el valor
marcado.
Para la celda electroltica; se coloco la solucin de yoduro de potasio
en un crisol, se le coloco un electrodo de carbn a cada uno de los polos
(+/-), de procedimiento hecho en la celda galvnica. Por ltimo se tomo
nota de lo ocurrido en experimento.
Materiales y reactivos:
Vasos de precipitado, pipetas, picetas, vidrio de reloj, probeta, varilla de
vidrio, matraz aforado, cables de conexin, tubo en U, electrodo de zinc,
electrodo de cobre, electrodo carbono, balanza voltmetro, crisol de
porcelana.
Etanol, sulfato de cobre (1M), sulfato de zinc (1M), cloruro de amonio
(0.1M), yoduro de potasio al 5%, fenolftalena, algodn.
4.- Clculos y resultados.5.- Observaciones.- Mis observaciones para esta prctica son:
Primero se ve que se cumpli con los objetivos de la prctica.
Segundo se ve que es necesario el puente que se coloco en los vasos de
precipitado.
Tercero se observa en el segundo experimento, que en uno de los
electrodos hay desprendimiento de gas y en el otro poco de
desintegracin.
6.- Conclusiones.- Para la prctica se concluye que:
De mi segunda observacin, concluyo que es necesario el tubo en forma
de U y colocarlo para que los cationes y aniones puedan pasar desde un
compartimiento hacia el otro compartimento.
De mi tercera observacin, concluye que el desprendimiento de gas y la
desintegracin de los electrodos es por medio de electrolisis.
7.- Cuestionario.R.-1. - La diferencia entre celda galvnica y celda electroltica, es que la
galvnica produce energa y la electroltica requiere energa.
2Li (s) 2Li+ (ac) + 2e-;
R.-2. -
= +3.040
Cu2+ (ac) + 2e- Cu (s);
= +0.340
2Li + Cu2+ 2Li+ + Cu;
= +3.380V
R.-3. - El puente salino para que los aniones y cationes puedan pasar de
un compartimento a otro.
R.-4. Los electrodos se caracterizan por qu, primero uno es el ctodo
y otro es el nodo, por medio de estos de electrodos existe la oxidacin
y la reduccin. En el nodo es donde ocurre la oxidacin y en el ctodo
es donde est la reduccin.
Adems es uno de los factores del voltaje de una celda.
8.- Bibliografa.Qumica General de Frederick R. Longo
McGraw-Hill
(paginas
McGraw-Hill
(paginas
242 - 248)
Qumica General de Raymond Chang
769 - 793)
Qumica General de Juan Goi Galarza
436)
Latinas editores (paginas 435 -
También podría gustarte
- DR560 MantenciónDocumento212 páginasDR560 Mantenciónsara100% (3)
- Manual Basico para Hacer VelasDocumento24 páginasManual Basico para Hacer VelasJoakoPrudenza100% (1)
- Memoria de Calculo Arcotecho La MercedDocumento38 páginasMemoria de Calculo Arcotecho La MercedHeber Trujillo Tellez50% (4)
- Cuestionario CalderasDocumento3 páginasCuestionario CalderasJuan Carlos Morales100% (3)
- Placas Anclaje Cype PDFDocumento21 páginasPlacas Anclaje Cype PDFPedro Jesús Gómez LassoAún no hay calificaciones
- Materia Másica y No MásicaDocumento4 páginasMateria Másica y No MásicaKorn Mtz FAún no hay calificaciones
- ViscosidadDocumento6 páginasViscosidad708170Aún no hay calificaciones
- Obtencion Del Estaño Metalico A Partir Del Mineral CasiteritaDocumento5 páginasObtencion Del Estaño Metalico A Partir Del Mineral Casiterita708170Aún no hay calificaciones
- Propiedades Magnéticas de La MateriaDocumento12 páginasPropiedades Magnéticas de La Materia708170Aún no hay calificaciones
- OtrosDocumento8 páginasOtros708170Aún no hay calificaciones
- Simbologia y Manejo de InstrumentosDocumento15 páginasSimbologia y Manejo de Instrumentos708170Aún no hay calificaciones
- Obtención de Acetato de AmonioDocumento1 páginaObtención de Acetato de Amonio708170Aún no hay calificaciones
- Refracción de La LuzDocumento12 páginasRefracción de La Luz708170Aún no hay calificaciones
- Propiedades Químicas de Hidrocarburos AromáticosDocumento3 páginasPropiedades Químicas de Hidrocarburos Aromáticos70817075% (4)
- HidrolisisDocumento5 páginasHidrolisis708170Aún no hay calificaciones
- Estudio de La Influencia de La Concentracion en La Velocidad de ReaccionDocumento5 páginasEstudio de La Influencia de La Concentracion en La Velocidad de Reaccion708170Aún no hay calificaciones
- Propiedades Químicas de Hidrocarburos Alifáticos y Cicloalifáticos Saturados e InsaturadosDocumento4 páginasPropiedades Químicas de Hidrocarburos Alifáticos y Cicloalifáticos Saturados e Insaturados708170Aún no hay calificaciones
- Puentes II - Javier ManterolaDocumento600 páginasPuentes II - Javier ManterolaRJNOAún no hay calificaciones
- Manual de Metrologia Materiales PDFDocumento84 páginasManual de Metrologia Materiales PDFHipolito FloresAún no hay calificaciones
- Derivadas PDFDocumento8 páginasDerivadas PDFanastasio teodoro garciaAún no hay calificaciones
- Desarrollo de Las Señales EEG y ECGDocumento79 páginasDesarrollo de Las Señales EEG y ECGDavid Puma100% (1)
- Abonadora Manual Un DiscoDocumento10 páginasAbonadora Manual Un DiscoJose Manuel Martínez SuárezAún no hay calificaciones
- 7.punto de Rocio en AcidoDocumento37 páginas7.punto de Rocio en AcidoflexAún no hay calificaciones
- LOU SecadoDocumento21 páginasLOU SecadocarmenAún no hay calificaciones
- Diferenciales y SiliconasDocumento3 páginasDiferenciales y Siliconasjoselitro13Aún no hay calificaciones
- Guia de Operacion Casio 4734 PDFDocumento5 páginasGuia de Operacion Casio 4734 PDFRafael ArteagaAún no hay calificaciones
- A Rotary Variable Differential TransformerDocumento2 páginasA Rotary Variable Differential TransformerSeptiembre FesAún no hay calificaciones
- El Sistema Thermo Scientific DionexDocumento12 páginasEl Sistema Thermo Scientific DionexSusana Smaldone MillánAún no hay calificaciones
- Sulfato en Agua Por Nefelometría PDFDocumento9 páginasSulfato en Agua Por Nefelometría PDFjedaymc27Aún no hay calificaciones
- 34101801-1884-1885 Dispermix VF-7-N (Lab - Vogue)Documento85 páginas34101801-1884-1885 Dispermix VF-7-N (Lab - Vogue)Jorge MartinezAún no hay calificaciones
- EGRÉGORESDocumento2 páginasEGRÉGORESabe_1962Aún no hay calificaciones
- Fases de La Luna - PlaneacionDocumento3 páginasFases de La Luna - PlaneacionMiriiToos' RoomeerooAún no hay calificaciones
- Programa - Proteccion - Radiacion - UV 2020Documento8 páginasPrograma - Proteccion - Radiacion - UV 2020moritamaAún no hay calificaciones
- Laboratorio 4 EstandarizacionDocumento4 páginasLaboratorio 4 EstandarizacionJULIOAún no hay calificaciones
- Líneas de Influencia PDFDocumento25 páginasLíneas de Influencia PDFSantiago EcheverríaAún no hay calificaciones
- Cristalografia (Clase 1 Orígen Historia 1Documento43 páginasCristalografia (Clase 1 Orígen Historia 1Limber AvilaAún no hay calificaciones
- Libro Leche 1Documento22 páginasLibro Leche 1Yolanda SarangoAún no hay calificaciones
- Mecánica Corporal ExpoDocumento20 páginasMecánica Corporal ExpoDanielsAún no hay calificaciones
- Quillay LISTA DE PRECIOS-d3d94Documento3 páginasQuillay LISTA DE PRECIOS-d3d94María Alejandra Fuma100% (1)
- Informe Equipos de ClimatizacionDocumento7 páginasInforme Equipos de ClimatizacionAldo Renato Cuzquén TiradoAún no hay calificaciones
- Deformacion PlasticaDocumento3 páginasDeformacion PlasticaRehey FloresAún no hay calificaciones