Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Teoria 1
Cargado por
Jonatan RojazTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Teoria 1
Cargado por
Jonatan RojazCopyright:
Formatos disponibles
TEORA No.
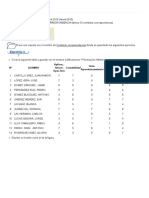
1 CONCEPTOS TERMODINMICOS BSICOS YANNETH PARRA MARTNEZ SISTEMA: Un sistema termodinmico se define como una cantidad de materia o una regin del espacio elegida para ser estudiada o para efectos de clculo. SISTEMA CERRADO: O masa de control, no hay masa atravesando los lmites del sistema, puede haber flujo de energa. SISTEMA ABIERTO: O volumen de control, hay masa atravesando los lmites del sistema y a su vez flujo de energa. PROCESO: Un proceso ocurre cuando un sistema experimenta un cambio de un estado de equilibrio a otro. PROCESO CUASIESTTICO O DE CUASIEQUILIBRIO: Es un proceso idealizado que ocurre en infinitos estados de equilibrio. CICLO: Ocurre cuando un sistema despus de sufrir una serie de procesos regresa a un estado idntico al que tena originalmente. PROCESO REVERSIBLE: Ocurre cuando un sistema sufre un proceso y retorna a su estado inicial siguiendo exactamente la misma trayectoria y sin efectos de friccin. PROCESO IRREVERSIBLE: Es un proceso en donde el sistema o su entorno no pueden ser devueltos a sus estados iniciales. PROCESO ADIABTICO: En un proceso adiabtico no hay transferencia de energa en forma de calor hacia el sistema o desde el sistema hacia los alrededores. Ocurre en sistemas totalmente aislados de los alrededores o cuando la temperatura de los alrededores y del sistema es igual. PROCESO ISOCRICO: Un proceso isocrico se efecta a volumen constante. Si el volumen de un sistema termodinmico es constante, no efecta trabajo sobre su entorno. PROCESO ISOTRMICO: O isotermo, es el que se efecta a temperatura constante. La compresin o expansin de un gas ideal en contacto permanente con un termostato (controlador de temperatura), es un ejemplo de este proceso. PROCESO ISOBRICO: Es el que se efecta a presin constante. El agua que hierve en un recipiente abierto a la atmsfera es un ejemplo de l. EQUILIBRIO TERMODINMICO: Se presenta cuando en un sistema las fuerzas mecnicas, trmicas y qumicas estn en equilibrio es decir no hay ninguna tendencia hacia un cambio espontneo una influencia del exterior sobre este. Equilibrio trmico: Cuando en un sistema todas sus partes se encuentran a la misma temperatura. Equilibrio qumico: Si no presenta tendencia a experimentar una reaccin. Equilibrio mecnico: Implica una igualdad de fuerzas en todos los puntos adems no debe experimentar aceleracin. Equilibrio de fases: Implica que no haya cambios de fase en el sistema. ENFOQUE MACROSCPICO: Estudios termodinmicos que no requieren un comportamiento individual de las partculas, se toman en cuenta los efectos globales o promedio de muchas molculas. ENFOQUE MICROSCPICO: Estudios termodinmicos con base en el comportamiento promedio de grandes grupos de partculas individuales. PROPIEDAD: Es una caracterstica de un sistema. PROPIEDADES TERMODINMICAS: Son caractersticas que se pueden observar, medir o cuantificar en las sustancias o en los sistemas. Dentro de las ms importantes se tienen: PRESIN: Se define como la fuerza por unidad de rea. PRESIN ABSOLUTA: Es la presin medida en un lugar determinado con respecto al vaco absoluto, se calcula como la suma de presin atmosfrica ms presin manomtrica. PRESIN ATMOSFRICA: Es la que ejerce la atmsfera o aire sobre la tierra. PRESIN MANOMTRICA: Es la presin presente en un sistema comparada con la atmosfrica, se mide dentro del sistema mediante un manmetro. PRESIN DE VACO: Se refiere a presiones manomtricas menores que la atmosfrica. TEMPERATURA: Se puede definir como una propiedad intensiva del sistema, que depende del contenido energtico del mismo.
PROPIEDADES EXTENSIVAS: Estas propiedades dependen del tamao o extensin del sistema, el valor de una propiedad extensiva vara directamente con la masa. Las letras maysculas se utilizan para denotar propiedades extensivas. PROPIEDADES INTENSIVAS: Estas propiedades son independientes del tamao del sistema, es decir independientes de la masa. Las letras minsculas se utilizan para denotar las propiedades intensivas, a excepcin de la temperatura y la presin. PROPIEDADES ESPECFICAS: Son las propiedades extensivas por unidad de masa u otro elemento de referencia. GASES IDEALES: Son gases cuyos comportamientos se presentan como idealizados a altas temperaturas y bajas presiones. Los gases ideales se encuentran en un estado homogneo, tomando la forma y el volumen del recipiente que lo contenga. Sus molculas se encuentran muy separadas unas de otras, por tanto el gas se puede comprimir o expandir con facilidad. Ley de Boyle: La ley de Boyle establece que la presin de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente. Esto quiere decir que si el volumen del contenedor aumenta, la presin en su interior disminuye y, viceversa, si el volumen del contenedor disminuye, la presin en su interior aumenta. La ley de Boyle permite explicar la ventilacin pulmonar, proceso por el que se intercambian gases entre la atmsfera y los alvolos pulmonares. El aire entra en los pulmones porque la presin interna de estos es inferior a la atmosfrica y por lo tanto existe un gradiente de presin. Inversamente, el aire es expulsado de los pulmones cuando estos ejercen sobre el aire contenido una presin superior a la atmosfrica. Ley de Charles: La ley de Charles establece que el volumen de un gas es directamente proporcional a su temperatura absoluta, asumiendo que la presin se mantiene constante. Esto quiere decir que en un recipiente flexible que se mantiene a presin constante, el aumento de temperatura conlleva un aumento del volumen. Ley de Dalton: La ley de Dalton establece que en una mezcla de gases cada gas ejerce su presin como si los restantes gases no estuvieran presentes. La presin especfica de un determinado gas en una mezcla se llama presin parcial, p. La presin total de la mezcla se calcula simplemente sumando las presiones parciales de todos los gases que la componen. Por ejemplo, la presin atmosfrica es: Presin atmosfrica (760 mm de Hg) = pO2 (160 mm Hg) + pN2 (593 mm Hg) + pCO2 (0.3 mm Hg) + pH2O (alrededor de 8 mm de Hg). Ley de Gay-Lussac: Publicada en 1802. Esta ley establece, que, a volumen constante, la presin de una masa fija de un gas dado es directamente proporcional a la temperatura. Ecuacin General de los Gases: En las leyes de los gases, la de Boyle, la de Charles y la Gay-Lussac, la masa del gas es fija y una de las tres variables, la temperatura, presin o el volumen, tambin es constante. Utilizando una nueva ecuacin, no solo podemos variar la masa, sino tambin la temperatura, la presin y el volumen. La ecuacin para los gases ideales es: pV = nRuT pV= mRT Donde: Ru: Es la constante de los gases ideales; es igual para todas las sustancias, se expresa en unidades de Energa/mol de temperatura. R: Es la constante especfica para cada gas, se expresa en unidades de Energa/masa de temperatura. Caractersticas de Gas Ideal: Se considera que un gas ideal presenta las siguientes caractersticas: El nmero de molculas es despreciable comparado con el volumen total de un gas. No hay fuerza de atraccin entre las molculas.
Las colisiones son perfectamente elsticas. Evitando las temperaturas extremadamente bajas y las presiones muy elevadas, podemos considerar que los gases reales se comportan como gases ideales. Propiedades de los gases: Los gases tienen 3 propiedades caractersticas: (1) Son fciles de comprimir, (2) se expanden hasta llenar el contenedor, y (3) ocupan mas espacio que los slidos o lquidos que los conforman. GASES REALES: Son gases que se encuentran a bajas temperaturas y presiones altas; para su evaluacin, se consideran diversas ecuaciones de estado que involucran de 2 a 17 constantes, cuyos valores difieren para distintos gases. OTROS TRMINOS DE IMPORTANCIA ENERGA INTERNA: (U) Energa que posee el sistema debida al movimiento de sus partculas subatmicas. ENERGA CINTICA: (Ec) Energa que posee el sistema debida a su movimiento con respecto a un nivel de referencia. ENERGA POTENCIAL: (Ep) Energa que posee el sistema debida a su posicin. CALOR: (Q) Energa que fluye a travs del sistema debido a una diferencia de temperatura. TRABAJO: (W) Energa que fluye debido a una fuerza impulsora aplicada sobre un sistema o por el sistema sobre los alrededores. El trabajo se puede definir en funcin de tres componentes bsicos: w = w flujo + w eje + w friccin Donde: W friccin Trabajo debido al rozamiento en el sistema W eje = Trabajo debido a partes mviles presentes en el sistema por ejemplo pistones, turbinas, bombas. W flujo = Trabajo de flujo definido a continuacin: TRABAJO DE FLUJO Cuando un fluido entra en un sistema, es empujado por el fluido que hay detrs de l. Por tanto, se efecta trabajo en el fluido dentro del sistema. De igual forma, el fluido que sale del sistema tiene que empujar al fluido que hay frente a l, lo que representa trabajo que sale del sistema. Este trabajo efectuado al mover el fluido recibe el nombre de trabajo de flujo y es vlido para sistemas abiertos. Este trabajo se evala como: W = P2v2 - P1v1 = PV ENTALPA: (h) Energa calorfica del sistema debida a su energa interna ms la energa debida al trabajo de flujo presente en el sistema. h = u + Pv
También podría gustarte
- Imperio Kitsch 30 de Agosto 2020Documento183 páginasImperio Kitsch 30 de Agosto 2020Eva Ponsati Cohen100% (1)
- 6 Sombreros para PensarDocumento6 páginas6 Sombreros para Pensarapi-236847123100% (1)
- Introducción A La Ingeniería de Minera Vol. IV LAs Funciones de La Ingeniería MineraDocumento46 páginasIntroducción A La Ingeniería de Minera Vol. IV LAs Funciones de La Ingeniería MineraDIOMEDES YUNIOR CHAMORRO MONAGOAún no hay calificaciones
- Actividad 16Documento25 páginasActividad 16Jeisson BayonaAún no hay calificaciones
- Proyecto Los MandalasDocumento10 páginasProyecto Los Mandalasalemarquez0% (1)
- Servicios Asociacion Suyay America Latina - Suyay AlDocumento27 páginasServicios Asociacion Suyay America Latina - Suyay Alsem carlosAún no hay calificaciones
- Biografia Thomas Kuhn-GpDocumento3 páginasBiografia Thomas Kuhn-GpkazeuzaguiAún no hay calificaciones
- Vision Mision Normas de Convivencia Indicaciones Ept Materiales Horario Atencion 2024Documento7 páginasVision Mision Normas de Convivencia Indicaciones Ept Materiales Horario Atencion 2024cotrinamedinafAún no hay calificaciones
- 16 Proc - Hse - 016 Procedimiento de Autorización de VisitasDocumento11 páginas16 Proc - Hse - 016 Procedimiento de Autorización de VisitasAzumy Lorena Lopez N. AzumyAún no hay calificaciones
- Alternativa ProductivaDocumento2 páginasAlternativa ProductivaWILLIAM DELGADOAún no hay calificaciones
- Aeroenfriadores UNCODocumento36 páginasAeroenfriadores UNCOEzequiel Gallardo100% (2)
- Teoricas JuntasDocumento326 páginasTeoricas JuntassansanAún no hay calificaciones
- CLASE 3 y 4 EMTPDocumento55 páginasCLASE 3 y 4 EMTPLore Viviana GonzalezAún no hay calificaciones
- IC Family Vacation Itinerary 27505 - ESDocumento5 páginasIC Family Vacation Itinerary 27505 - ESMariana Gurrola SotoAún no hay calificaciones
- Imforme CalicataDocumento10 páginasImforme Calicatarussel calderon chochocaAún no hay calificaciones
- Actividades Tema 13 PDFDocumento4 páginasActividades Tema 13 PDFBruno Bejar AbaldeAún no hay calificaciones
- Términos y Condiciones Mi Cuenta Tigo - 0Documento3 páginasTérminos y Condiciones Mi Cuenta Tigo - 0DS ClanAún no hay calificaciones
- Documento Sin TítuloDocumento2 páginasDocumento Sin TítuloCarlosKikeGutierrezAún no hay calificaciones
- Justificación Del Diseño de La Presa ReservorioDocumento18 páginasJustificación Del Diseño de La Presa ReservorioGeorge Franco Matta TelloAún no hay calificaciones
- Pensamiento Lógico - EcuRedDocumento3 páginasPensamiento Lógico - EcuRedSophie ElizabethAún no hay calificaciones
- OclusionDocumento9 páginasOclusionivett gonzalezAún no hay calificaciones
- Apuntes Histologia DefinitivosDocumento84 páginasApuntes Histologia DefinitivosCarlos MartínezAún no hay calificaciones
- Metodo de IntervalosDocumento2 páginasMetodo de Intervalosjosefa reyesAún no hay calificaciones
- Aula 4 Transformada Discreta de Fourier TDFDocumento29 páginasAula 4 Transformada Discreta de Fourier TDFDarwin Osmar Palomino JoveAún no hay calificaciones
- LO 5.1 Guia Trabajo Aplicativo-DAF 2023-2Documento2 páginasLO 5.1 Guia Trabajo Aplicativo-DAF 2023-2Ariana Andrea RIOS LIZANOAún no hay calificaciones
- 6 Evapotranspiracion FAODocumento25 páginas6 Evapotranspiracion FAOIrvin LozanoAún no hay calificaciones
- Homomorfismo de Grupos PDFDocumento14 páginasHomomorfismo de Grupos PDFvqt2000100% (1)
- Ter Ter 1 Energia CFTDocumento2 páginasTer Ter 1 Energia CFTfdAún no hay calificaciones
- Sildenafilo CitratoDocumento4 páginasSildenafilo CitratoJaime AlegríaAún no hay calificaciones
- Paso Fino ColombianoDocumento7 páginasPaso Fino Colombianojesus castañedaAún no hay calificaciones