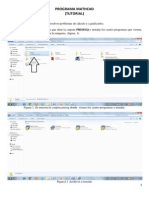
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
3er Examen Parcial
Cargado por
Javier RodriguezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
3er Examen Parcial
Cargado por
Javier RodriguezCopyright:
Formatos disponibles
3er examen parcial. Electroqumica.
Sem 2015-1
1. En el acumulador de Edison, los siguientes equilibrios redox son caractersticos de
las semi-reacciones andica y catdica:
Ni2O3 (s) + H2O (l) + 2 e- 2 NiO(s) + 2 OHFeO(s) + H2O (l) + 2 e- Fe + 2 OHEstablecer la reaccin global, calcular FEM0. Cmo depende la FEM de la
actividad de OH-?
2. Escribir la reaccin global de cada una de las siguientes cadenas electroqumicas y
calcular los valores de FEM a 25 C. cules son celdas espontaneas y cules no?
Ag / Ag+ (a=0.01) //Zn2+ (a=0.1) / Zn
Pt / Fe2+ (a=1.0), Fe3+ (a=0.1) // Cl- (a=0.001) /AgCl / Ag
Zn / ZnO22- (a=0.1) , OH- (a=1) / HgO / Hg
3. Calcular las constantes de equilibrio de las siguientes reacciones, a 25 C.
Zn2+ + 4 CN Zn(CN)423 H2O + Fe Fe(OH)3 (s) + 3/2 H2
-
4. En una celda electroqumica se detecta la evolucin de oxgeno en el nodo a partir
de una disolucin cida (pH = 2). Escriba la semi-reaccin correspondiente y la
ecuacin de Nernst para este sistema sabiendo que el potencial normal del par
oxgeno-agua es 1.23 V. Cul ser el potencial de equilibrio del nodo cuando la
presin parcial del oxgeno sobre dicho electrodo sea igual a 0.8 atm? Asuma
comportamiento ideal.
5. Construir el diagrama de predominancia de especies E-pH, del sistema platino-agua
a 25C
E0 Ag /Ag = 0.7991 V vs. ENH
E0 Zn /Zn = -0.763
E0 Fe / Fe = 0.771
E0 AgCl/Ag = 0.222
E0 ZnO /Zn = -1.216
E0 HgO/Hg = 0.098
E0 Ni O /NiO = 0.4
E0 FeO/Fe = -0.87
E0 Zn(CN) /Zn = -1.26
E0 Fe(OH) /Fe = -0.77
E0 H O/H ,OH = -0.828
E0 Pt /Pt = 1.188
E0 Pt(OH) /Pt = 0.98
E0 PtO /Pt(OH) = 1.043
E0 PtO / PtO = 2.0
+
2+
3+
2+
2-
2-
2+
2
3
También podría gustarte
- Coeficiente de Tranferencia Convectiva de Masa-140228Documento11 páginasCoeficiente de Tranferencia Convectiva de Masa-140228Javier Rodriguez75% (4)
- Cambiadores de Coraza T YubosDocumento15 páginasCambiadores de Coraza T YubosJavier RodriguezAún no hay calificaciones
- Sintesis de ColumnasDocumento17 páginasSintesis de ColumnasRamces FuenmayorAún no hay calificaciones
- BellDocumento26 páginasBellCami PereiraAún no hay calificaciones
- Tutorial MathcadDocumento12 páginasTutorial MathcadhanscivilAún no hay calificaciones
- Tema 11 - Hornos PDFDocumento29 páginasTema 11 - Hornos PDFYurendry GarcíaAún no hay calificaciones
- Entropia y Energia LibreDocumento41 páginasEntropia y Energia LibreJavier RodriguezAún no hay calificaciones
- Alicia Wood CasasDocumento86 páginasAlicia Wood CasasBernardino RamosAún no hay calificaciones
- Resumen Transferencia de MasaDocumento5 páginasResumen Transferencia de MasaJavier RodriguezAún no hay calificaciones
- Tratamiento ResiduclaDocumento3 páginasTratamiento ResiduclaJavier RodriguezAún no hay calificaciones
- Ejercicios de InglesDocumento6 páginasEjercicios de InglesJavier RodriguezAún no hay calificaciones
- Reglas de RusoDocumento2 páginasReglas de RusoJavier RodriguezAún no hay calificaciones
- Clase 28-04-14Documento5 páginasClase 28-04-14Javier RodriguezAún no hay calificaciones
- p4 Luf ScribdDocumento4 páginasp4 Luf ScribdJavier RodriguezAún no hay calificaciones
- p3 Luf - ScribdDocumento3 páginasp3 Luf - ScribdJavier RodriguezAún no hay calificaciones
- Conveccion ForzadaDocumento6 páginasConveccion ForzadaJavier Rodriguez0% (1)
- Practica 1 - Proteccion AmbientalDocumento4 páginasPractica 1 - Proteccion AmbientalJavier RodriguezAún no hay calificaciones
- Ozono P1 PaDocumento4 páginasOzono P1 PaJavier RodriguezAún no hay calificaciones
- Practica 2-Proteccion AmbientalDocumento4 páginasPractica 2-Proteccion AmbientalJavier RodriguezAún no hay calificaciones
- IntegralesmultiplesDocumento56 páginasIntegralesmultiplespacocuestal100% (4)
- Int DoblesDocumento50 páginasInt DoblesJoshe Luwis CordovaAún no hay calificaciones
- CMC Enero 2014Documento8 páginasCMC Enero 2014Javier RodriguezAún no hay calificaciones
- Serie de Problemas Número 3. Termodinámica ElectroquímicaDocumento1 páginaSerie de Problemas Número 3. Termodinámica ElectroquímicaJavier RodriguezAún no hay calificaciones
- IntegralesmultiplesDocumento56 páginasIntegralesmultiplespacocuestal100% (4)
- Serie7EcuaciondeNernst, CeldasdeConcentracion, Determinacion (H+) 27331Documento3 páginasSerie7EcuaciondeNernst, CeldasdeConcentracion, Determinacion (H+) 27331Javier RodriguezAún no hay calificaciones
- Int DoblesDocumento50 páginasInt DoblesJoshe Luwis CordovaAún no hay calificaciones