Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tema 4 1ra Ley Sistema Cerrado TERMO 1
Cargado por
sergdesDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tema 4 1ra Ley Sistema Cerrado TERMO 1
Cargado por
sergdesCopyright:
Formatos disponibles
Prof. Carlos G.
Villamar Linares
Ingeniero Mecnico
MSc. Matemticas Aplicada a la Ingeniera
TERMODINAMICA 1
Primera Ley de la Termodinamica.
Aplicada a Sistemas Cerrados
Prof. Carlos G. Villamar L. TERMODINAMICA 1. ING
MECANICA. ULA
1
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
2
CONTENIDO
Primera Ley de laTermodinmica para Sistemas Cerrados.
Primera ley de la termodinmica para ciclos, primera ley de la termodinmica para sistemas cerrados.
Energa interna y entalpa, aplicacin de la primera ley para procesos isobricos, calor especifico a volumen
y a presin constante para sustancias puras.
Energa interna, entalpa y calores especficos para gases ideales.
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
3
La primera ley establece un balance de energa para un sistema determinado que permite definir que:
LA ENERGA NO SE CREA NI DESTRUYE, SOLAMENTE SE
TRANSFORMA
Est basada en evidencias experimentales que no han podido ser desvirtuadas, por lo que debe
considerarse como una prueba suficiente.
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
4
PRIMERA LEY PARA CICLOS
Joule realizo el siguiente experimento para plantear la ecuacin de primera ley de la
Termodinmica para un ciclo.
Sea un ciclo formado por dos procesos como se muestra en la figura.
GAS
W
Agitador
Se introduce trabajo de agitacin provocado por el
movimiento del peso, sin que exista Transferencia
de Calor el trabajo puede calcularse como:
W
12
= F dz = m g (Z
2
Z
1
)
El trabajo calculado constituye el cambio de
energa potencial del bloque.
AGUA
Q
Termmetro
Agitador
Luego se quita el aislamiento y se introduce el
sistema en un bao de agua de manera que el calor
fluya hacia el agua
Mediante el termmetro se censa la variacin de la
temperatura del agua y por lo tanto puede
calcularse el calor que ella absorbe como:
Q
12
= m
agua
C
P agua
T
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
5
Se puede introducir diferentes cantidades de trabajo y por lo tanto rechazar diferentes cantidades
de calor pero siempre ambas cantidades resultan iguales.
Si Calor y Trabajo se expresan en las mismas unidades se puede establecer una ecuacin que
establece que el Calor neto y el Trabajo neto transferido en un ciclo son iguales.
Esto se conoce como la Primera Ley de la Termodinmica para ciclos.
Q W =
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
6
PRIMERA LEY PARA PROCESOS
Sean dos ciclos formados cada uno como se muestra en la figura.
V
1
P
2
B
C
A
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
7
Para ambos se ciclos se cumple la 1 Ley de la Termodinmica entonces, para cada uno se
tiene
V
1
P
2
B
C
A
2 1 2 1
1A 2B 1A 2B
2 1 2 1
1A 2C 1A 2C
1 1 1 1
2B 2C 2B 2C
Q Q W W
Q Q W W
Q Q W W
+ = +
(
+ = +
(
=
Agrupando los trminos para cada proceso
tenemos
Restando el ciclo AC del
ciclo AB
1 1 1 1
2B 2B 2C 2C
Q W Q W =
o lo que es lo mismo
1 1
2B 2C
( Q W) ( Q W) =
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
8
Esto implica que el termino Q - W no depende de la trayectoria por lo tanto es la diferencia de
una funcin puntual o lo que es lo mismo constituye la variacin de una propiedad.
Esa propiedad se denomina la Energa de un sistema y se representa con la letra E
Por tanto para un sistema cerrado que experimenta un proceso, la ecuacin de la Primera ley de la
Termodinmica se expresa como:
Q - W = dE
La energa puede asociarse al marco coordenado:
Energa Cintica.
Energa Potencial.
Energa Interna, esta asociada a nivel molecular.
Por tanto la ecuacin se expresa como:
Q - W = dE
c
+ dE
P
+ dE
interna
dE
Energa Macroscpica Energa Microscpica
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
9
1 2
E
entra
E
sale
Edo. 1
Edo. 2
Haciendo un balance de energa se tiene
E
hay
+ E
entra
= E
sale
+ E
queda
E
1
+ E
entra
= E
sale
+ E
2
Si consideramos: E
entra
= Q E
sale
= W
Al sustituir obtenemos E
1
+ Q
12
= W
12
+ E
2
Expresando la ecuacin por unidad de masa. e
1
+ q
12
= w
12
+ e
2
En forma diferencial
Por unidad de tiempo
Q W dE =
dE
Q W
dt
=
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
10
Energa Cintica.
Esta asociada con el cambio de velocidad
del sistema.
2 2
c
1 1
2 2
c
1 1
2 2
c
1 1
2 2
c
1 1
2
2
c 1
1
2
2 2
c 1 1
2 2
2 2 1
c 1
dEc = F dx Integrando
dE Fdx Como F ma
dV
dE ma dx Ademas a
dt
Por tan to
dV dx
dE m dx Como V
dt dt
dx Vdt
Al sutituir resulta
dV
dE m Vdt Por lo cual
dt
E m V dV
mV
E
2
m(V V )
E
2
o lo
= =
= =
= =
=
= /
/
=
=
2 2 2
c 1 2 1
que es lo mismo
1
E m(V V )
2
Se considera cero en el Reposo
=
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
11
Energa Potencial.
Esta asociada con la posicin del
sistema.
Se considera cero cuando el sistema se
localiza en el marco de referencia.
P
2 2
P
1 1
2 2
p
1 1
2 2
P 1 1
2
P 1 2 1
dE Fdz Como F mg
dE Fdz Sustituyendo
dE m g dz y al int egrar
E m g z o lo que es lo mismo
E m g(z z )
= =
=
=
=
=
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
12
Energa Interna.
Est asociada al estado termodinmico del sistema y expresa el grado de actividad molecular del
mismo, representa la suma de las E
C
y E
P
de las molculas.
Es una propiedad extensiva y se representa con la letra U (Mayscula).
Se cuantifica a partir de niveles de referencia arbitrarios, para el cual se considera cero la energa
interna del lquido saturado en el punto triple.
La energa interna especifica u es el resultado de dividir la energa interna total entre la masa del
sistema.
Es una propiedad intensiva que permite definir estados termodinmicos.
Se define entonces:
u
f
= Energa interna del lquido saturado.
u
g
= Energa interna del vapor saturado.
u < u
f
Lquido comprimido
u > u
g
Vapor sobrecalentado
u
f
< u < u
g
Mezcla saturada L+V
Para una mezcla saturada se cumple que
u
m
= u
f
+ x u
fg
m f
fg
u u
x
u
=
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
13
1 Ley para procesos en sistemas cerrados
Por unidad de masa
Definiendo:
Por unidad de tiempo
2 2
1 2 1 1 1 1 2 2 2 2
1 2
2 2
+ + + = + + +
E E
m m
Q V mgz mu W V mgz mu
2 2
12 1 1 1 12 2 2 2
1 2
1 1
2 2
e e
q V gz u w V gz u + + + = + + +
m
m
t
=
2 2
1 1 1 2 2 2
2 2
2 1
2 1 2 1
1 2
2 2
( ) ( ) 0
2
E E
m m
Q V mgz mu W V mgz mu
V V
Q m g z z u u W
+ + + = + + +
(
+ + + =
(
En sistemas cerrados generalmente
E
c
0 E
p
0
Por lo tanto la ecuacin queda
1 2 1 1 2 2
+ = + Q mu W mu
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
14
Definicin de la Entalpa.
Para el sistema formado por una sustancia pura, simple, compresible que experimenta un proceso de
expansin como el que se muestra en la figura.
1
2 Al aplicar la ecuacin de la Primera ley de la Termodinmica obtenemos
1 2 1 2 c p
1 2 1 2
1 2 2 1
1 2 2 2 2 1 1 1
1 2 2 1
Q W E Despreciando E y E
Q W U
Ocurre un trabajo de expansion a P Cte
W P(V V) Sustituyendo en la ecuacion de 1 Ley
Q (U P V ) (U PV)
Donde : U PV H Entalpia
Q H H
=
=
=
=
= + +
+ = =
=
La entalpa es una propiedad muy utilizada en el anlisis de ciertos procesos como generacin de
potencia, refrigeracin, flujo de fluidos, etc.
Es una combinacin de propiedades que se hace por simplicidad y conveniencia, se representa con la
letra H, se define como:
H = U + PV [KJ]
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
15
La entalpa especifica h es el resultado de dividir la entalpa total entre la masa del sistema.
h = u + Pv
La entalpa especifica es una propiedad que aparece tabulada en tablas termodinmicas y a partir de ella
se puede determinar el valor de la
energa interna especifica cuando sta no aparece en las tablas.
Se define entonces:
h
f
= Entalpa del lquido saturado.
h
g
= Entalpa del vapor saturado.
h < h
f
Lquido comprimido
h > h
g
Vapor sobrecalentado
h
f
< h < h
g
Mezcla saturada L+V
Para una mezcla saturada se cumple que
h
m
= h
f
+ x h
fg
m f
fg
h h
x
h
=
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
16
CALORES ESPECFICOS
Se sabe que al tener la misma masa de dos sustancias diferentes, se requiere diferentes cantidades de
energa para aumentar sus temperaturas en un grado.
El Calor Especfico es la energa que se necesita para aumentar la temperatura de una masa unitaria en
un grado.
El calor especfico depender de cmo se realice el proceso, tenemos calor especfico a Presin y
Volumen constante.
Por definicin tenemos:
Calor especfico a Volumen Constante.
Calor especfico a Presin Constante.
v
v
u
C
T
| |
=
|
\
p
p
h
C
T
| |
=
|
\
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
17
CALORES ESPECIFICOS PARA GASES IDEALES.
EXPERIMENTO DE JOULE
A
B
AIRE
AGUA
VACIO
TERMOMETRO
El recipiente A contiene inicialmente Aire a
presin, el recipiente B esta vaci, la vlvula se
encuentra cerrada.
Se abre la vlvula y se alcanza el equilibrio, se
observa que la temperatura del termmetro no
vara.
Se aplica la 1 ley de la termodinmica al sistema
cerrado formado por el aire.
Como la temperatura se mantuvo constante Joule
considero que:
q w du =
q 0 =
Como la expansin es contra el vaco
Al sustituir en la ecuacin de primera ley nos queda
que du = 0 u
2
= u
1
Se observa que el volumen especfico y la presin
varan en el proceso, por lo tanto la energa interna
no depende del volumen ni de la presin, se
concluye que solo es funcin de la temperatura.
w 0 =
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
18
u = f(T)
Para un proceso cualquiera de un gas ideal a volumen constante se tiene:
Como h = u + Pv
Para un gas ideal Pv = R
g
T
Al sustituir en la ecuacin de la entalpa
h = u + R
g
T
Como u = f(T) y R
g
es Cte.
Se puede concluir que para un gas ideal la entalpa no depende de la presin y es solo funcin de la
temperatura.
Se puede particularizar para cualquier proceso de un gas ideal.
v0 v0
du [Kj]
C C
dT [Kg K]
= =
p0 p0
dh [Kj]
C C
dT [Kg K]
= =
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
19
Para determinar cambios de energa interna de un gas ideal se puede despejar
du = C
v0
dT
Integrando la ecuacin anterior
Se debe conocer como varia C
v0
= f(T) para poder realizar la integral.
2
v0
1
u C dT =
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
20
Mtodos para resolver la integral
1.- Cuando T es pequeo se pude tomar C
v0
o C
p0
constante
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
21
2.- Cuando T es pequeo se pude tomar C
v0
o C
p0
promedio.
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
22
3.- Utilizando grficos: Permiten hallar C
v0
o C
p0
promedio, al evaluarlo a la temperatura
promedio. Son muy inexactos.
El calor especfico vara con la
temperatura
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
23
Cuando T es muy grande se debe conocer la ecuacin de la curva.
Donde a, b, c y d son constantes diferentes para cada sustancia.
2 3
p0
C a bT cT dT = + + +
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
24
Donde a, b, c y d son constantes diferentes para cada sustancia.
= Calor especifico en base molar
Unidades de Calor especifco, en base msica
Para expresar los calores especficos en base molar en calores especficos en base msica se divide entre
el peso molecular de la sustancia.
p0 v0
C o C
[ ]
[ ]
Kj
Kmol K
p0
v0
p0 v0
C
C
C C
PM PM
= =
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
25
RELACIONES ENTRE C
P0
y C
VO
h = u + Pv
Como Pv = R
g
T
h = u + R
g
T derivando dh = du + R dT
Como: du = C
v0
dT dh = C
p0
dT
Sustituyendo en la ecuacin de dh obtenemos
C
p0
dT = C
v0
dT + R dT
R = C
p0
- C
v0
Definiendo la relacin de calores especficos como
p0
v0
C
k
C
=
PRIMERA LEY DE LA TERMODINAMICA
APLICADA A SISTEMAS CERRADOS
Prof. Carlos G. Villamar L. TERMODINAMICA 1.
ING MECANICA. ULA
26
PREGUNTAS ?????????
También podría gustarte
- Rúbrica-Tarea Académica N°1Documento1 páginaRúbrica-Tarea Académica N°1sergdesAún no hay calificaciones
- Actividad MTA 2-Consumo en Calentadores Eléctricos y Gas-14-0-M1Documento1 páginaActividad MTA 2-Consumo en Calentadores Eléctricos y Gas-14-0-M1sergdesAún no hay calificaciones
- El Peruano: Domingo 10 de Mayo de 2020Documento7 páginasEl Peruano: Domingo 10 de Mayo de 2020Marcial Guillermo Perez HerreraAún no hay calificaciones
- Capítulo 07 - Trabajo y Energia - 2020-1Documento8 páginasCapítulo 07 - Trabajo y Energia - 2020-1sergdesAún no hay calificaciones
- BlaBla 3 1aLeyCerrados PDFDocumento9 páginasBlaBla 3 1aLeyCerrados PDFAndreAún no hay calificaciones
- FIRTH+INDUSTRIES+PERU+S.A Procedimiento+de+Homologación+2013+-+TRANSPORT.... UnlockedDocumento13 páginasFIRTH+INDUSTRIES+PERU+S.A Procedimiento+de+Homologación+2013+-+TRANSPORT.... UnlockedsergdesAún no hay calificaciones
- Rm. - 099 2020 MinamDocumento3 páginasRm. - 099 2020 Minamrosmel chavez loarteAún no hay calificaciones
- MTA3 Guion - Del - Alumno - 3 13 2 M1Documento1 páginaMTA3 Guion - Del - Alumno - 3 13 2 M1sergdesAún no hay calificaciones
- Tema 4 1ra Ley Sistema Cerrado TERMO 1Documento26 páginasTema 4 1ra Ley Sistema Cerrado TERMO 1sergdesAún no hay calificaciones
- Anexo Rm. 099-2020-Minam Recomendaciones para El Manejo de Residuos Solidos Durante La Emergencia Sanitaria Por Covid-19Documento17 páginasAnexo Rm. 099-2020-Minam Recomendaciones para El Manejo de Residuos Solidos Durante La Emergencia Sanitaria Por Covid-19David UlcoAún no hay calificaciones
- Reglamento de Bicicleyas PDFDocumento17 páginasReglamento de Bicicleyas PDFJonathan Chullo SantiagoAún no hay calificaciones
- Ingreso A Webinar 29-05-20 PDFDocumento2 páginasIngreso A Webinar 29-05-20 PDFsergdesAún no hay calificaciones
- He LadosDocumento32 páginasHe Ladosjose puma chavezAún no hay calificaciones
- Hoja de Ejercicios 4Documento5 páginasHoja de Ejercicios 4sergdesAún no hay calificaciones
- Rubrica Trabajo FinalDocumento4 páginasRubrica Trabajo FinalsergdesAún no hay calificaciones
- 1 PBDocumento12 páginas1 PBsergdesAún no hay calificaciones
- Ptar Biofisica 09-09-18Documento8 páginasPtar Biofisica 09-09-18sergdesAún no hay calificaciones
- He LadosDocumento32 páginasHe Ladosjose puma chavezAún no hay calificaciones
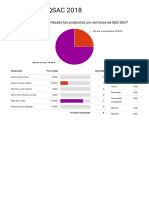
- Encuesta 2018Documento26 páginasEncuesta 2018sergdesAún no hay calificaciones
- Plan Anual de Seguridad y Salud en El Trabajo - MTCDocumento18 páginasPlan Anual de Seguridad y Salud en El Trabajo - MTCxohe8Aún no hay calificaciones
- R M 050-2013-TR Registros Obligatorios SGSSTDocumento186 páginasR M 050-2013-TR Registros Obligatorios SGSSTElmer PisfilAún no hay calificaciones
- Guia Basica Sobre SGSSTDocumento40 páginasGuia Basica Sobre SGSSTjossy_quispe7821100% (1)
- Iper CorpacDocumento14 páginasIper CorpacCristian Regalado LaverianoAún no hay calificaciones
- Sílabo - Investigación de OperacionesDocumento5 páginasSílabo - Investigación de OperacionessergdesAún no hay calificaciones
- Portaretratos de Papel RecicladoDocumento1 páginaPortaretratos de Papel RecicladosergdesAún no hay calificaciones
- Declaración Jurada Simple No AdeudarDocumento1 páginaDeclaración Jurada Simple No AdeudarsergdesAún no hay calificaciones
- Manual de Seguridad y Salud en El Trabajo - Sector MineroDocumento44 páginasManual de Seguridad y Salud en El Trabajo - Sector MineroSunafil100% (3)
- Matriz Electro Tec Nia Lab 904Documento4 páginasMatriz Electro Tec Nia Lab 904R. S.Aún no hay calificaciones
- Iper Sede Central - OtiDocumento141 páginasIper Sede Central - OtiAndy Baca GonzalesAún no hay calificaciones
- Presidentes Del PeruDocumento33 páginasPresidentes Del PerusergdesAún no hay calificaciones