Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Potenciales termodinámicos y pilas: principios de funcionamiento y aplicaciones
Cargado por
Ivan FortunattTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Potenciales termodinámicos y pilas: principios de funcionamiento y aplicaciones
Cargado por
Ivan FortunattCopyright:
Formatos disponibles
POTENCIALES
TERMODINAMICOS
Objetivo
Que el alumno conozca la importancia de los
potenciales termodinmicos , su interpretacin fsica y
su aplicacin en una reaccin de oxido reduccin en
una pila comercial
Qu es una reaccin de oxido
reduccin?
Se consideran como reacciones de transferencia de
electrones o el cambio de estado de oxidacin de los
reactivos
2.- Qu es una pila y cual es su
principio de su funcionamiento?
Una pila es un generador , dispositivo que transforma
la energa potencial qumica en energa elctrica
Las pilas bsicamente consisten en dos electrodos
sumergidos en un liquido, solido o pasta que se llama
electrolito .
Cuando los electrodos
reaccionan con el electrolito,
en uno de los electrodos
(nodo) se producen
electrones (oxidacin), y en el
otro (ctodo) se produce un
defecto de electrones
(reduccin). Cuando los
electrones sobrantes del
nodo pasan al ctodo a travs
de un conductor externo a la
pila se produce corriente
elctrica.
3. Investigar qu es una pila de xido de plata-zinc, cul
es la reaccin de xido-reduccin que se lleva a cabo en
ella y las aplicaciones de este tipo de pilas.
Una batera de xido de plata usa xido de plata como
el electrodo positivo, el zinc como electrodo negativo
adems de un electrolito alcalino, normalmente
hidrxido de sodio o hidrxido de potasio. La plata se
reduce en el ctodo y el zinc se oxida en el nodo
Ag2O (s) + Zn (s) 2 Ag (s) + ZnO (s)
Es un potencial termodinmico, es decir, una funcin
de estado extensiva con unidades de energa, que da la
condicin de equilibrio y de espontaneidad para una
reaccin qumica a temperatura y presin constantes.
La Energa Libre de un estado se define como G= G =
H-TS
A temperatura constante el cambio de energa libre se
describe como:
DG = H-TDS
El cambio de energa libre de un proceso
que se lleva a cabo a presin y temperatura
constantes y espontaneidad de una reaccin
es la siguiente:
Si DG es negativo, la reaccin es espontanea en el
sentido contrario.
Si DG es igual a cero, esta en equilibrio.
Si DG es positivo, la reaccin en el sentido directo no
es espontanea; es necesario aportar trabajo desde
los alrededores o entorno para que se lleve a cabo.
En cambio, la reaccin inversa ser espontanea
Entalpa qumica
Para una reaccin exotrmica a presin constante, la
variacin de entalpa del sistema es igual a la energa
liberada en la reaccin, incluyendo la energa
conservada por el sistema y la que se pierde a travs de
la expansin contra el entorno (es decir que cuando la
reaccin es exotrmica la variacin de entalpa del
sistema es negativa). Anlogamente, para una reaccin
endotrmica, la variacin de entalpa del sistema es
igual a la energa absorbida durante la reaccin,
incluyendo la energa perdida por el sistema y la
ganada a travs de la expansin contra el entorno (en
las reacciones endotrmicas el cambio de entalpa es
positivo para el sistema, porque gana calor).
Entropa
Podemos definir la entropa como el ndice de la
cantidad de energa no disponible en un sistema
termodinmico dado en un momento de su
evolucin. Es la relacin que existe entre el calor de
un sistema y su temperatura. Qrev/T
Sirve para medir el grado de desorden dentro de un
proceso y permite distinguir la energa til, que es la
que se convierte en su totalidad en trabajo, de la
intil, que se pierde en el medio ambiente.
Relacin entre DG, DH y DS a
Temperatura constante
La relacin entre la energa libre de Gibbs con la
entropa y entalpa de una reaccin depende
directamente de los signos que stas posean stas
y se determina mediante la siguiente ecuacin:
DG = H-TDS
Factores que afectan el signo de
DG
La relacin entre la energa y el desorden puede
explicarse a partir de la siguiente ecuacin:
donde H es el contenido energtico o entalpa, T es la
temperatura absoluta, S es la entropa y G la llamada
energa libre de Gibbs.
La variacin de G es la que determina el carcter
espontneo de una reaccin qumica. En todos los
procesos espontneos la energa libre del sistema
disminuye, es decir, el valor final de G es menor que el
inicial y, por tanto, G es negativa.
De acuerdo con la anterior ecuacin, tal disminucin
(G<0) podr ser debida a una disminucin del
contenido energtico H (H<0), a un aumento del
desorden (S>0) o a ambos.
El resultado final de ese balance entre energa y
desorden es entonces el responsable de la
espontaneidad de la reaccin. Si TS es mayor que H
aunque el proceso sea endotrmico (H>0) ser
espontneo (G<0)
Qu es trabajo elctrico?
El trabajo elctrico se define como la cantidad de
energa consumida por unidad de tiempo, esta
energa proviene de una fuente elctrica.
En el sistema internacional , la unidad de potencia
es el joule por segundo (J / s), conocido como el
watt.
W= Pt
No obstante potencia se define:
P=
2
Donde:
V= Diferencia de voltaje que se expresa en volts (J/cb)
R= resistencia que se expresa en ohms
Otra forma de expresar la potencia:
P= VI
Donde:
I= Intensidad que se expresa en Amperes
Qu es potencial elctrico?
El potencial elctrico o potencial electrosttico en un
punto, es el trabajo que debe realizar un campo
electrosttico para mover una carga positiva q:
V= w/q
Sus unidades son voltios= J/cb
Criterios de espontaneidad
Para un proceso a temperatura y presin constantes, el
cambio en la energa libre de Gibbs, G, es:
El signo de G depende de los signos de los cambios en
entalpa (H) y entropa (S), as como de la temperatura
absoluta (T, en Kelvin). G cambia de positivo a negativo (o
viceversa) en el valor donde T = H/S.
Cuando G es negativo, un proceso o reaccin qumica
ocurre espontneamente en la direccin dada.
Cuando G es positivo, el proceso o reaccin qumica ocurre
espontneamente en la direccin inversa a como est dada.
Cuando G es cero, el proceso se encuentra en equilibrio, sin
que tome lugar un cambio neto a travs del tiempo.
Podemos adems distinguir cuatro casos con la
regla descrita anteriormente, por medio de
examinar los signos de los dos trminos en el lado
derecho de la ecuacin.
Cuando S es positivo y H es negativo, un
proceso es espontneo.
Cuando S es positivo y H es positivo, un
proceso es espontneo a altas temperaturas,
donde el carcter endotrmico del proceso
(indicado por H) juega un pequeo rol en el
balance final.
Cuando S es negativo y H es negativo, un
proceso es espontneo a bajas temperaturas,
done el carcter exotrmico del proceso ahora s
resulta importante.
Cuando S es negativo y H es positivo, un
proceso no es espontneo a ninguna
temperatura, pero el proceso inverso es
espontneo
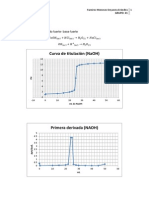
Ecuacin para una reaccin redx
También podría gustarte
- Problemas 17 SeptDocumento4 páginasProblemas 17 SeptIvan FortunattAún no hay calificaciones
- Tarea3 Ing - Economica1Documento2 páginasTarea3 Ing - Economica1Ivan FortunattAún no hay calificaciones
- ExperimentosMasa DifusiónDocumento1 páginaExperimentosMasa DifusiónIvan FortunattAún no hay calificaciones
- Difraccion e Interferencia Casi CompletaDocumento36 páginasDifraccion e Interferencia Casi CompletaIvan FortunattAún no hay calificaciones
- Analitica Acido BaseDocumento6 páginasAnalitica Acido BaseIvan FortunattAún no hay calificaciones
- 7Documento1 página7Ivan FortunattAún no hay calificaciones
- PráCtica de ElectrocardiogramaDocumento5 páginasPráCtica de ElectrocardiogramaIvan FortunattAún no hay calificaciones
- Calcular La Carga Eléctrica Total de ErínDocumento6 páginasCalcular La Carga Eléctrica Total de ErínIvan FortunattAún no hay calificaciones
- Analitica Acido BaseDocumento6 páginasAnalitica Acido BaseIvan FortunattAún no hay calificaciones
- Ciclo HexanoDocumento1 páginaCiclo HexanoIvan FortunattAún no hay calificaciones
- Oxidación de Los Metales y Propiedades PeriódicasDocumento2 páginasOxidación de Los Metales y Propiedades PeriódicasIvan Fortunatt100% (2)
- Ciencia La Frontera Sin Fin ComentarioDocumento2 páginasCiencia La Frontera Sin Fin ComentarioIvan FortunattAún no hay calificaciones
- AGASOLDocumento7 páginasAGASOLOmar JesúsAún no hay calificaciones
- 3..tecnica HistologicaDocumento22 páginas3..tecnica HistologicaJuanAún no hay calificaciones
- Flyer - BR - Volante GalMac 4R - SP - Feb21Documento2 páginasFlyer - BR - Volante GalMac 4R - SP - Feb21Santiago HuancaAún no hay calificaciones
- Matriz de Compatibilidad QuímicaDocumento3 páginasMatriz de Compatibilidad QuímicaSorany Alarcón AmézquitaAún no hay calificaciones
- DestilaciionDocumento8 páginasDestilaciionupanafrayAún no hay calificaciones
- Trabajo Materiales Unidades I, IIDocumento294 páginasTrabajo Materiales Unidades I, IIJesús Adrián RAún no hay calificaciones
- Rocas Sedimentarias Trabajo de ExposicionDocumento9 páginasRocas Sedimentarias Trabajo de ExposicionLUIS JAIME RAMOS POMPAAún no hay calificaciones
- Marea Roja - Toxinas y Bioensayo en RatonDocumento6 páginasMarea Roja - Toxinas y Bioensayo en RatonMTKestAún no hay calificaciones
- MULTIS EP 2 - 084738 - Argentina - Spanish - 20210128Documento12 páginasMULTIS EP 2 - 084738 - Argentina - Spanish - 20210128Cesar RivasAún no hay calificaciones
- Unidad 2 - Fase 2 - Métodos Analíticos1Documento21 páginasUnidad 2 - Fase 2 - Métodos Analíticos1Leidy Yaneth Quiñonez50% (6)
- Digestion GastricaDocumento19 páginasDigestion GastricaPedro José Barboza EspejoAún no hay calificaciones
- GelatinaDocumento9 páginasGelatinaPaola GilAún no hay calificaciones
- Mercaptano o PolisulfuroDocumento2 páginasMercaptano o PolisulfuroAndreina ochoaAún no hay calificaciones
- What Is ASTM SpanishDocumento12 páginasWhat Is ASTM SpanishTeodoroAún no hay calificaciones
- CIRANO - PLUS Hoja de SeguridadDocumento8 páginasCIRANO - PLUS Hoja de Seguridadgerardo antonio cortes garciaAún no hay calificaciones
- Exposicion de PinturasDocumento21 páginasExposicion de PinturasImanol FloresAún no hay calificaciones
- PRÁCTICA 1 Solubilidad de Compuestos Orgánicos e InorgánicosDocumento2 páginasPRÁCTICA 1 Solubilidad de Compuestos Orgánicos e InorgánicosNicolas Henao SaavedraAún no hay calificaciones
- Inv.e 125 - Determinación Del Límite Líquido de Los SuelosDocumento5 páginasInv.e 125 - Determinación Del Límite Líquido de Los SuelosCRISTIAN DAVID CARLOZAMA DIAZAún no hay calificaciones
- Balance de Masa en Una Caldera de VavorDocumento3 páginasBalance de Masa en Una Caldera de VavorJavier Coronado BautistaAún no hay calificaciones
- Bioseguridad en OdontologíaDocumento37 páginasBioseguridad en OdontologíaSilvia FlorAún no hay calificaciones
- Un Metal de Interés Tecnológico - El AluminioDocumento3 páginasUn Metal de Interés Tecnológico - El AluminiolujulAún no hay calificaciones
- OnicolisisDocumento3 páginasOnicolisislancelot630Aún no hay calificaciones
- Manual de Bomba Pgp35-5Documento12 páginasManual de Bomba Pgp35-5helloaldoAún no hay calificaciones
- HER - Hid.001 Cartilla Uso Gatas HidráulicasDocumento15 páginasHER - Hid.001 Cartilla Uso Gatas HidráulicascarlosgomeznoriegaAún no hay calificaciones
- Informe Elaboracion de Jabon A Partir de Aceite Extraido Del Motacu-1Documento44 páginasInforme Elaboracion de Jabon A Partir de Aceite Extraido Del Motacu-1Pablo Juan ZarateAún no hay calificaciones
- Estudios Sobre Cancer en BomberosDocumento35 páginasEstudios Sobre Cancer en BomberosMatías Rivas MotaAún no hay calificaciones
- Construye tu invernadero caseroDocumento17 páginasConstruye tu invernadero caserojeskaroteAún no hay calificaciones
- Hornos y TragantesDocumento14 páginasHornos y TragantesYelcin Caled Caballero VillamizarAún no hay calificaciones
- CLASE Cinetica - Equilibrio GRADO 11 2021....Documento30 páginasCLASE Cinetica - Equilibrio GRADO 11 2021....jhelen dayana palacio bernalAún no hay calificaciones
- Examen Parcial Ventilacion de MinasDocumento9 páginasExamen Parcial Ventilacion de MinasCristhian Benjamin Dister Huaman Janampa100% (2)