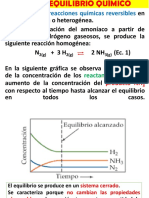
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Estequiometria 14-05
Cargado por
Joselyn Parra RiveroDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Estequiometria 14-05
Cargado por
Joselyn Parra RiveroCopyright:
Formatos disponibles
ESTEQUIOMETRIA
Qumica Electivo Tercero Medio
LEY DE VOLUMENES
Hacia 1808 Joseph-Louis
Gay-Lussac estableci que,
en cualquier reaccin
qumica, los volmenes de
todas las sustancias
gaseosas que intervienen
en la misma, medidos en
las mismas condiciones de
presin y temperatura,
estn en una relacin de
nmeros enteros sencillos.
LEY DE AVOGADRO
Establece que en las mismas condiciones de
temperatura y presin, igual volmenes de gases
tienen el mismo nmero de molculas
CONCEPTOS BSICOS
Las masa de los tomos
se puede comparar,
utilizando la escala de
masa atmica, cuya
unidad patrn es la
unidad de masa atmica
( o uma).
1 = 1,66x10
-24
g
Las masa atmica que aparece en
la Tabla peridica, es un promedio
relativo a las abundancias de cada
uno de los istopos existentes en la
naturaleza de cada uno de los
elementos.
Masa atmica
EJEMPLO 1
Determinar la masa atmica del cloro si tiene dos
istopos, cuyas masas atmicas son 35 y 37 .
Sus abundancias relativas son 77,5% y 22,5%,
respectivamente.
MOL
La cantidad de sustancia que contienen tantas entidades
elementales como tomos hay exactamente en 12 gramos
de carbono 12.
CUNTOS TOMOS HAY EN 12 G DE C-12?
N
A
= 6,02x10
23
Nmero de Avogadro (N
A
)
1mol de e.e = N
A
de e.e
*e.e= entidades elementales (tomos, molculas iones,
ncleos, electrones)
1 par de
anteojos
2
anteojos
1 docena
de dulces
12 dulces
1 mol de
tomos
6,02x10
23
tomos
MASA MOLAR Y MOLECULAR
Masa en gramos (g) de
un mol de sustancia
(tomos o molculas).
Suma de las masas
atmicas de cada uno de
los elementos que
conforman un
compuesto.
MASA MOLAR MASA MOLECULAR
EJEMPLO 2
Determinar la masa molar de:
a) H
2
S
b) C
4
H
10
c) Al(OH)
3
d) HNO
3
MOL Y SUS EQUIVALENCIAS
Contiene 6,02x10
23
e.e
1 mol
En masa es = MM
1 mol
De un gas ocupa un
volumen de 22,4 L (C.N)
1 mol
EJEMPLO 3
Cuntas molculas y tomos hay en 3 moles de
oxgeno molecular ?
EJEMPLO 4
Cuntos moles existen en 108 g de una sustancia
cuya masa molar es 27 g/mol?
Reaccin qumica
(cambio qumico) sucede
cuando cierto grupo de
sustancias, se combinan
entre s para originar
nuevas especies. Cada
Representacin de una
reaccin qumica que
muestra las sustancias a
reaccionar (reactivos), y
el resultado de esa
combinacin
(productos). Tambin se
especfica en qu
condiciones fsicas se
encuentran las especies
y las cantidades de cada
uno de ellas.
Reaccin Qumica Ecuacin Qumica
La ecuacin qumica permite establecer relaciones
cuantitativas entre reactantes y productos y debe
estar BALANCEADA, IGUALADA O
EQUILIBRADA.
Para esto se anteponen coeficientes
estequiomtricos a elementos o compuestos, para
igualar el nmero de tomos de cada elemento en
ambos miembros.
Muchas ecuaciones qumicas se balancean por
simple inspeccin, usando el Mtodo de Tanteo
(prueba y error).
BALANCE DE ECUACIONES
1) Escribir la ecuacin no igualada con smbolos y/o frmulas
correctas de reactivos y productos.
2) Igualar la ecuacin ajustando los coeficientes que preceden las
frmulas y/o smbolos.
Ej) C
2
H
4
+ O
2
CO
2
+ H
2
O
2 tomos de C 1 tomos de C
4 tomos de H 2 tomos de H
2 tomos de O 3 tomos de O
MTODO DE TANTEO
C
2
H
4
+ O
2
2 CO
2
+ H
2
O
2 tomos de C 2 tomos de C
4 tomos de H 2 tomos de H
2 tomos de 0 5 tomos de 0
C
2
H
4
+ O
2
2 CO
2
+ 2 H
2
O
2 tomos de C 2 tomos de C
4 tomos de H 4 tomos de H
2 tomos de O 6 tomos de O
C
2
H
4
+ 3 O
2
2 CO
2
+ 2 H
2
O
2 tomos de C 2 tomos de C
4 tomos de H 4 tomos de H
6 tomos de O 6 tomos de O
MTODO ALGEBRAICO
PASO 1.
A cada molcula identifiqumosla con una
letra:
A B C D
C
6
H
14
O
4
+ O
2
CO
2
+ H
2
O
EL MTODO ALGEBRAICO
PASO 2.
Formar ecuaciones de la siguiente manera:
A B C D
C
6
H
14
O
4
+ O
2
CO
2
+ H
2
O
H: 14A = 2D
C: 6A = 1C
O: 4A + 2B = 2C + 1D
EL MTODO ALGEBRAICO
PASO 3.
Escribir las ecuaciones y establecer un valor a
la letra A:
Supongamos que el valor de A = 2
(adivinando, pero debe darse en nmero
entero)
H: 14A = 2D
C: 6A = 1C
O: 4A + 2B = 2C + 1D
EL MTODO ALGEBRAICO
PASO 4.
Calculemos los valores de las otras letras
partiendo que A = 2 y las ecuaciones echas en
el paso 2.
A = 2
14A = 2D
6A = 1C
4A + 2B = 2C + 1D
14A = 2D
14A = D
2
14 (2) = D
2
D = 14
6A = C
6(2) = C
C = 12
4A +2B = 2C + D
2B = 2C +D - 4A
B = 2C +D 4A
2
B = 2(12) + (14) 4(2) = 15
2
FRMULA EMPRICA Y MOLECULAR
Smbolo: representan de forma abreviada los elementos
qumicos y los tomos de dichos elementos.
Frmula: representa de forma abreviada, las sustancias
qumicas tal y como se presentas en condiciones estndar
(25
0
C y 1 atm.). Smbolos + subndices que indican el n de
tomos de cada elemento.
Oxgeno: molculas formadas por dos tomos de oxgeno. O
2
(subndice indica el n de tomos en la molcula)
cido sulfrico: dos tomos de hidrgeno
por uno de azufre y cuatro de oxgeno
H
2
SO
4
FRMULA EMPRICA Y MOLECULAR
Frmula Emprica: es la frmula ms sencilla que puede
representar el compuesto, sin indicar el nmero de veces
que se repite esta unidad bsica.
Ej: Frmula emprica de butano
Frmula molecular: aplicable slo a sustancias moleculares,
nos informa del n de tomos que integran cada molcula.
Ej: Frmula molecular del butano
C
2
H
5
(C
2
H
5
) = C
4
H
10
TIPO DE FRMULAS
TIPOS DE FRMULAS
Frmula Estructural: indica como se encuentran
distribuidos y situados los distintos tomos en una
molcula o estructura inica.
DETERMINACIN DE FRMULA EMPRICA Y
MOLECULAR
1. Cuando no se indica la masa de la muestra, suponer una
masa total de compuesto. Lo ms conveniente es que sea
100 g.
2. Calcular la masa de cada elemento presente en el
compuesto a partir del porcentaje. Este paso no es
necesario cuando se conoce la masa de cada elemento.
3. Calcular la cantidad de sustancia (n) de cada elemento
presente en el compuesto, para lo cual se utilizan las
masas molares.
4. Si la cantidad de sustancia (n) de cada elemento en el
compuesto no es un nmero entero, dividir entre el ms
pequeo de los valores.
DETERMINACIN DE FRMULA EMPRICA Y
MOLECULAR
1. Si an as no todos los nmeros son enteros, se
multiplica por un comn mltiplo a todos los
valores, para obtener nmeros enteros.
Para determinar la formula molecular
1. Calcular la masa molar de frmula emprica
2. Dividir la masa molar de la frmula molecular por
la masa molar de la frmula emprica, para
obtener un factor multiplicador.
67 . 6
00 . 1
67 . 6
33 . 3
14
67 . 46
67 . 1
16
67 . 26
67 . 1
12
00 . 20
v z
y x
Una sustancia orgnica que se supone pura ha dado la siguiente
composicin centesimal: 20.00% de C; 26.67% de O; 46.67% de N y
6.67% de H. Determinar su frmula emprica.
Sea C
x
H
v
N
z
O
y
la frmula emprica
Tenemos que calcular x, y, z , v, que son proporcionales al n de moles de
los diferentes tomos
Por tanto: x=1; Y=1; Z=2; V=4 y la frmula es CH
4
N
2
O
(urea)
99 . 3
67 . 1
67 . 6
; 99 . 1
67 . 1
33 . 3
; 1
67 . 1
67 . 1
; 1
67 . 1
67 . 1
67 . 1
v z
y x
por s Dividiremo
EJEMPLO 1
3
67 . 6
20
1
67 . 6
67 . 6
00 . 20
00 . 1
80 100
67 . 6
12
80
y x
y x
mol
g
L atm
K
K mol
L atm
g
M
pV
mRT
M
M
mRT
pV nRT pV
02 . 30
5 . 0 84 . 0
310 082 . 0 496 . 0
1 1
La masa de un hidrocarburo gaseoso contenido en un matraz de 500 ml a
37
0
C y 0.84 atm es de 0.496 g. Si contiene 80% de carbono. Halla la
frmula emprica y la molecular.
La frmula emprica para un hidrocarburo es C
x
H
y
, donde:
La frmula emprica es CH
3
Frmula molecular (CH
3
)
n
Calcular la
masa molecular
2
15
02 . 30
15 ) 1 3 12 ( 02 . 30
mol
g
mol
g
n
mol
g
n
mol
g
n
mol
g
M n M
emprica
Frmula molecular
(CH
3
)
2
C
2
H
6
EJEMPLO 2
O moles
mol
g
g
z
H mol
mol
g
g
y C mol
mol
g
g
x
0222 . 0
16
) 044 . 0 6 . 0 ( 1
044 . 0
00 . 1
044 . 0
05 . 0
12
6 . 0
4 1 4 : ; 8 4 2 : ; 9 4 24 . 2 :
1
022 . 0
022 . 0
: ; 2
0222 . 0
044 . 0
: ; 24 . 2
0222 . 0
05 . 0
:
z y x
z y x
La aspirina es un analgsico muy conocido. Su composicin, al analizar 1g
de aspirina comercial, es la siguiente: 0.6 g de C; 0.044 g de H y el resto,
de oxgeno. Determinar su frmula emprica y molecular (MM= 180
g/mol)
Frmula emprica C
x
H
y
O
z
Calcular moles
Dividir por el menor
n de moles.
Frmula molecular
1
) 16 4 1 8 12 9 (
180
) 16 4 1 8 12 9 ( 180
n
n M n M
empirica
C
9
H
8
O
4
C
9
H
8
O
4
EJEMPLO 3
También podría gustarte
- Historia Clinica LaboralDocumento3 páginasHistoria Clinica LaboralAargeniz ZavaletaAún no hay calificaciones
- Comandantes funerariosDocumento84 páginasComandantes funerariosrotcivicius0% (1)
- Hotel SicarareDocumento162 páginasHotel Sicarareyisela rodriguezAún no hay calificaciones
- Tarea 2 Ser Humano y Desarrollo SostenibleDocumento6 páginasTarea 2 Ser Humano y Desarrollo SostenibleArienny Castillo100% (1)
- RFT 400019 CA Niepos yDocumento31 páginasRFT 400019 CA Niepos yFrank Gomer Gonzales ArroyoAún no hay calificaciones
- Calidad agua Lago TiticacaDocumento113 páginasCalidad agua Lago TiticacaAnonymous g1wuXFAún no hay calificaciones
- Guía de Ejercicios de EsterquiometríaDocumento3 páginasGuía de Ejercicios de EsterquiometríaJoselyn Parra RiveroAún no hay calificaciones
- Química Electivo Tercero MedioDocumento26 páginasQuímica Electivo Tercero MedioJoselyn Parra RiveroAún no hay calificaciones
- Zonas de ChileDocumento2 páginasZonas de ChileJoselyn Parra RiveroAún no hay calificaciones
- Modelo Mecano-Cuántico 1° Medio 2015Documento18 páginasModelo Mecano-Cuántico 1° Medio 2015Joselyn Parra RiveroAún no hay calificaciones
- ISOMERIADocumento43 páginasISOMERIAJoselyn Parra RiveroAún no hay calificaciones
- Modelo Mecano-Cuántico 1° Medio 2015Documento18 páginasModelo Mecano-Cuántico 1° Medio 2015Joselyn Parra RiveroAún no hay calificaciones
- Modelo Mecano-Cuántico 1° Medio 2015Documento18 páginasModelo Mecano-Cuántico 1° Medio 2015Joselyn Parra RiveroAún no hay calificaciones
- Guía de LaboratorioDocumento2 páginasGuía de LaboratorioJoselyn Parra RiveroAún no hay calificaciones
- Química Electivo Tercero MedioDocumento26 páginasQuímica Electivo Tercero MedioJoselyn Parra RiveroAún no hay calificaciones
- Guía 1° MedioDocumento4 páginasGuía 1° MedioJoselyn Parra RiveroAún no hay calificaciones
- Química Electivo Tercero MedioDocumento26 páginasQuímica Electivo Tercero MedioJoselyn Parra RiveroAún no hay calificaciones
- Guía de LaboratorioDocumento2 páginasGuía de LaboratorioJoselyn Parra RiveroAún no hay calificaciones
- Configuración ElectrónicaDocumento12 páginasConfiguración ElectrónicaJoselyn Parra RiveroAún no hay calificaciones
- Fracciones 4 PrimariaDocumento24 páginasFracciones 4 PrimariaTeodoro Almerco AvalosAún no hay calificaciones
- 1 EstequiometriaDocumento27 páginas1 EstequiometriaJoselyn Parra RiveroAún no hay calificaciones
- Guía 2 Primero MedioDocumento1 páginaGuía 2 Primero MedioJoselyn Parra RiveroAún no hay calificaciones
- Nociones Básicas de QuímicaDocumento3 páginasNociones Básicas de QuímicaJoselyn Parra RiveroAún no hay calificaciones
- Analisisinstunidad1 120223182303 Phpapp01Documento45 páginasAnalisisinstunidad1 120223182303 Phpapp01William Herrera JimenezAún no hay calificaciones
- 03 Cin Tica Qu MicaDocumento37 páginas03 Cin Tica Qu MicaGarcia Lopez Maria LuisiAún no hay calificaciones
- 03 Cin Tica Qu MicaDocumento37 páginas03 Cin Tica Qu MicaGarcia Lopez Maria LuisiAún no hay calificaciones
- Guía de EjerciciosDocumento2 páginasGuía de EjerciciosJoselyn Parra RiveroAún no hay calificaciones
- Los MayasDocumento9 páginasLos Mayasnano manAún no hay calificaciones
- Ejemplo Acta de ConstituciónDocumento24 páginasEjemplo Acta de ConstituciónJANETH TATIANA SOLANO CARDENASAún no hay calificaciones
- Algoritmo MaquinaDocumento4 páginasAlgoritmo MaquinaSaúl Pereyra PereyraAún no hay calificaciones
- Manual de Acceso SenadisDocumento9 páginasManual de Acceso Senadis'Karen Eliizabeth'Aún no hay calificaciones
- Dcim - T14-4 - Grupo de Pilotes - TeoriaDocumento30 páginasDcim - T14-4 - Grupo de Pilotes - TeoriaJuan TorresAún no hay calificaciones
- Inbound MarketingDocumento13 páginasInbound MarketingCeleste VeraAún no hay calificaciones
- Sistema Integrado de GestiónDocumento34 páginasSistema Integrado de GestiónAbel CarrAún no hay calificaciones
- SOLICITUD PRISION DOMICILIARIA David Stiven LunaDocumento5 páginasSOLICITUD PRISION DOMICILIARIA David Stiven Lunacarlosjose_contreras3846Aún no hay calificaciones
- Ficha Tecnica Taladro BaukerDocumento25 páginasFicha Tecnica Taladro BaukerClaudia CardonaAún no hay calificaciones
- Caso Practico Unidad 3Documento7 páginasCaso Practico Unidad 3Cristina PrimeraAún no hay calificaciones
- MF4700 Tractores Global SeriesDocumento2 páginasMF4700 Tractores Global SeriesPablo PiccasoAún no hay calificaciones
- Herman - Unas Huellas Rabínicas en El CarneroDocumento9 páginasHerman - Unas Huellas Rabínicas en El CarneroLuis Castellví LaukampAún no hay calificaciones
- Rigidez Ejercicios Resueltos Parte 1 128140 Downloable 936980Documento16 páginasRigidez Ejercicios Resueltos Parte 1 128140 Downloable 936980JAIME JOSE CHIPANA SORIAAún no hay calificaciones
- Dynamo StudioDocumento2 páginasDynamo StudiomakortoAún no hay calificaciones
- Vender más con TwitterDocumento2 páginasVender más con Twitterjuan0% (1)
- Nombres Comerciales Completos18 de Abril de 2022Documento372 páginasNombres Comerciales Completos18 de Abril de 2022Solanny RosadoAún no hay calificaciones
- 04 204 FLSmidth Krebs GMAX Hydrocyclones 4-19-17 SPANISH WebDocumento4 páginas04 204 FLSmidth Krebs GMAX Hydrocyclones 4-19-17 SPANISH WebJonathan Atamari ViAún no hay calificaciones
- Tema V Equilibrio QuímicoDocumento28 páginasTema V Equilibrio QuímicojoseAún no hay calificaciones
- Indiana Jorrat. Tesis - de Ella Se DecíaDocumento10 páginasIndiana Jorrat. Tesis - de Ella Se DecíaMay MartinezAún no hay calificaciones
- Certificado Coordinador Trabajo en AlturasDocumento1 páginaCertificado Coordinador Trabajo en AlturasAnonymous qrdoZqlAún no hay calificaciones
- Experiencia 4 Primera SemanaDocumento8 páginasExperiencia 4 Primera SemanaRuthcyta FriendAún no hay calificaciones
- InterconductismoDocumento38 páginasInterconductismoBianca A. Castro MataAún no hay calificaciones
- 8-. Arata y Marin o - EL OFICIO DE ENSEN AR UNA CUESTION DE ESTADODocumento22 páginas8-. Arata y Marin o - EL OFICIO DE ENSEN AR UNA CUESTION DE ESTADOSergio RolonAún no hay calificaciones
- Resolucion TP2Documento14 páginasResolucion TP2Anahi ZelayaAún no hay calificaciones