Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Adsorcion Wloyola 2006
Cargado por
Mis Classes FastclassesTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Adsorcion Wloyola 2006
Cargado por
Mis Classes FastclassesCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL DE TRUJILLO
DEPARTAMENTO DE INGENIERIA QUIMICA
MODELADO Y SIMULACIN DE LA
ADSORCIN TENARIA DE SOLUCIONES
ACUOSAS EN LECHO FIJO
PROMOCION DOCENTE
ASOCIADO - PRINCIPAL
Wilber Loyola Carranza
www.fast-classes.wix.com/fastclasses
TRUJILLO - PERU
RESUMEN
En el presente trabajo se realiza el ajuste de parmetros de los
modelos de adsorcin de Freundlich, Langmuir y Dual
Langmuir usando el mtodo de Marquardt para diez solutos
en soluciones acuosas diluidas. Los parmetros ptimos de
los modelos seleccionados para cada soluto son usados para
predecir el equilibrio multisoluto mediante la teora de la
solucin adsorbida ideal (IAS).
Asimismo, se analiza el comportamiento dinmico de mezclas
de estos componentes y de un sistema cuyo equilibrio
multicomponente no es adecuadamente descrito por los
modelos de Freundlich, Langmuir o Dual Langmuir; a su paso
por una columna de lecho fijo rellena con carbn activado.
II.
OBJETIVOS
2.1 Objetivo general
Predecir el equilibrio y el perfil de relacin de
concentraciones de una solucin acuosa
multicomponente diluida, cuando sta fluye a travs
de un lecho empacado con carbn activado.
2.2 Objetivos especficos
Determinar los parmetros ptimos de los modelos de
Freundlich, Langmuir y Dual Langmuir para los
siguientes sistemas formados por un soluto en solucin
acuosa diluda: acetona, cido benzoico, cido fenil
actico, 2,4 diclorofenol, cido dodecil bencen
sulfnico, fenol, p-cresol, p-clorofenol, p-nitrofenol,
propionitrilo.
2.2.2 Predecir el equilibrio multicomponente,
mediante la teora de la solucin adsorbida
ideal, de las siguientes soluciones acuosas
diluidas:
p-Nitrofenol (1)-fenol(2)-agua;
Acetona(1)-propionitrilo(2)-agua;
p-Cresol(1)-p-clorofenol(2)-agua;
p-Nitrofenol(1)-p-clorofenol(2)-agua;
p-Nitrofenol(1)-cido benzoico(2)-agua;
p-Clorofenol(1)-cido fenil actico(2)-agua;
2,4-Diclorofenol(1)-cido
dodecilbencensulfnico(2)-agua
2.2.3 Predecir el comportamiento dinmico de la adsorcin
ternaria en una columna de lecho fijo, para los siguientes
sistemas :
Acetona(1)-propionitrilo(2)-2,4-diclorofenol(3)-agua.
p-Cresol(1)-p-clorofenol(2)-propionitrilo(3)-agua.
p-Cresol(1)-p-clorofenol(2)-cido benzoico(3)-agua
p-Cresol(1)-p-clorofenol(2)-p-nitrofenol(3)-agua
p-Nitrofenol(1)-p-clorofenol(2)-cido benzoico(3)-agua.
Acido benzoico(1) - p-cresol(2) - 2,4-diclorofenol(3)-agua.
Propionitrilo(1)-cido benzoico(2) - p-cresol(3)-agua.
p-Cresol(1)-1,2-diclorofenol(2)-p-nitrofenol(3)-agua.
2.2.4 Analizar el efecto de las caractersticas fsicas del
carbn activado, de las caractersticas del lecho y
propiedades de flujo a travs de este y de los parmetros
de transporte y tiempo de procesamiento, sobre el
comportamiento de las concentraciones del sistema 2-
butanol (1)- alcohol t-amlico (2) fenol(3) agua en una
columna de adsorcin de lecho fijo.
INTRODUCCION
Los procesos de separacin juegan un papel
fundamental en la industria de los procesos
qumicos. Estos se usan para eliminar impurezas
de la materia prima, recuperacin de productos
primarios o la eliminacin de contaminantes de los
efluentes acuosos o gaseosos. Ejemplos de
algunos procesos incluyen per-vaporacin,
smosis reversa, dilisis, adsorcin, cromatografa,
electrodilisis, membranas, etc.
1 ft
3
de carbn activado puede tratar ms de 5 millones de
galones de agua conteniendo 1ppm (1 mg L) de cloro
libre. El costo de operacin de un filtro de GAC es
alrededor de 5 - 6 centavos de dlar / 1000 Gal.
(Chem Eng.Jan 1991, pg 76)
Para este efecto se ha procedido a una revisin
bibliogrfica sobre los modelos cinticos y de
equilibrio de la adsorcin mediante carbn activado
granular (CAG), el cual posee una serie de
caractersticas especficas que lo hacen adecuado
para el tratamiento de efluentes que contaminan el
ambiente (1,2,3,4,5,6,7,8).
ANTECEDENTES DEL EQUILIBRIO DE ADSORCION SOLIDO-LIQUIDO
1. Fritz & and Shluender, 1974 : ADSORBENTE - CARBON ACTIVADO.
2a. Hsieh(1974) : ADSORBENTE C.A.
2b. BALZLI 1977 ECUACION EMPIRICA DEL TIPO LANGMUIR: SISTEMA: 2 - BUTANOL - ALCOHOL TERAMILICO:
ADSORBENTE (C.A)
3.MODELO DEL POTENCIAL DE ADSORCION COMPETITIVO - Wang, S (16).
4. MODELO ESTADISTICO DE DOS PARAMETROS PARA 1,2 Y 3 COMPONENTES ADSORBIBLES: (Ram k.
Gupta Deepak Kunzru, Deoki n. Saraf
5. ENFOQUE DE LA TERMODINAMICA CLASICA ( Larinov & Myers; Minka & Myers, Ref.10)
6. Termodinmica estadstica: Sircar & Myers, Ref
7. Enfoque de Cooney & Strusi
8. Prediccin de la adsorcin binaria (Costa, 1t al., Ref 21)
9. Termodinmica de soluciones ideales diluidas (Radke & Prausnitz, Ref 23)
10.Prediccin de la adsorcin de mezclas lquidas (Sircar & Myers, Ref.24)
11. Modelo de adsorcin de mezclas orgnicas de Fritz-Schluender-Balzli (Ref.13,15
12. Isotermas de adsorcin de Freundlich (Kueenen, et al., Ref.25)
AJUSTE DE MODELOS DE
EQUILIBRIO
* Langmuir; Dual Langmuir;
Freundlich
* Distribucin de residuales
* Hiper elipsoide de confianza
de los parmetros
TEORIA DE LA SOLUCION
ADSORBIDA IDEAL
J. Williams Gibbs (1878) e independientemente J.J. Thomson dedujeron la relacin
exacta entre adsorcin y tensin superficial. Tambin a la fecha existen otras
teoras.
Asunciones bsicas:
1. A U
proceso adsorcin
T
=
0
AU
adbte
<<< AU
gas que se adsorbe
2
..
El rea del adsorbente es constante y es la misma para todos los adsorbatos
3. Se aplica la definicin de adsorcin de Gibbs, que corresponde a la tcnica
volumtrica para obtener isotermas de adsorcin experimental.
Ecuaciones termodinmicas para la fase adsorbida:
Sircar & Myers (24) en 1973 demostraron la siguiente ecuacin para una mezcla:
(5 15)
= =
= +
N
j
N
j
j
j
j
z
j j
j
j g
n
x
n
x e f
f
x T R
j
1 1
0 ]
1
[ ) ln( |
o
1
,
i
n
i i
C K C
=
Modelo de Freundlich (25)
Donde;
C
,i
--cantidad de sustancia adsorbida por unidad de peso de
carbn ( mgg)
K
i
-----constante para el componente dado
1 n
i
----pendiente de la lnea de equilibrio para el componente dado,
generalmente n > 1 y mientras ms grande el valor, mayor no
linealidad.
Muy usada en la adsorcin de compuestos
orgnicos a aprtir de corrientes acuosas sobre
carbn activado.
Modelo de Langmuir (16,46)
P T b
P T b
C C
s
) ( 1
) (
+
=
) exp( ) (
T R
Q
b T b
g
=
1
i
i
i
QKC
q
KC
=
+
Donde:
q
i
= Captacin de equilibrio por el
adsorbente, g (solutog slido.
Q= Peso del adsorbato para cobertura
monocapa completa, g soluto g slido.
C
A
= Concentracin del soluto en la fase
fluida en equilibrio con la conc. en la fase
adsorbida, mol cm
3
.
K----constante, cm
3
mol
P b
P b
C
P b
P b
C C
s s
21
2
2
1
1
1
1 1 +
+
+
=
Modelo de Langmuir (46)
donde;
n : nmero de moles por masa unitaria de adsorbente
n
j
: nmero de moles de j puro por masa unitaria del adsorbente en el
mismo estado de referencia
f
j
: fugacidad de j puro en el estado de referencia
| : potencial superficial, Joule
z
j
: distribucin de presin reducida
El potencial superficial | se calcula de la siguiente ecuacin:
(5-16)
Para componentes puros, el potencial superficial se calcula como
(5-17)
Para la solucin de la Ec. 5-15, se tiene que:
(5-18)
Si se alcanza el equilibrio de fases, y se considera comportamiento ideal para
la fase gaseosa (
j
= 1), entonces:
=
=
N
1 j
j j
) dln(Py x d
nRT
1
-
}
=
0
0
0
0
ln
i
P
o
i i
i
P d n
RT
|
g
j
s
j
f f =
j j j j
x z f f ) exp(
0
=
( 5-19)
por tanto el siguiente trmino, en la Ec. (5-15)
(5-20)
obtenindose
(5-21)
(5-22)
En el equilibrio:
f
j
fase adsorbida
= f
j
fase gas
(5-23)
y cuando la presin es baja, entonces
f
j
= P y
j
(5-24)
1
) exp(
0
=
j j j
j
z f
f
=
n
j
j
j
n
x
n
1
1
T R n
Z
g j
j
j
o
o
| |
=
Combinando las Ec 5-19 y 5-24:
(5-25)
Las Ec. (5-21) y (5-25) definen la teora de la solucin adsorbida ideal.
El estado estndar, Myers & Prausnitz (19), establecen:
(5-26)
donde
| : es el potencial superficial de la fase adsorbida
|
j
0
: es el potencial superficial del componente j puro en el estado de
referencia.
P
j
o
: presin hipottica del componente puro que da la misma diferencia de
tensiones interfaciales (t) como aquella de la mezcla.
Para cualquier componente j, Z
j
=0, en la Ec. 5-22
La presin de saturacin P
j
o
, puede calcularse segn la siguiente ecuacin
) exp(
j j j j
z x P Py
=
}
= =
o
j
P
o
j
o
j
o
j
g
o
j
g
dP
P
n
T R T R
0
|
|
(5-27)
y semejante a la Ley de Raoult en el equilibrio L-V, debe satisfacerse
(5-28)
(5-29)
En la (TSAI), la ecuacin de las isotermas de adsorcin para los
componentes puros pueden ser tomadas de aquellas que mejor ajusten
los datos experimentales. Esta teora es termodinmicamente consistente
y exacta en el lmite de presin cero ( 46 ).
Para la adsorcin en fase lquida, p
i
, se sustituye por c
i
en la fase lquida;
mientras que la presin total P, es reemplazado por la concentracin total
en la fase lquida, C.
Reescribiendo La Ec de la (IAS) en trminos para la fase lquida y fase adsorbida
j j j
x P Py
=
=
N
j
j
y
1
1
=
=
N
j
j
x
1
1
(5-30)
el potencial superficial de la fase adsorbida |
(5-31
donde
n
j
0
:es el nmero de moles de j puro por masa unitaria.
|
j
0
:es el potencial superficial del componente j puro en el estado de referencia.
| :es el potencial superficial de la fase adsorbida
La ley de Raoult anloga, para un sistema de adsorcin ideal es:
(5-32)
De esta ecuacin se puede despejar x
j
C
j
0
es la presin hipottica del componente puro que da la misma diferencia
de tensiones interfaciales (t) sobre la superficie, como aquella de la mezcla. A
esta diferencia se le denomina spreading pressure y es el negativo del
potencial superficial, por lo que la Ec (5-31) se convierte en
=
=
N
j
j
j
n
x
n
1
0
1
}
= =
0
0
0
0
0 0 0
) (
j
C
j
j
j j j
g
dC
C
C n
RT T R
|
|
) (
0
t
j j j j
C x c Cy = =
} } }
= = = =
0
2
0 0
1
0 0
2
2
0
1
1
...
C C
N
N
C
N
dC
C
C
dC
C
C
dC
C
C
RT
A
Z
t
(5-34)
donde
C
j
:
es la concentracin del componente j en la fase adsorbida.
z : es denominada diferencia de tensiones interfaciales reducidas
A : es el rea superficial del adsorbente
La sumatoria de las fracciones molares en la fase adsorbida se expresa
(5-35)
(5-36)
La Ec. (5-36) debe resolverse iterativamente para z, el valor de inicio del
clculo z
0
depende del modelo que mejor ajuste los datos de equilibrio de
los componentes puros de la mezcla. Para el caso que sea Langmuir el que
mejor ajuste los datos se puede tomar el promedio molar de z de acuerdo a la
Ec.(5-37):
=
=
N
j
j
x
1
1
= =
= = =
N
j
N
j
j
j
j
z C
Cy
x z F
1 1
0
0 1
) (
1 ) (
}
=
=
C
j
j
j
N
j
j
dC
C
C
y z
0
1
0
(5-37)
(5-38)
Integrando y reempezando lmites se obtiene:
(5-39)
donde C es la concentracin total en la fase lquida.
Cuando el modelo es diferente al de Langmuir y para un solo componente, la Ec. (5-
39):
(5-40)
Despejando C
j
o,
se tiene: (5-41)
}
= (
(
+
=
N
j
C
j
j j
j
j s j
dC
C b
b
C y z
1
0
, 0
1
=
+ =
N
j
j s j
bC C y z
1
, 0
) 1 ln(
) 1 ln(
0
, 0 j j j s
C b C z z + = =
j
j s
j
b
C z
C
1 ) / ( exp
, 0
Es obvio que si el modelo de ajuste es diferente a Langmuir no podemos obtener el
valor de C
j
0
. Para obtener este valor como una funcin de z, Myers y Valenzuela
comentado por Douglas (10) sugirieron calcularlo iterativamente expresando la Ec. (5-
37) mediante.
(5-42)
Conociendo la fraccin mol en la fase adsorbida (x
j
) y la concentracin hipottica de los
componentes puros que da la misma t como aquella de la mezcla, la cantidad total
adsorbida puede calcularse con la Ec.(5-30), que expresada en trminos de
concentracin sera
(5-43)
ahora se puede calcular la cantidad contribuida por el componente j, mediante la
siguiente ecuacin
(5-44)
}
= =
0
0
0
0 ) (
j
C
j
j
j
j
z dC
C
C
C G
=
=
N
j j
j
T
C
x
C
1
0
1
j T j
x C C
=
TABLAS : 5-2-5-11
Fig. (5-7) DATOS EXPERIMENTALES PARA LAS ISOTERMAS DE
ACETONA A 298K
(23)
0.00
0.20
0.40
0.60
0.80
1.00
1.20
0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00 45.00
CONCENTRACION DEL SOLUTO EN LA FASE LIQUIDA (mmol / l)
C
O
N
C
E
N
T
R
A
C
I
O
N
D
E
L
S
O
L
U
T
O
E
N
L
A
F
A
S
E
A
D
S
O
R
B
I
D
A
(
m
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Mejor Freundlich y
Langmuir
0 5 10 15 20 25 30 35 40 45
-4
-2
0
2
4
6
8
10
x 10
-3
X, Concentracin en la fase lquida (mmol/l)
(y-yc)
Fig.(5-.8) DISTRIBUCION DE RESIDUALES PARA LA ACETONA
Modelo Dual Langmuir
0.00
0.50
1.00
1.50
2.00
2.50
3.00
3.50
4.00
4.50
0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50
CONCENTRACION EN LA FASE LIQUIDA (mmol / l)
C
O
N
C
E
N
T
R
A
C
I
O
N
E
N
L
A
F
A
S
E
A
D
S
O
R
B
I
D
A
(
m
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Fig. (5-9) DATOS EXPERIMENTALES PARA LAS ISOTERMAS DE ACIDO
BENZOICO A 298K
(48)
Langmuir no ajusta los datos
0 0.5 1 1.5 2 2.5 3 3.5
-0.1
-0.08
-0.06
-0.04
-0.02
0
0.02
0.04
0.06
0.08
0.1
Fig. (5-10) DISTRIBUCIN DE RESIDUALES PARA ACIDO BENZOICO
X, Concentracin en fase lquida (mmol / l)
Modelo Dual Langmuir
Distribucin aleatoria de residuales, en
este caso para Dual Langmuir
0.00
0.50
1.00
1.50
2.00
2.50
3.00
3.50
0.00 1.00 2.00 3.00 4.00
CONCENTRACION EN LA FASE LIQUIDA (mmol / l)
C
O
N
C
E
N
T
R
A
C
I
O
N
E
N
L
A
F
A
S
E
S
O
L
I
D
A
(
m
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Fig. (5-11) DATOS EXPERIMENTALES PARA LAS
ISOTERMAS DE ACIDO FENIL ACETICO A 293K
(48)
0
0.5 1 1.5 2 2.5 3 3.5 4 4.5
-0.06
-0.04
-0.02
0
0.02
0.04
0.06
FIG. (5 -12) DISTRIBUCIN DE RESIDUALES PARA EL ACIDO FENIL ACTICO
X, Concentracin en la fase lquida (mmol / l)
Modelo Dual Langmuir
y - yc
El clculo slo se presenta distribucin
aleatoria para este modelo
0.00
0.50
1.00
1.50
2.00
2.50
3.00
3.50
4.00
4.50
0.05 0.25 0.45 0.65 0.85 1.05 1.25
CONCENTRACION EN LA FASE LIQUIDA ( mmol / l)
C
O
N
C
E
N
T
R
A
C
I
O
N
E
N
L
A
F
A
S
E
A
D
S
O
R
B
I
D
A
(
m
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Fig. (5-13) DATOS EXPERIMENTALES PARA LAS ISOTERMAS DE
2, 4 DICLOROFENOL 293K
(48)
Mejor ajustan Freundlich y
Dual Langmuir
0
0.2 0.4 0.6 0.8 1 1.2 1.4
-0.1
-0.05
0
0.05
0.1
0.15
FIG. (5-14) DISTRIBUCIN DE RESIDUALES PARA 2,4 DICLOROFENOL
X, Concentracin en la fase lquida (mmol / l)
Modelo de Langmuir
y-yc
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
1.60
1.80
2.00
0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00
CONCENTRACION EN LA FASDE LIQUIDA (mmol / l)
C
O
N
C
N
E
T
R
A
C
I
O
N
E
N
L
A
F
A
S
E
A
D
S
O
R
B
I
D
A
(
m
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Fig. (5 -15) DATOS EXPERIMENTALES PARA LAS ISOTERMAS
DEL ACIDO DODECIL BENCENSULFONICO A 293K
(48)
Mejor ajustan Freundlich y
Dual Langmuir
0 1 2 3 4 5 6 7 8
-0.8
-0.6
-0.4
-0.2
0
0.2
0.4
0.6
0.8
X, CONCENTRACIN EN LA FASE LQUIDA (mmol / l)
Fig. (5 -16) DISTRIBUCIN DE RESIDUALES PARA ACIDO DODECIL BENCEN SULFNICO
Modelo de Langmuir
y-yc
0.00
0.50
1.00
1.50
2.00
2.50
3.00
3.50
4.00
0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00
CONCENTRACION EN LA FASE LIQUIDA (mmol / l)
C
O
N
C
E
N
T
R
A
C
I
O
N
E
N
L
A
F
A
S
E
A
D
S
O
R
B
I
D
A
(
m
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Fig. (5-17) DATOS EXPERIMENTALES PARA LAS ISOTERMAS DE FENOL
A 293K
(48)
Freundlich y Dual Langmuir
ajustan mejor los datos
0 1 2 3 4 5 6 7
-0.1
-0.08
-0.06
-0.04
-0.02
0
0.02
0.04
0.06
0.08
X, CONCENTRACIN EN FASE LIQUIDA ( mmol / l)
Fig. (5 -18) DISTRIBUCIN DE RESIDUALES PARA FENOL
Modelo Dual Langmuir
Slo Dual Langmuir presenta distribucin aleatoria de
residuales
FIG.(5-19) DATOS EXPERIMENTALES PARA LAS ISOTERMAS DE
p-CLOROFENOL A 293K
(23)
0.00
0.50
1.00
1.50
2.00
2.50
3.00
3.50
4.00
4.50
5.00
0.04 0.54 1.04 1.54 2.04 2.54 3.04
CONCENTRACION DEL SOLUTO EN LA FASE LIQUIDA (mmol/l)
C
O
N
C
E
N
T
R
A
C
I
O
N
D
E
L
S
O
L
U
T
O
E
N
L
A
F
A
S
E
A
D
S
O
R
B
I
D
A
(
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Freundlich y dual Langmuir ajustan mejor
los datos
0 0.5 1 1.5 2 2.5 3
-0.08
-0.06
-0.04
-0.02
0
0.02
0.04
0.06
0.08
x,Concentracin en fase lquida (mmol / l)
(y-yc)
Fig.(5-20 ) DISTRIBUCION DE RESIDUALES DEL p- CLOROFENOL
Modelo de Dual Langmuir
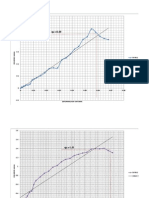
0.97
0.98
0.99
1.00
1.01
1.02
1.03
1.04
1.05
0.040 0.045 0.050 0.055 0.060
CONCENTRACION EN LA FASE LIQUIDA (mmol / l)
C
O
N
C
E
N
T
R
A
C
I
O
N
E
N
L
A
F
A
S
E
A
D
S
O
R
B
I
D
A
(
m
m
o
l
/
g
)
DATOS EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Fig. (5-21) DATOS EXPERIMENTALES PARA LAS ISOTERMAS DE
p-CRESOL A 298K
(23)
Freundlich y Langmuir ajustan
mejor los datos
0.042 0.044 0.046 0.048 0.05 0.052 0.054 0.06
-4
-3
-2
-1
0
1
2
3
4
5
10
-3
X, Concentracin en la fase lquida (mmol / l)
(y-yc)
Fig. (5-22) DISTRIBUCION DE RESIDUALES DEL p-CRESOL
Modelo de Langmuir
Distribucin aleatoria de residuales
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00
CONCENTRACION EN LA FASE LIQUIDA (mmol / l)
C
O
N
C
E
N
T
R
A
C
I
O
N
E
N
L
A
F
A
S
E
A
D
S
O
R
B
I
D
A
(
m
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
Fig. (5-23) DATOS EXPERIMENTALES PARA LAS ISOTERMAS DE
PROPIONITRILO A 298K
(23)
Langmuir se desva de de la
tendencia de los datos
0 5 10 15 20 25 30 35
-4
-2
0
2
4
6
8
10
x 10
-3
x, Concentracin en fase lquida (mmol / l)
(y-yc)
Fig. (5 -24) DISTRIBUCION DE RESIDUALES DEL PROPIONITRILO
Modelo Dual Langmuir
Slo este modelo presenta distribucin aleatoria de
residuales
Fig. ( 5-25): DATOS EXPERIMENTALES Y PREDICCIONES PARA LAS ISOTERMAS DEL
p-NITROFENOL, 293K
(48)
0.00
0.50
1.00
1.50
2.00
2.50
3.00
3.50
4.00
4.50
0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 4.50 5.00
CONCENTRACION EN LA FASE LIQUIDA (mmol / l)
C
O
N
C
E
N
T
R
A
C
I
O
N
E
N
L
A
F
A
S
E
S
O
L
I
D
A
(
m
m
o
l
/
g
)
EXPERIMENTALES
FREUNDLICH
LANGMUIR
DUALLANGMUIR
El mejor ajuste lo hacen Dual
Langmuir, seguido por Freundlich
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5
-0.14
-0.12
-0.1
-0.08
-0.06
-0.04
-0.02
0
0.02
0.04
0.06
X, Concentracin en fase lquida ( mmol / l)
Fig. (5 -26) DISTRIBUCIN DE RESIDUALES DEL p- NITROFENOL
Modelo de Freundlich
y -y
c
No aleatoriedad de los datos
1. 05 1. 1 1. 15 1. 2 1. 25 1. 3
39. 975
39. 98
39. 985
39. 99
39. 995
40
40. 005
40. 01
40. 015
40. 02
40. 025
Cus (m m ol / g)
b
(
L
/
m
m
o
l
)
Fig.(5-23) Hiper elipsoide de
confianza de los parmetros de
Freundlich para el Acido Dodecil
Bencen Sulfnico
Para un modelo correcto, esta
regin debe ser muy pequea,
grandes regiones indican error
aleatorio en la data (AIChE J
(Vol24, N1, pg.27, 1978.
Tabla 5-14, pg. 137
0.20
0.25
0.30
0.35
0.40
0.45
0.50
0.55
0.60
0.65
0.70
0.10 0.15 0.20 0.25 0.30 0.35 0.40 0.45 0.50
x (Fraccin mol en la fase liquida)
y
(
F
r
a
c
c
i
n
m
o
l
e
n
f
a
s
e
a
d
s
o
r
b
i
d
a
)
EXPERIMENTALES
LANGMUIR
Fig ( 5- IAS1) : Resultados y su Desviacin del Clculo del Equilibrio de Adsorcin
para el sistema p- nitrofenol (1 ) -p-clorofenol (2) - Agua, T = 293 K;
[48]
RESULTADOS - TEORIA IAS
RESULTADOS - TEORIA - IAS
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4
x (Fraccin mol en la fase lquida )
y
(
F
r
a
c
c
i
n
m
o
l
e
n
l
a
f
a
s
e
a
d
s
o
r
b
i
d
a
)
EXPERIMENTALES
LANGMUIR
Fig. ( 5-IAS3) : Resultados y su Desviacin del Clculo del Equilibrio de Adsorcin para el sistema
2,4 Diclorof enol (1 ) - Acido Dodecil Bencen Sulf nico (2) - Agua, T = 293 K;
[48]
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5
x (Fraccin mol en la fase lquida )
y
(
F
r
a
c
c
i
n
m
o
l
e
n
l
a
f
a
s
e
a
d
s
o
r
b
i
d
a
)
EXPERIMENTALES
LANGMUIR
Fig ( 5-IAS2) : Resultados y su Desviacin del Clculo del Equilibrio de Adsorcin
para el sistema p-nitrofenol (1 ) - Acido benzoico (2) - Agua, T = 293 K;
[48]
RESULTADOS - TEORIA - IAS
CURVAS DE RUPTURA
ADSORCION EN CAMA FIJA
ALIMENTACION
SALIDA
Entrada de la Fase Fluida
Concentracin Soluto, Co
Z
Salida de la Fase Fluida
Concentracin del Soluto, Ci(z,t)
COLUMNA
MODELO
L
Co
0
0
Volumen del efluente
Ca Cb Cc
Cd
Cc Cb Ca
Punto de Quiebre
Co Co Co Co
CURVA DE RUPTURA
FORMULACION DEL
MODELO
a. Balance de materia.
Para la seccin diferencial Az, que se representa en la Fig.5-4; un
balance general para el soluto i; considerando:
1.Que la concentracin de cada componente en la fase lquida varia con
la posicin y con el tiempo C
i
(Z,t).
2.Que existe dispersin axial, lo cual resta eficiencia a la separacin por
adsorcin.
3.Que no existen gradientes de concentracin radiales
4.Que existe concentracin diluida de adsorbatos, para eliminar la
necesidad de un balance de energa.
5.Pequea cada de presin en el lecho
6.Partculas aproximadamente esfricas
AZ
z
i
i i
C
D C )
Z
u (
z
c
c
c
z z
i
i i
C
D C
A +
)
Z
u (
z
c
c
c
Elemento diferencial de la columna de adsorcin:
Por la ecuacin de continuidad, considerando acumulacin , el trmino de
dispersin axial, fraccin hueca del lecho empacado y tomando lmites, se obtiene
la ec. (5-48)
(5-48)
Si el flujo es uniforme (flujo en tapn y el efecto de la dispersin axial es
insignificante, las ecuaciones para cada adsorbato pueden escribirse
(5-49)
Hougen y Marshall 1947; comentado por Maddox (51), para contenidos pequeos
de lecho, se puede despreciar el primer trmino del segundo miembro.
Z
C
V -
Z
C
D
= )
r
3
)(
t
C
)(
- 1
( +
t
C
di
2
di
2
i
0
s i, di
c
c
c
c
c
c
c
c
c
c
z
is
z
i
t
i z
t
C
t
C
Z
C u
1
1 c
c
c
c
c
c
+
|
.
|
\
|
e
e
=
|
.
|
\
|
e
e
z
is
t
i z
t
C
Z
C u
1 c
c
c
c
=
|
.
|
\
|
e
e
(5-50)
Introduciendo una definicin para la densidad del slido
s
y de las variables
adimensionales q
i
Z, u, X
i
, Y
i
, q
io
, se llega a la Ec. (5-58).
(5-58)
Se sabe que el coeficiente de transferncia demasa es funcin de la densidad del
fluido, viscosidad del fluido, difusividad, velocidad superficial y dimetro de la
partcula (Ref. 45).
Se ha tomado el coeficiente que expresa la velocidad de adsorcin para cada especie
como:
(5-59)
Adimensionalizando la Ec. (5-59) obtenemos la Ec. (5-65)
(5-65)
Si usamos el modelo de tipo Langmuir, entonces podemos usar la Ec. 5-69
( )
0
1
Z
=
|
.
|
\
|
e
e
+
|
.
|
\
|
u c
c
c
c
i i s i
y a X
( )
( )
si i
s
li i
C C
K
t
q
e
=
1
c
c
( )
si i
L
i
i
X X
y
=,
u c
c
(5-69)
Adimensionalizando las Ec. (5-58) y (5-65) se obtienen las Ec. (5-70) y (5-71).
(5-70)
(5-71)
b.3. Fase lquida controlante
La parte ms grande de los gradientes est en las capas exteriores de la partcula.
Clculos detallados muestran que la resistencia puede a ser aproximada por una
pelcula de difusin con un espesor de aprox. d/10 de la partcula (Wesseling, J.A., R
Krishna Mass Transfer, Ellis Horwood, England 1990, pg. 138).
...la concentracin del soluto en el solvente es a menudo de rdenes de magnitud
ms baja que en el sorbente, de modo que la resistencia en el solvente puede ser
importante.
0
Z
= +
u c
c
c
c
i
i
i
y
a
x
( ) ( )
i si
s
i si i
l
i
i
y y x x
y
= =
u c
c
=
+
=
N
j
sj j
si i
si
C b
C a
q
1
1
Si la difusin externa es considerada controlante de la velocidad, la concentracin
promedio en la fase adsorbida y
i,
puede relacionarse mediante la isoterma de adsorcin,
Ec. (5-78).
(5-78)
definiendo una relacin P
l
mediante la Ec. (5-79)
(5-79)
Reemplazando los valores de x
sj
de la Ec. (5-79) por P
l
y
j
, se obtiene
(5-82)
entonces x
si
, puede calcularse en funcin de la composicin en la fase adsorbida
=
=
+
|
|
.
|
\
|
+
=
N
j
sj j j
si
N
j
j j
si
x c b
x c b
y
1
0
1
0
1
1
|
|
.
|
\
|
+
|
|
.
|
\
|
+
= =
=
=
N
j
j j
sj
N
j
j j
i
si
l
c b
x c b
y
x
P
1
0
1
0
1
1
( )
=
+
=
N
j
j j j
l
y c b
P
1
0
1 1
1
(5-83
Por lo que las ecuaciones para la adsorcin en fase lquida controlante pueden
escribirse:
(5-85)
(5-86)
donde :
(5-87)*
( )
=
+
= =
N
j
j j j
i
i l si
y c b
y
y P x
1
0
1 1
0
a
i
= +
u c
c
c
c
c
i i
y
Z
x
( )
(
(
(
(
+
=
=
N
j
j j j
i
i
l
i
i
y c b
y
x
y
1
0
1 1
u c
c
) 1 (
1
1
0
c
|
|
.
|
\
|
+
=
=
u a
c b Lk
i
N
j
j j li
l
i
Fig. (5-27) Relacin C
i
/C
oi
vs t para 2-Butanol (1) - Alc. Teramlico (2) - Fenol (3), L=0.42m, Q=1.8E-
5 m
3
/s, K
f1
=1.2E-4, K
f2
= 2.12E-5, K
f3
=4.17E-5 m/s, (r
b
)=606.3Kg/m
3
, e=0.278, d
b
=0.05m, Vs.=33.002m/h,
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
Exp.2-Butanol
Exp. Alc. Teramlico
Exp. Fenol
C
01
=100ppm C
02
=200ppm C
03
=900ppm
dp=0 .05cm
1
2
3
La prediccin para el comp 2, reproduce
aprox. el punto de ruptura. La cama est
saturada totlamente despus de 10 h para el
fenol
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
1.60
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
1 : 2-BUTANOL
2 : ALCOHOL TERAMILICO
3: FENOL
C
01
=100ppm
Fig. (5-28) Efecto de la disminucin del caudal sobre C
i
/C
oi
vs t para 2-Butanol (1), Alc. Teramlico (2),
Fenol (3), L=0.41m,Q=1.5E-5m
3
/s, K
f1
=1.2E-4, K
f2
= 2.12E-5, K
f3
=4.17E-5m/s, (
b
)=606.3Kg/m
3
, c =0.278,
V
s
.=33.002m/h, L=0.42m.
C
02
=200ppm C
03 =
900ppm
dp = 0.05 cm
Q = 1,15 E-5 m
3
/ s
2
1
3
Se incrementa el tiempo de saturacin de la cama para los tres
solutos, lo que implica que se aumenta la capacidad de
adsorcin
Fig. (5-29). Efecto del aumento del dimetro de la columna sobre C
i
/ C
oi
vs t para 2-Butanol (1) -
Alc. Teramlico (2) - Fenol (3), L=0.41m, Q=1.8E-5 m
3
/s, K
f1
=1.2E-4, K
f2
=2.12E-5, K
f3
=4.17E-5 m/s,
b
=236.8 kg/m
3
, c =0.718, d
b
=0.08m, V
s
=12.892 m/h.
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
2-BUTANOL
ALCOHOL
TERAMILICO
FENOL
C
01
=100ppm
C
02
=200ppm
C
03
=900ppm
d
p
=0 .05cm
1
2
3
Disminuye ligeramente el tiempo de ruptura
para el componente (1). Implica que el
tiempo de contacto de la solucin con el
adsorbente dismunuye
Fig. (5-30 ):Efecto del aumento de los CTM sobre C
i
/ C
oi
para el sistema 2-Butanol (1) - Alc. Teram
lico (2) - Fenol (3), L=0.41m, Q=1.8E-5m
3
/s, (
b
)=606.3Kg/m
3
, c =0.278, d
b
=0.05m, V
s
=33.002m / h.
0
0.2
0.4
0.6
0.8
1
1.2
1.4
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
Exp. 2 - Butanol
Exp. Alc. teramlico
Exp. Fenol
C
01
=100ppm C
02
=200ppm C
03
=900ppm
K
f1
= 1.56E-4 m/s
K
f2
= 2.76E-3 m/s
K
f3
= 5.42E-3 m/s,
1
2
3
El tiempo de ruptura disminuye muy
ligeramente, esto implica que aumenta la
velocidad de TM.
Fig.(5-31): Efecto del tipo de adsorbente sobre C
i
/ C
oi
para 2-Butanol (1)-Alc. Teramlico-Fenol (3),
L=0.41m, Q=1.8E-5m
3
/s, K
f1
=1.2E-4, K
f2
=2.12E-5, K
f3
=4.17E-5 m/s, (
b
)=606.3 kg/m
3
, c =0.067, d
b
=0.05m,
V
s
=33.002m/h.
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
1.60
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
2-BUTANOL
ALCOHOL TERAMILICO
FENOL
C
01
=100ppm C
02
=200ppm C
03
=900ppm
1
2
3
Se afecta ms la poca afinidad del
componente 1 y la zona de TM
aumenta para los comp. (2) y (3)
Fig.(5-32): Efecto de la altura de la columna sobre C
i
/ C
oi
vs t para 2-Butanol - Alc. Teramlico (2)-
Fenol(3), Q=1.8E-5m
3
/s,
b
=262.7Kg/m
3
, c =0.531,V
s
.=33.002m/h, d
B
=0.05 m
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
1.60
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
2-BUTANOL
ALCOHOL TERAMILICO
FENOL
L = 0.82 m
m =0.650 Kg carbn
1
2 3
El 2-butanol se adsorbe ms
rpidamente. La solucin entra en
contacto con adsorbente menos
saturado en su reccorido
Fig.(5-33): Efecto de la altura de la columna sobre C
i
/ C
oi
vs t para 2-Butanol - Alc. Teramlico (2)-
Fenol(3), Q=1.8E-5m
3
/s,
b
=262.7Kg/m
3
, c =0.531,V
s
.=33.002m/h, d
B
=0.05 m
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
1.60
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
2-BUTANOL
ALCOHOL TERAMILICO
FENOL
L = 0.82 m
m =0.650 Kg carbn
1
2 3
Fig. (5-34) Efecto del aumento de la concentracin inicial del butanol sobre C
i
/C
oi
vs t para 2-
Butanol (1) - Alc. Teramlico (2) - Fenol (3),L=0.41m,Q=1.8E-5 m
3
/s,K
f1
=1.2E-4,K
f2
= 2.12E-5, K
f3
=4.17E-3
m/s, (
b
)=606.3 Kg/m
3
, c =0.278,V
s
.=33.002m/h,
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
2-BUTANOL
ALCOHOL TERAMILICO
FENOL
C
01
=150ppm
C
02
=200ppm C
03
=900ppm d
p
= 0.05 cm
1 2
3
No se producen cambios en las concentrac.
Implica que este soluto no tiene capacidad de
competencia frente a los otros solutos
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
0 2 4 6 8 10 12 14 t (h)
C
i
/
C
o
i
2-BUTANOL
ALCOHOL TERAMILICO
FENOL
C
03
=900ppm C
01
=100ppm C
02
=700ppm
Fig. (5-35) Efecto del aumento de la concentracin inicial del alcohol teramlico sobre C
i
/C
oi
vs t para 2-
Butanol (1), Alc. Teramlico (2), Fenol (3),L=0.41m,Q=1.8E-5m
3
/s,K
f1
=1.2E-4,K
f2
= 2.12E-5, K
f3
=4.17E-5m/s
(
b
)=606.3Kg/m
3
, c =0.278, V
s
.=33.002m/h
dp=0.05 cm
1
2 3
Se reduce el tiempo de ruptura para los
tres componentes. Implica que se reduce
la capacidad de adsorcin de la columna,
debido a que este componente tiene
afinidad intermedia por los sites de
adsorcin
Fig. (5-36) Efecto de la disminucin de las concentraciones sobre C
i
/C
o
i vs t para 2-Butanol (1) - Alc.
Teramlico (2)- Fenol (3), L=0.41m,Q=1.8E-5m
3
/s ,K
f1
=1.2E-4,K
f2
= 2.12E-5, K
f3
=4.17E-5 m/s (
b
)=606.3
Kg/m
3
,c =0.278,V
s
.=33.002m/h.
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00
t (h)
C
i
/
C
o
i
2-BUTANOL
ALCOHOL TERAMILICO
FENOL
C
01
=100ppm
C
02
=100ppm C
03
=100ppm
d
p
= 0.05 cm
1
2
3
La columna puede seguir
operando durante ms tiempo,
antes que , antes que ocurra la
saturacin del lecho
Fig. (5-37): Efecto del aumento del dimetro de la partcula sobre C
i
/ C
oi
para 2-Butanol (1) - Alc.
Teramlico (2) - Fenol (3), L =0,41 m, Q=1.8E-5 m
3
/s, K
f1
=1.2E-4, K
f2
= 2.12E-5, K
f3
=4.17E-5 m/s,
(
b
)=606.3Kg/m
3
, c =0.278, d
b
=0.05m, V
s
.=33.002m/h,
0.00
0.20
0.40
0.60
0.80
1.00
1.20
1.40
0 2 4 6 8 10 12 14
t (h)
C
i
/
C
o
i
2-BUTANOL
ALCOHOL TERAMILICO
FENOL
d
p
=0 .08cm C
01
=100ppm
C
02
=200ppm
C
03
=900ppm
1
2
3
El tiempo de ruptura disminuye debido
a que la solucin posiblemente no
logre entrar completamente en
contacto con la superficie de adsorcin
6. CONCLUSIONES
6.1 Para el caso de un soluto el modelo de Dual
Langmuir ajusta con mayor precisin los datos, luego
sigue el modelo de Freundlich y finalmente el modelo
de Langmuir; siendo la relacin de sistemas
ajustados 6/3/1, respectivamente.
6.2 La simulacin del proceso usando la teora de la
solucin adsorbida ideal (TSAI) a sistemas multisoluto
muestra lo siguiente:
1. Para los solutos acetona (1) - propionitrilo (2) la
desviacin estndar fue 1.8% y para el sistema p-
Cresol (1) - p-Clorofenol (2) a 298K fue 5.13 %.
En ambos casos, las predicciones son inferiores
a las estimadas por Radke & Prausnitz (23),
empleando modelos empricos de 3 parmetros y
la TSAI.
2. Para los sistemas p-nitrofenol (1)-p-clorofenol(2)-
agua(3) y p-nitrofenol(1)-cido benzoico(2)-agua(3), la
desviacin estndar fue menor para el primer
sistema.
3. Para los sistemas p-clorofenol(1)-cido fenil
actico(2)-agua,p-nitrofeno(1)-fenol(2)-agua y 2,4-
Diclorofenol(1)-cido dodecil bencen sulfnico(2)-
agua, las desviaciones son inferiores a la de las
curvas experimentales, conforme se puede observar
en la Fig.6-IAS3.
A partir de estas evidencias podemos concluir que el
modelo de la TSAI es apropiado para el tratamiento
de datos correspondientes a estos sistemas.
6.3 La simulacin dinmica de la adsorcin del 2-butanol (1)
- alcohol t-amlico (2) - fenol (3) en solucin acuosa
diluida sobre carbn activado, muestra que:
a. Las predicciones del perfil de concentraciones
adimensionales con respecto al tiempo guarda
consistencia con los datos experimentales, con
cuadrados de diferencias no mayor del 0.5 % para el 2-
butanol (1), de 10% para el alcohol t-amlico (2) y de 4%
para el fenol (3).
b. El tiempo de ruptura de los lechos es funcin de los
caudales manejados as como del tipo de carbn
utilizado, toda vez que el coeficiente de transferencia de
masa depende de las condiciones de operacin, el
tamao de poro y de las afinidades intrnsecas entre el
adsorbato y el adsorbente.
c. El incremento del tiempo de ruptura al igualar las
concentraciones iniciales de ingreso a la columna implica
que la columna de adsorcin operar por ms tiempo
antes de saturarse; puesto que disminuye la competencia
por los sitios de adsorcin de los componentes que tienen
mayor afinidad de adsorcin.
d. La invariabilidad observada de la relacin de con
centraciones al aumentar la concentracin inicial del 2-
butanol (1), se debe a que este adsorbato tiene la menor
afinidad del grupo por el adsorbente
Para todos los sistemas, las predicciones mediante los
algoritmos de Vanier y de AdDesign coinciden en reproducir el
tiempo de ruptura; esto permite afirmar que el software
desarrollado en el presente trabajo, logra una adecuada
prediccin del comportamiento dinmico de la adsorcin de
soluciones acuosas diluidas sobre carbn activado.
7. RECOMENDACIONES
1. Se recomienda extender las aplicaciones del modelo de Dual
Langmuir a otros sistemas en adsorcin slido-lquido para
tener una mejor apreciacin sobre su confiabidad, as como
realizar estudios de simulacin para el caso de soluciones
no diluidas y para el caso de mezclas liquidas no acuosas.
2. Queda para futuros trabajos la posibilidad de optimizar
parmetros para otros modelos de equilibrio, considerando
otros tipos de adsorbente, como: arcillas activadas o arcillas
pilareadas de gran aplicacin en catlisis ambiental.
3. Implementar columnas a nivel de laboratorio con el objeto de
determinar experimentalmente puntos de ruptura y tiempos
ptimos de operacin, en la remocin de agentes
contaminantes.
También podría gustarte
- Simulación del efecto de la presión en la síntesis y purificación de etilbencenoDocumento2 páginasSimulación del efecto de la presión en la síntesis y purificación de etilbencenoMis Classes FastclassesAún no hay calificaciones
- Efecto de Alternancia de Presión en El Equilibrio y Separación de Mezclas Azeotrópicas Tetrahidrofurano - AguaDocumento14 páginasEfecto de Alternancia de Presión en El Equilibrio y Separación de Mezclas Azeotrópicas Tetrahidrofurano - AguaMis Classes FastclassesAún no hay calificaciones
- # 3-MapaEquipoYDiagrasFlujoExtraccionDocumento5 páginas# 3-MapaEquipoYDiagrasFlujoExtraccionMis Classes FastclassesAún no hay calificaciones
- Artic 2011 Fin WLDocumento13 páginasArtic 2011 Fin WLMis Classes FastclassesAún no hay calificaciones
- Difus Molec 17 11 10Documento36 páginasDifus Molec 17 11 10Mis Classes FastclassesAún no hay calificaciones
- 1 FloculadorDocumento1 página1 FloculadorMis Classes FastclassesAún no hay calificaciones
- Adsorc-Lecho FijoDocumento20 páginasAdsorc-Lecho FijoMis Classes FastclassesAún no hay calificaciones
- Clase2 - de Excel 02-11-13-MatricDocumento10 páginasClase2 - de Excel 02-11-13-MatricMis Classes FastclassesAún no hay calificaciones
- La TesisDocumento32 páginasLa TesisMis Classes FastclassesAún no hay calificaciones
- Adsorcion Multicomp 2012Documento8 páginasAdsorcion Multicomp 2012Mis Classes FastclassesAún no hay calificaciones
- Presentación P5Documento19 páginasPresentación P5Ignacio Sánchez GutiérrezAún no hay calificaciones
- Unit Iv Kinetics FoundationsDocumento29 páginasUnit Iv Kinetics FoundationsHenry Lambis MirandaAún no hay calificaciones
- Generador de OlasDocumento7 páginasGenerador de OlasJOel Cordova TadeoAún no hay calificaciones
- CorrosiónDocumento3 páginasCorrosiónGABRIELA AGUILA ROJASAún no hay calificaciones
- Cinematica 1Documento24 páginasCinematica 1Rafael Pérez GarcíaAún no hay calificaciones
- Secado PapaDocumento13 páginasSecado PapaNohemy MamaniAún no hay calificaciones
- Tarea Grupal 12Documento3 páginasTarea Grupal 12Lucy FloresAún no hay calificaciones
- Turbin AsDocumento29 páginasTurbin AsJuan Jesús OrtízAún no hay calificaciones
- Informe 2 Propiedades de Los GasesDocumento10 páginasInforme 2 Propiedades de Los GasesH4vocAún no hay calificaciones
- Exercicis Variats CinemàticaDocumento2 páginasExercicis Variats CinemàticaXavier MerencioAún no hay calificaciones
- Practica Fisica Semana 14 Kerly Elizabeth Quispe BarturenDocumento6 páginasPractica Fisica Semana 14 Kerly Elizabeth Quispe BarturenKERLY ELIZABETH QUISPE BARTURENAún no hay calificaciones
- Intervalos de Mantenimiento Motor C9Documento4 páginasIntervalos de Mantenimiento Motor C9carvalle5Aún no hay calificaciones
- Pia de FisicoquimicaDocumento8 páginasPia de FisicoquimicaMelissa CortésAún no hay calificaciones
- MQ13 02 DR 3410 Me3001 Imco MC01 PDFDocumento9 páginasMQ13 02 DR 3410 Me3001 Imco MC01 PDFCarlos AndresAún no hay calificaciones
- HAUG WPS ASME Español 2008Documento2 páginasHAUG WPS ASME Español 2008VirgilioAún no hay calificaciones
- Movimientos uniformemente acelerado y uniforme: experimento y análisis de datosDocumento7 páginasMovimientos uniformemente acelerado y uniforme: experimento y análisis de datosAndrés Felipe BalocoAún no hay calificaciones
- PT - Planta Potabilizacion 0330 m3-s en Dos EtapasDocumento114 páginasPT - Planta Potabilizacion 0330 m3-s en Dos EtapasbarriopedroAún no hay calificaciones
- Free Tema 6 DINAMICA DE LAS CAPAS FLUIDASDocumento8 páginasFree Tema 6 DINAMICA DE LAS CAPAS FLUIDASbrooferAún no hay calificaciones
- D6C TRACTOR - POWERSHIFT - 10K00001-07952 (Máquina) (UE070095 - 00) - Documentación4Documento7 páginasD6C TRACTOR - POWERSHIFT - 10K00001-07952 (Máquina) (UE070095 - 00) - Documentación4jaidervaccaAún no hay calificaciones
- Proyecto de Investigacion Sobre El SolDocumento16 páginasProyecto de Investigacion Sobre El SolHuguito Anaya Estrada50% (4)
- SEMANA 3 - Cinemática de La Partícula en Movimiento Relativo en El Plano 2DDocumento64 páginasSEMANA 3 - Cinemática de La Partícula en Movimiento Relativo en El Plano 2DHilary Diaz ReyesAún no hay calificaciones
- Ciclo de CarnotDocumento10 páginasCiclo de CarnotWilmerChancasanampaGomezAún no hay calificaciones
- Grafica de Esfuerzo y Deformacion de Suelos - Xls 1Documento13 páginasGrafica de Esfuerzo y Deformacion de Suelos - Xls 1Alexllb IngenierosAún no hay calificaciones
- Cálculo de estructuras por el método de bielas y tirantesDocumento45 páginasCálculo de estructuras por el método de bielas y tirantesBenjamin ChacónAún no hay calificaciones
- Expo Upea Mod 3Documento8 páginasExpo Upea Mod 3DAVID BERNAL FRANCOAún no hay calificaciones
- Gutierrez Rodriguez Matias IgnacioDocumento1 páginaGutierrez Rodriguez Matias IgnaciocatalinaAún no hay calificaciones
- Cap. 1 Introducción-Estática (ING135) PUCPDocumento11 páginasCap. 1 Introducción-Estática (ING135) PUCPHéctor Peña Saavedra50% (2)
- Informe 1 Laboratorio de Aguas y LodosDocumento62 páginasInforme 1 Laboratorio de Aguas y LodosfelipeAún no hay calificaciones
- Efecto ThomsonDocumento2 páginasEfecto Thomsonkathe100% (1)