Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Equilibrio Quimico - Iónico
Cargado por
Gaby RodriguezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Equilibrio Quimico - Iónico
Cargado por
Gaby RodriguezCopyright:
Formatos disponibles
EQUILIBRIO QUMICO La tendencia de las sustancias a reaccionar, la direccin y magnitud del cambio qumico se reflejan en el valor de la constante de equilibrio.
Las reacciones qumicas, son reversibles en ciertas condiciones de presin y temperatura. Un sistema que ha alcanzado el equilibrio est en estado de equilibrio. Un sistema es dinmico, pues reacciona indefinidamente formando tanto reactivos como productos; es espontneo, pues evoluciona espontneamente hacia el equilibrio; es reversible, pues la naturaleza y las propiedades del estado de equilibrio son las mismas, independientemente de la direccin desde la que se alcanza; es de naturaleza termodinmica, pues las molculas tienden a asumir un estado de energa mnima y a su vez a evolucionar hacia un estado de desorden. Ley de accin de masa.- La velocidad de una reaccin qumica es directamente proporcional a la concentracin de las especies reactantes. Constantes de equilibrio.- el valor numrico de la constante de equilibrio de una reaccin es una expresin concisa de la tendencia de los reactivos a convertirse en productos. Factores que influyen en los equilibrios qumicos.- Los factores que pueden influir en el equilibrio son los cambios de concentracin, la presin, la temperatura y la adicin de un catalizador. Le Chatelier postula Que toda vez que un factor externo perturba el equilibrio de un sistema, este reacciona tratando de anular el efecto perturbador. Cociente de reaccin (Q). o Cuando Q < K. la reaccin va hacia la derecha o Cuando Q = K el sistema est en equilibrio o Cuando Q > K la reaccin va hacia la izquierda. Cambios de concentracin Aumento de concentracin de A o B Q<K izquierda a derecha Aumento de concentracin de C o D Q>K derecha a izquierda Disminucin de concentracin de A o B Q > K derecha a izquierda Disminucin de concentracin de C o DQ < K izquierda a derecha Influencia del cambio de presin. Influye en Kx Incremento de presin; < volumen Q>K derecha a izquierda Disminucin de presin; < volumen Q<K izquierda a derecha Influencia del cambio de temperatura. En un sistema endotrmico el calor se absorbe como si fuera un reactivo, el equilibrio se desliza hacia la derecha y Q < K. En un sistema exotrmico el calor se absorbe como producto, el equilibrio se desliza de izquierda a derecha y Q > K. Al enfriar un sistema endotrmico, se desplaza a la izquierda y Q > K. Al enfriar un sistema exotrmico, se desplaza a la derecha y Q < K. Efecto de un catalizador.- un catalizador es una sustancia que incrementa la velocidad de una reaccin, pero que no es consumida por la misma.
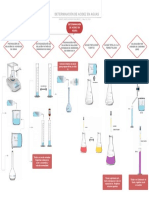
EQUILIBRIO INICO. cidos.- Tienen sabor cido; hacen cambiar el color de muchos indicadores; reaccionan con los metales que se encuentran por arriba del hidrgeno; reaccionan con xidos e hidrxidos metlicos para formar sales y agua y conducen la energa elctrica. Bases.- tienen sabor amargo; tienen sensacin resbalosa; hacen cambiar de color muchos indicadores; reaccionan con cidos para formar sales y agua y sus soluciones acuosas conducen la corriente elctrica porque estn ionizadas. Teora de Arrhenius.- los cidos se disociaban dando como resultado protones y un in negativo denominado radical cido; las bases siempre se disociaban siempre dando origen a iones (OH) junto con otro in metlico positivo. La reaccin entre cidos y bases da lugar a procesos de neutralizacin, en los que los iones se combinan entre s para formar molculas de agua. Teora de Brnsted Lowry.- los cidos son sustancias formadas por iones o molculas capaces de ceder protones, en su disociacin en vez de H se encuentra el in hidronio y las bases son sustancias que pueden aceptar protones. Existen sustancias que actan tanto como bases como cidos como el agua; estas se denominan anfiprticas o anfteras. Teora de Lewis. Un cido es un compuesto que puede aceptar un par de electrones en la formacin de un enlace covalente. Una base es un compuesto que puede ceder un par de electrones en la solucin de un enlace covalente. Fuerza relativa de cido y bases.- Ka, la constante de disociacin o acidez y Kb, la constante de basicidad son la expresin cuantitativa de un cido o una base respectivamente; permiten establecer una ordenacin de la fuerza relativa de los pares cido base. pH.- es una medida de la concentracin de iones de hidrgeno de una disolucin. cidos fuertes.- son electrolitos fuerte y reaccionan completamente; los ms comunes son HCl, HBr, HI, HNO3, HClO4 y H2SO4. Bases fuertes.- las ms comunes son LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Bases dbiles.- la ms comn es el amoniaco NH3; stas se disocian parcialmente. Efecto del in comn.- es un cambio en un equilibrio inico causado por la adicin de un soluto que proporciona un in que toma parte en el equilibrio. Soluciones amortiguadoras.- resisten un cambio en el pH despus de la adicin de pequeas cantidades de un cido o una base. Contiene pares conjugados cido- base en concentraciones razonables. Titulacin.- es el proceso en el cual un reactivo de la solucin, el titulante, se aade cuidadosamente a la solucin de otro reactivo y se determina el volumen necesario para que la reaccin se complete. Estandarizacin es el proceso por el cual se determina la concentracin de una solucin midiendo con exactitud el volumen necesario de la misma para reaccionar con una cantidad perfectamente conocida de un estndar primario.
Indicador.- es un colorante que se utiliza para distinguir entre las soluciones cidas y bsicas por medio del cambio de color que experimentan estas soluciones; el punto en el que cambia de color se llama punto final o punto de equivalencia que es el punto en el cual se neutralizan un cido y una base. Curva de titulacin.- es una grfica de pH contra cantidad de cido o base aadida. Hidrlisis de sales.- es la reaccin qumica de cualquier especie con el agua. Producto de solubilidad.- la expresin del producto de solubilidad de un compuesto, es el producto de las concentraciones de los iones que lo constituyen, elevadas cada una a la potencia que corresponde al nmero de iones en una unidad de la frmula del compuesto.
También podría gustarte
- Determinación de acidez en aguasDocumento1 páginaDeterminación de acidez en aguasAngie Daniela BravoAún no hay calificaciones
- Receptores celulares y acción de fármacosDocumento22 páginasReceptores celulares y acción de fármacossarahimanzoAún no hay calificaciones
- Difusión Binaria en Gases (Final)Documento23 páginasDifusión Binaria en Gases (Final)Drarius Pedernal100% (1)
- Bombas de LobuloDocumento6 páginasBombas de LobuloJaime MontielAún no hay calificaciones
- Mezclas y AleacionesDocumento3 páginasMezclas y AleacionesDanny Chavez Zuniga100% (1)
- Concepto Sensibilidad y SelectividadDocumento6 páginasConcepto Sensibilidad y SelectividadFranzMichaelSanchezAlbaAún no hay calificaciones
- Ligandos Macrociclicos TesisDocumento91 páginasLigandos Macrociclicos TesisgersonAún no hay calificaciones
- Proceso de fabricación del yeso de construcción en 7 etapasDocumento2 páginasProceso de fabricación del yeso de construcción en 7 etapasmarycieloAún no hay calificaciones
- Modelo de Informe de Laboratorio de Mecanica de MaterialesDocumento20 páginasModelo de Informe de Laboratorio de Mecanica de MaterialesJuan Andres Osorio AriasAún no hay calificaciones
- Nomenclatura inorgánica y funciones hidrogenadasDocumento6 páginasNomenclatura inorgánica y funciones hidrogenadasJhonatan ArmasAún no hay calificaciones
- Variacion de La Resistencia Electrica Con La Temperatura, Ing. QuimicaDocumento12 páginasVariacion de La Resistencia Electrica Con La Temperatura, Ing. QuimicaYan Carla Quispe FloresAún no hay calificaciones
- Quimica ParcialesDocumento10 páginasQuimica ParcialesBraulio SilvaAún no hay calificaciones
- Act de Req Etapa 1 FqeDocumento5 páginasAct de Req Etapa 1 FqeAmishwiiAún no hay calificaciones
- Métodos numéricos para ingeniería químicaDocumento3 páginasMétodos numéricos para ingeniería químicayumniAún no hay calificaciones
- Estequiometria 4 EsoDocumento3 páginasEstequiometria 4 Esoindalo59100% (1)
- Semana 8Documento66 páginasSemana 8Hipolito Vargas0% (1)
- Entiendes El Rombo de NFPA - Seguridad IndustrialDocumento10 páginasEntiendes El Rombo de NFPA - Seguridad IndustrialJulio Edgar QuiritaAún no hay calificaciones
- ADN ÁCIDOS NUCLEICOS BIOLOGÍA BACHILLERATODocumento3 páginasADN ÁCIDOS NUCLEICOS BIOLOGÍA BACHILLERATOnicolasmartincomino0% (1)
- Informe de PHDocumento16 páginasInforme de PHAnTony Frank Perales QuispilayaAún no hay calificaciones
- Gasometria ArterialDocumento10 páginasGasometria ArterialElena GuerreroAún no hay calificaciones
- Acidos y Bases de Lux-Flood PearsonDocumento16 páginasAcidos y Bases de Lux-Flood PearsonleidyhurtadoAún no hay calificaciones
- Semana 10 Lab Análisis Del AguaDocumento21 páginasSemana 10 Lab Análisis Del AguaKir FernándezAún no hay calificaciones
- Acidez y Aluminio IntercambiableDocumento25 páginasAcidez y Aluminio IntercambiableSebastián Martínez LlanosAún no hay calificaciones
- Sesión N°5Documento23 páginasSesión N°5Edinson Raul Quispe BautistaAún no hay calificaciones
- Cap 1 Fundamentos Del EquilibrioDocumento39 páginasCap 1 Fundamentos Del Equilibrioclau-a-cAún no hay calificaciones
- Informe de Materiales de ConstrucciónDocumento15 páginasInforme de Materiales de ConstrucciónAyrton JoséAún no hay calificaciones
- Ficha de seguridad activador DPFDocumento7 páginasFicha de seguridad activador DPFGestion AmbientalAún no hay calificaciones
- Msds Arc s2 Parte A - EsDocumento5 páginasMsds Arc s2 Parte A - EsMansys Proyectos SacAún no hay calificaciones
- Sexto GrupoDocumento9 páginasSexto GrupoLuis Alberto Apaza ArceAún no hay calificaciones
- Enlaces QuimicosDocumento11 páginasEnlaces QuimicosjuanvallenatoAún no hay calificaciones