Física
TERMODINÁMICA 4. Con referencia al modelo cinético,
determine si cada proposición es
1. Isotérmicamente se traslada un gas que se verdadera (V) o falsa (F) y marque la
encuentra en un recipiente de forma secuencia correcta:
esférica a otro más pequeño de diámetro
50% menos que el primero. Determine la I. A una misma temperatura, las
presión (en atm) del gas, si inicialmente se moléculas de un gas liviano tienen
encuentra a 2 atm. mayor velocidad que las moléculas de
un gas pesado.
A) 12 B) 14 C) 16 II. A una misma temperatura, las
D) 18 E) 20 moléculas de un gas liviano tienen
mayor energía cinética que las
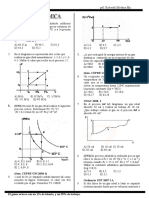
2. Se muestra la dependencia de la presión moléculas de un gas pesado.
de un mismo gas ideal con su III. La temperatura de un volumen de gas
V
temperatura. Si V2 =8 la presión en el punto está relacionada con la energía interna
1
de todo el volumen de gas.
3 (en atm)
A) VFF B) FFV C) VVV
D) VVF E) FFF
5. Acerca de la teoría cinética de los gases,
determine si cada proposición es
verdadera (V) o falsa (F) y marque la
secuencia correcta:
I. Estudia las propiedades físicas de los
gases, como presión y temperatura
relacionándolas con las propiedades
A) 16 B) 12 C) 10
microscópicas de las moléculas, tales
D) 8 E) 6
como velocidad y energía cinética.
II. La presión del gas se debe a choques
3. Un recipiente provisto de un émbolo
de las moléculas del gas contra las
contiene un gas ideal de densidad ρ,
paredes del recipiente.
presión P y temperatura T=27°C. ¿En
III. Una molécula de gas de H u O2 tiene
cuántos grados centígrados se 3
incrementará la temperatura del gas si se energía cinética media igual a 2 kT.
le somete a un proceso mediante el cual su
densidad y presión alcanzan los valores A) VVV B) VFV C) FVF
1,5ρ y 2P respectivamente? D) VVF E) FFF
A) 50 B) 75 C) 100 6. La energía cinética media por molécula de
D) 125 E) 150 un gas ideal es igual a: E ̅c =823,9×10-23 ,
halle la temperatura (en °C) a la cual se
encuentra el gas. (k=1,38×10-23 J/K)
A) 35 B) 100 C) 125
D) 115 E) 55
1
� Física
7. Cuando una cantidad de gas ideal
monoatómico se expande a una presión
constante de 3×104 Pa, el volumen del gas
aumenta de 3×10−3 m3 a 6×10−3 m3, calcule
el cambio de la energía interna del gas (en
J).
A) 160 B) 300 C) 75
D) 100 E) 135
A) –50,42 B) –93,07 C) –25,72
D) –128,4 E) –41,2
8. Determine si cada proposición es
verdadera (V) o falsa (F) y marque la 11. Cuando un sistema realiza el proceso ACB,
secuencia correcta: el sistema absorbe 80 J de calor y realiza 30
J de trabajo. Si sistema realiza el proceso
I. Es posible que un gas ideal realice un ADB realiza 10 J de trabajo, calcule el calor
proceso isotérmico cambiando al absorbido por el sistema (en J) en el
mismo tiempo su energía interna. proceso ADB.
II. Si un sistema está sujeto a un proceso
isocórico el sistema no realiza trabajo
mecánico.
III. Cuando un gas ideal se somete a un
proceso adiabático su energía interna
permanece inalterada.
A) VVV B) VFV C) FVF
D) VVF E) FFF A) 100 B) 80 C) 60
D) 40 E) 20
9. Se calienta un mol de gas oxígeno a
volumen constante, determine 12. La figura muestra el proceso (123) para un
aproximadamente la cantidad de calor determinado gas. Si en el proceso (12)
necesario (en J) para elevar su temperatura ΔU1−2=2×105 J y Q1−2=8×105 J, determine el
de 20° C a 100 °C, considere gas ideal trabajo desarrollado (en J) en el proceso
diatómico. (123)
A) 1426 B) 1662 C) 1868
D) 2114 E) 2244
10. tiene 8 moles de O2 encerrado en el
cilindro mostrado en la figura, a una
temperatura de 427 ºC. Se deja enfriar el
gas de manera que la tapa desciende sin
fricción 0,5 m, hasta la temperatura
ambiente de 27 ºC. Determine el calor
extraído en kJ. A) 1×105 B) 2×105 C) 2,5×105
D) 3×105 E) 3,5×105
2
� Física
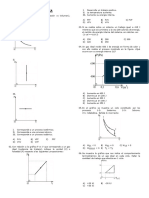
13. En el diagrama presión (p) versus 15. En un cilindro provisto de un embolo
volumen (V) adjunto se muestra el proceso móvil, se tiene 4 kg de aire a 25 °C. Cuando
termodinámico que sigue un gas ideal. el proceso es adiabático y el trabajo sobre
Determine la cantidad de calor (en J) el sistema es 70 kJ, determine la
absorbido por el gas en dicho proceso. temperatura final del sistema (en °C).
Considere para el aire: cv=0,7 kJ/kg.K
A) 0 B) 2 C) 5
D) 7 E) 9
16. Dos máquinas de Carnot opera según los
diagramas mostrados. Determine la
ε
relación de las eficiencias ε1
2
A) 100 B) 200 C) 400
D) 800 E) 900
14. Con referencia al proceso cíclico mostrado
en la figura, realizado por 1 mol de gas
ideal, determine si cada proposición es
verdadera (V) o falsa (F) y marque la A) 1,13 B) 1,34 C) 1,67
secuencia correcta: (1 J= 0,24 cal) D) 1,83 E) 1,95
17. La figura muestra el ciclo de Carnot donde
I. El trabajo total realizado por el gas es TH=207 °C y TC = −153 °C , determine si
36 cal. cada proposición es verdadera (V) o falsa
II. Durante la expansión el trabajo (F) y marque la secuencia correcta:
realizado por el gas es 58 cal.
III. Si durante la expansión el gas absorbe QC 1
144 cal, al término de esta etapa la I. =4
QH
energía interna del gas disminuye en II. Q en dabc=4Q en cd
86 cal. III. La eficiencia es negativa.
A) VVV B) VVF C) VFV
D) FVF E) FFF A) VVF B) FVF C) VFF
D) VFV E) VVV
3
� Física
18. La figura muestra dos máquinas térmicas A) 0,02 B) 0,04 C) 0,06
de Carnot, si la eficiencia de la primera es D) 0,08 E) 0,10
el doble que la de la segunda. Determine
la temperatura del foco T. (en K) 21. Respecto a la 2da ley de la termodinámica,
determine si cada proposición es
verdadera (V) o falsa (F) y marque la
secuencia correcta:
A) 300 I. En un proceso cíclico es imposible
B) 350 convertir el 100% de trabajo en calor.
C) 400 II. Es imposible transferir
D) 450 espontáneamente calor de un cuerpo a
E) 500 otro más caliente.
III. La máquina de Carnot tiene una
eficiencia de 100%.
A) VVV B) FVF C) FFF
D) FFV E) VFF
19. Una máquina térmica consume 300 J de
calor proveniente de un foco caliente a 300
K, realiza 60 J de trabajo y devuelve calor
a un foco frío de 200 K. ¿Cuánto calor (en
J) se pierde por ciclo respecto de una
máquina Carnot?
A) 15 B) 20 C) 30
D) 40 E) 50
20. Se tienen dos máquinas térmicas que
trabajan según ciclos de Carnot de
eficiencias ε1 y ε2 respectivamente tal como
lo muestra la figura si T’2 = T2 – 8 °C.
Determine ε2 − ε1.