Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Anemias Megaloblásticas
Cargado por
ELMER ELOY MAQUI SANTOTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Anemias Megaloblásticas
Cargado por
ELMER ELOY MAQUI SANTOCopyright:
Formatos disponibles
FISIOPATOLOGÍ
ANEMIAS MEGALOBLÁSTICAS
A. ANEMIA POR DEFICIENCIA DE VITAMINA B12.
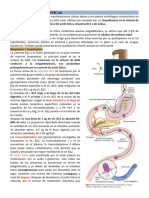
METABOLISMO DE LA B12.
La vitamina B12, también denominada cobalamina por presentar cobalto en su
molécula, aparece en alimentos de origen animal.
Los almacenes de vitamina B12 se sitúan fundamentalmente en el hígado, y su
nivel es tan elevado que la deficiencia tarda años en producirse.
La vitamina B12 sólo se le encuentra en alimentos de origen animal, al ingresar al
tubo digestivo esta por acción de los jugos gástricos queda libre y a continuación
se une a la haptocorrina o proteína-R (secretada junto a la saliva), formándose el
complejo proteína R-B12, dicho complejo protege a la vitamina B12 de la acción
degradativa del ácido clorhídrico; tengamos en cuenta que nivel del estómago en
las células parietales también se secreta factor intrínseco (FI).
El enlace que mantiene unido el complejo proteína R-B12, a nivel del duodeno se
“rompe” o se separa por acción de las proteasas pancreáticas e inmediatamente
B12 al quedar libre se une al factor intrínseco (FI), formando el complejo FI-B12, el
cual va permitir la absorción de B12 a nivel del íleon,uniéndose a receptores de
factor intrínseco ubicados en la membrana de los enterocitos ileales; luego de la
absorción B12 pasa hacia el plasma.
En la sangre la vitamina B12 se une a la transcobalamina tipo II, la cual es
sintetizada a nivel del hígado y presenta un tiempo de vida media corto. También
existe la transcobalamina I (sintetizada en los neutrófilos) que presenta un mayor
tiempo de vida media.
MED. ALAN APAZA 1
FISIOPATOLOGÍ
ETIOLOGÍA DE LA DEFICIENCIA DE B12:
a. Disminución de la ingesta: dietas vegetarianas estrictas.
b. Disminución de la absorción.
Deficiencia de factor intrínseco: gastrectomía, anemia perniciosa o enfermedad
de Biermer (anemia perniciosa adquirida).
Alteración intestinal, sobre todo del íleon terminal.
Infestación por bacterias o parásitos (síndrome de sobrecrecimiento bacteriano,
Diphyllobothrium latum).
Deficiencia de receptores ileales para factor intrínseco (síndrome de Imerslund).
Alteraciones pancreáticas.
Fármacos (anticonceptivos, alcohol, colestiramina).
c. Alteración en la utilización: inactivación de la vitamina B12 de almacén mediante el
óxido nitroso de la anestesia.
MED. ALAN APAZA 2
FISIOPATOLOGÍ
MANIFESTACIONES CLÍNICAS DE LA DEFICIENCIA DE COBALAMINA.
ÓRGANOS O SISTEMA SÍNTOMAS Y SIGNOS
AFECTADO
Síntomas generales Sueño incrementado, astenia, hiporexia (inapetencia), anorexia,
irritabilidad, rendimiento físico disminuido, fatiga, vértigos,
mareos, cefaleas y alteraciones en el crecimiento.
Alteraciones en piel Piel pálida (causada por la ictericia, una enfermedad que se
desarrolla cuando se acumula en la sangre una sustancia química
denominada bilirrubina).
Síntomas cardiopulmonares Dificultad para respirar (disnea), sobre todo durante el ejercicio,
desmayos, palpitaciones (latidos irregulares).
Alteraciones digestivas Diarrea o estreñimiento, inflamación y enrojecimiento de la
lengua (glositis), úlceras en la boca o encías que sangran
Síntomas neurológicos o Disminución de la concentración, confusión o cambio en el
estado mental (demencia) en casos graves o avanzados o
Alteración o disminución del sentido del tacto
o Disminución de la capacidad para sentir dolor, alteración en la
forma de caminar o moverse
o Dolor de cabeza, zumbidos (acúfenos)
o Trastornos visuales o
Depresión
o Hormigueo y entumecimiento de manos y pies. o
Demencia.
Una forma especial de deficiencia de cobalamina es la ANEMIA
PERNICIOSA. La anemia perniciosa suele ser una enfermedad que aparece
en edades avanzadas, en razas nórdicas y que presenta agrupación
familiar.
El trastorno consiste en una gastritis crónica atrófica, que ocasiona destrucción de las
células parietales gástricas, lo
que produce disminución del
factor intrínseco, y como
consecuencia, carencia de
absorción de vitamina B12. Se
trata de un proceso autoinmune,
objetivándose en el suero del
enfermo anticuerpos contra
células parietales y contra el
factor intrínseco (más
específicos). Por ello se asocia a
otros trastornos autoinmunes, sobre todo tiroideos. La anemia perniciosa es un
proceso premaligno, por lo cual es necesario el seguimiento del enfermo para
diagnóstico precoz de cáncer gástrico.
Debe tenerse en cuenta que, por la destrucción de las células parietales, se ocasiona
aclorhidria, que puede a su vez ocasionar una disminución de la absorción del hierro de
los alimentos.
MED. ALAN APAZA 3
FISIOPATOLOGÍ
TRATAMIENTO.
FÁRMACO PRESENTACIÓN DOSIFICACIÓN
HIDROXICOBALAMINA Inyectable de En deficiencia clínica como anemia perniciosa
usualmente se suministra 1 mg
1 mg/ml B12 intramuscular diario por una semana, luego
1 mg B12 semanal por 4 semanas y si persiste la
causa (ej. resección íleon terminal) 1 mg
B12 mensual de por vida. Por este motivo, se
recomienda discutir con el paciente la duración
de la terapia y la necesidad de seguimiento
cuando la causa subyacente es desconocida. La
respuesta al tratamiento provee confirmación
diagnóstica.
ANEMIA POR DEFICIENCIA DE FOLATO (B9)
Es la causa más frecuente de anemia megaloblástica.
METABOLISMO DEL FOLATO:
El ácido fólico para su utilización y absorción se da en su forma monoglutámica, es
decir, el grupo Pteridina, unida al ácido paraaminobenzoico y a una sola molécula de
ácido glutámico.
MED. ALAN APAZA 4
FISIOPATOLOGÍ
Pero en la naturaleza el ácido fólico aparece no solamente en productos cárnicos, sino
también en verduras, legumbres,
levaduras y frutos secos, en sus
formas poliglutámicas, es decir,
unida a varias moléculas de ácido
glutámico, en los vegetales se
encuentra en su forma
heptaglutámica (7 residuos de ácido
glutámico) y en los alimentos de
origen animal en su forma
pentaglutámica (5 residuos de ácido
glutámico).
Por lo tanto, para su absorción lo
primero que debe pasar es que las
formas poliglutámicas deben ser transformadas a su forma monoglutámica, por acción
de la enzima Pteroil γ glutamil carboxipeptidasa o poliglutamato hidroxilasa presente
en las células en borde en cepillo del yeyuno, enzima que hidroliza la cadena de ácido
glutámico, transformando de este modo la forma poli a monoglutámica. La absorción
se ve favorecida por la FBP (en enterocitos y leche materna) en niños; y la vitamina C
en el adulto y se ve disminuida: etanol, barbitúricos, anticonceptivos orales.
Luego las formas
monoglutámicas son
absorbidas a nivel del
yeyuno con
participación de
receptores de folato y al
pasar al interior del
enterocito duodenal se
reduce por acción de las
folato reductasas y
metila a N-5-10- metil
THF; pasa a circulación
donde circula de
manera libre en un 60%,
y el resto unido a
albúmina, alfa 2 macro
globulina, y proteína
lígadora de folato.
El hígado es el principal
depósito en su forma poliglutámica (las reservas de folato hepáticas son útiles
solamente para tres o cuatro meses, a diferencia de las de vitamina B12 que pueden
tardar hasta tres a seis años en agotarse). Y la excreción de folatos y sus productos de
degradación se da a través del riñón/ bilis
MED. ALAN APAZA 5
FISIOPATOLOGÍ
SIGNOS Y SÍNTOMAS:
ÓRGANOS O SISTEMA SÍNTOMAS Y SIGNOS
AFECTADO
Síntomas generales Sueño incrementado, astenia, hiporexia (inapetencia), anorexia,
irritabilidad, rendimiento físico disminuido, fatiga, vértigos,
mareos, cefaleas y alteraciones en el crecimiento.
Alteraciones en piel Piel pálida
Síntomas cardiopulmonares Dificultad para respirar (disnea), sobre todo durante el ejercicio,
desmayos, palpitaciones (latidos irregulares).
Alteraciones digestivas Diarrea, inflamación y enrojecimiento de la lengua (glositis),
úlceras en la boca o encías que sangran
Síntomas neurológicos Disminución de la concentración, confusión
La deficiencia de ácido fólico durante el embarazo aumenta el
riesgo de defectos congénitos del tubo neural y, tal vez, de otros
defectos cerebrales.
DIAGNÓSTICO:
Hemograma completo y niveles séricos de vitamina B12 y ácido fólico
El hemograma completo puede mostrar anemia megaloblástica indistinguible de la
causada por deficiencia de vitamina B12. Se determina entonces cantidad de B12
presente en los eritrocitos.
La anemia por deficiencia de folato puede sospecharse a partir de los resultados
generales de una historia médica completa y un examen físico. Además, pueden
realizarse varios exámenes de sangre para confirmar el diagnóstico. Si se cree que la
anemia es causada por un problema del tracto digestivo, puede realizarse un estudio
con bario del sistema digestivo.
La deficiencia de folato no suele producir problemas neurológicos, pero sí la deficiencia
de vitamina B12.
La deficiencia de folato y la de vitamina B12 pueden estar presentes al mismo tiempo.
Si la deficiencia de vitamina B12 se trata con folato por error, los síntomas de la anemia
pueden disminuir, pero los problemas neurológicos pueden empeorar.
VER ESQUEMA: METABOLISMO Y ABSORCIÓN DE
B12:
Etiología de la deficiencia de folato.
a. Disminución de aporte: desnutrición, etilismo (intoxicación por consumo de
alcohol).
b. Disminución de absorción: enteropatías y fármacos (anticonvulsivantes y
anticonceptivos).
c. Aumento de consumo: embarazo, infancia, hemopoyesis hiperactiva,
hipertiroidismo.
d. Activación bloqueada de folatos: antagonistas inhibidores de la folato reductasa:
metotrexate, trimetoprim, hidantoínas, barbitúricos, triamtereno, tetraciclina,
Fenitoína.
e. Incremento de pérdidas: la enteropatía pierde proteínas, hemodiálisis,
hepatopatía crónica.
MED. ALAN APAZA 6
FISIOPATOLOGÍ
TRATAMIENTO:
Ácido fólico: Tabletas de 0,5 mg y 1 mg
Dosis:
Adultos: oral. Prevención de la deficiencia, suplemento dietético en el embarazo hasta
1 mg/d. Tratamiento de la deficiencia: Inicial 0,025 mg -1 mg/d, hasta que ocurra
respuesta hematológica. Cuando han desaparecido los síntomas clínicos y el cuadro
hematológico se ha normalizado, se continúa con una dosis de mantenimiento de 0,5
mg/d; en el embarazo y la lactancia 0,8-1 mg/d
Niños: Las dosis para prevención y tratamiento inicial de la deficiencia son iguales que
la de los adultos. La dosis de mantenimiento en el tratamiento de la deficiencia en
lactantes es de 0,1 mg/d, en niños hasta los 4 años 0,3 mg/d; y en niños mayores de 4
años 0,4 mg/d.
MED. ALAN APAZA 7
FISIOPATOLOGÍ
VASOS SANGUÍNEOS: ENFERMEDAD Y TRATAMIENTO
FARMACOLÓGICO
HEMORRAGIA
La hemorragia es, generalmente, un signo de
extravasación de la sangre producida por una
rotura vascular. En la hemorragia, la sangre
puede salir al exterior (hemorragia externa) a
quedar encerrada en el seno de un tejido; la
masa de sangre acumulada se llama hematoma.
Los hematomas pueden ser relativamente
intrascendentes (como después de una
rozadura), pero a veces forman colecciones de sangre en cantidad suficiente para
causar la muerte (p. ej., el hematoma retroperitoneal masivo debido a la rotura de un
aneurisma disecante de la aorta puede ser mortal.
HEMOSTASIA Y TROMBOSIS
Partiremos señalando que la hemostasia es un proceso fisiológico y la trombosis es
patológico; pero ambos procesos se dan con los mismos eventos.
La hemostasia normal es el resultado de una serie de procesos perfectamente
regulados que cumplen dos funciones importantes:
1. Mantener la sangre en estado líquido y sin coágulos dentro de los vasos
sanguíneos normales.
2. Estar preparados para formar
rápidamente un tapón hemostático
localizado en el punto de lesión
vascular.
HEMOSTASIA NORMAL
Después de la lesión inicial, se produce
una vasoconstricción arteriolar de breve
duración, debido a la secreción de
endotelina, un potente vasoconstrictor
derivado del endotelio vascular. Pero su
efecto es pasajero, y la hemorragia
reaparecería si no fuera por la activación
de las plaquetas y de los sistemas de la
coagulación.
La lesión del endotelio deja al
descubierto la matriz extracelular
subendotelial compuesta por el
colágeno, de intenso poder
trombógeno, que permite a las
MED. ALAN APAZA 8
FISIOPATOLOGÍ
plaquetas adherirse y activarse, es decir, sufrir un cambio de forma y vaciar sus
granulaciones secretorias. En pocos minutos, los productos secretados atraen a otras
plaquetas y se forma el tapón hemostático: este es el proceso de la hemostasia
primaria, es decir un acumulo de plaquetas que fácilmente se disgrega y el sangrado
continúa.
Luego, el factor tisular, que es un factor procoagulante unido a la membrana y
sintetizado por el endotelio, también queda al descubierto en el sitio de la lesión. Este
factor actúa junto a los factores secretados por las plaquetas para activar la cascada de
la coagulación, y culmina con
la activación de la trombina. La
trombina, a su vez, convierte al
fibrinógeno disuelto en la
sangre en fibrina insoluble,
que acaba depositándose
“amarrando” a las plaquetas,
dando lugar a la formación del
tapón hemostático
secundario, el cual es
permanente y realmente frena
el sangrado.
La fibrina polimerizada y los agregados de plaquetas forman un sólido tapón
permanente que impide cualquier nueva hemorragia. En esta fase, se ponen en marcha
los mecanismos de contrarregulación (p. ej., el activador del plasminógeno tisular [t-
PA]), para que el tapón hemostático quede circunscrito al sitio de la lesión.
T
anto la hemostasia como la trombosis dependen de tres factores
generales: el endotelio vascular, las plaquetas y la cascada de la
coagulación.
1. ENDOTELIO VASCULAR:
Por un lado, estas células tienen propiedades antiplaquetarias, anticoagulantes y
fibrinolíticas; por otro lado, son capaces de ejercer funciones procoagulante.
A. Propiedades antitrombóticas
- Antiplaquetarias:
La integridad del endotelio vascular que impide que las plaquetas y los
factores plasmáticos de la coagulación se pongan en contacto con la
matriz extracelular subendotelial dotada de intensa acción trombógena.
Las plaquetas sin activar no se adhieren al endotelio, una propiedad que
es intrínseca a la membrana citoplásmica de la célula endotelial.
La prostaciclina o prostaglandina endotelial (PGI2) y el oxido nítrico. Estos
dos mediadores son potentes vasodilatadores e inhibidores de la
agregación plaquetaria.
MED. ALAN APAZA 9
FISIOPATOLOGÍ
Adenosin difosfatasa (ADP), que degrada el adenosin difosfato producto
del metabolismo de otras células.
- Anticoagulantes:
Moléculas afines o tipo heparina, receptores de la célula endotelial para
antitrombina III, dicho complejo inactiva la acción de la trombina, por lo
tanto inactiva la cascada de la coagulación a nivel de los factores Xa y IXa
La trombomodulina, que es un receptor específico de la trombina, y
cuando se une a esta, activa a la Proteína C presente en el plasma; y una
vez activada la Proteína C, esta degrada los factores Va y VIIIa de la
cascada y por lo tanto se inhibe dicho proceso.
- Fibrinolíticas:
Las células endoteliales sintetizan el t-PA, que favorece la fibrinólisis es decir
degrada la fibrina que mantiene unido a las plaquetas que conforman el
trombo, permitiendo de este modo la disolución del mismo.
B. Propiedades protrombóticas:
La lesión del endotelio vascular que causan adhesión de las plaquetas a la
matriz extracelular subyacente (colágeno); esto es favorecido por el factor
de von Willebrand (vWF), un cofactor formado en el endotelio que es
esencial para que las plaquetas se unan al colágeno y a otras superficies.
MED. ALAN APAZA 1
FISIOPATOLOGÍ
Las células
endoteliales también
son estimuladas por
las endotoxinas
bacterianas o por las
citocinas (p. ej., factor
de necrosis tumoral
(TNF) o la interleucina
1 (IL-1).
El factor tisular
secretado en el
endoteliovascualr
que, como se verá a
continuación, activa la
cascada de la
coagulación
extrínseca.
2. PLAQUETAS
Las plaquetas desempeñan un papel
esencial en la hemostasia normal.
- El tromboxano A2 y la trombina,
se sintetizan en las plaquetas, el
primero favorece la
vasoconstricción y agregación
plaquetaria, y el segundo
favorece la agregación
plaquetaría, a su vez ambos se
liberan para llamar a más
plaquetas a formar parte del
trombo.
- En condiciones fisiológicas, las plaquetas circulan en forma no activa y
expresan en su superficie un número relativamente pequeño de muchas de las
moléculas que, en estado activado, van a facilitar su interacción con otras
plaquetas y otras células de su entorno. Además, las plaquetas contienen
diferentes tipos de gránulos (fundamentalmente gránulos densos, gránulos α
y lisosomas) desde los que al ser activadas liberan diferentes factores
almacenados en ellos y que a su vez estimulan más la actividad de la propia
plaqueta.
- La liberación de los gránulos densos en las plaquetas ocurre por exocitosis, y
desde ellos se liberan difosfato de adenosina (ADP), trifosfato de adenosina
(ATP), fosfato inorgánico, polifosfatos, serotonina y calcio, entre otros.
- La liberación de ADP es esencial como cofactor de la agregación plaquetaria y
actúa mediante su interacción con receptores específicos localizados en la
superficie plaquetaria. Se conocen dos receptores para el ADP en la plaqueta,
MED. ALAN APAZA 1
FISIOPATOLOGÍ
uno acoplado a la proteína Gaq (el P2Y1) y otro acoplado a Gi (el P2Y12), que
es esencial para la hemostasia primaria. Ambos receptores actúan de modo
sinérgico en la activación de las plaquetas.
- El calcio liberado por la plaqueta es necesario para la formación de fibrina,
mientras que las polifosfatos actúan como elementos reguladores en la
coagulación y la serotonina no sólo tiene efecto vasoconstrictor, sino que
también interviene en la activación de las propias plaquetas.
- Los gránulos α son reservorios de proteínas que van desde factores de
crecimiento hasta moléculas de adhesión o receptores que utiliza la plaqueta
para interaccionar con otras células. Entre estos receptores se incluyen las
glucoproteínas (GP) Ib.
- La adhesión de las plaquetas a la matriz extracelular esta mediada en gran
parte por interacciones con el vWF, y el colágeno expuesto, con el receptor
GP Ib de la membrana plaquetaria.
- La trombina se une al receptor superficial de las plaquetas y, junto con el ADP
y el TXA2, produce más agregación. Esto va seguido de la retracción de las
plaquetas, que acaban formando una masa irreversiblemente fundida de
plaquetas, que constituye el definitivo tapón hemostático secundario. Al
mismo tiempo, en toda la extensión del tapón plaquetario, la trombina
convierte al fibrinógeno en fibrina, formando prácticamente una argamasa
con las plaquetas que allí se encuentran. Por tanto, la trombina es esencial
para la formación de los trombos y, de hecho, es una importante sustancia
contra la que se dirige el tratamiento antitrombótico.
Adhesión plaquetaria: Unión de las plaquetas al colágeno del subendotelio
vascular, tras la lesión de la pared, a través de la glicoproteína Ib de la
membrana plaquetaria, mediante la acción del factor de Von Willebrand, que
actúa como puente; supone el primer paso para la formación del tapón plaquetario.
MED. ALAN APAZA 1
FISIOPATOLOGÍ
Agregación plaquetaria: Atracción y adhesión de unas plaquetas a otras a
través de la glicoproteína IIb/IIIa de su membrana, actuando el fibrinógeno
como puente de enlace. Este proceso está estimulado por el ADP y el
tromboxano A2
liberados por las plaquetas tras la adhesión, y conduce a la formación del tapón
plaquetario.
MED. ALAN APAZA 1
FISIOPATOLOGÍ
El eicosanoide PGI2 derivado del endotelio es una sustancia vasodilatadora
que inhibe la agregación plaquetaria, mientras que el eicosanoide TXA2
derivado de las plaquetas es un potente vasoconstrictor que activa la
agregación plaquetaria. La utilidad clínica de la aspirina en los pacientes expuestos
a una trombosis coronaria se debe, en gran parte, a su capacidad para inhibir la
síntesis del TXA2.
MED. ALAN APAZA 1
También podría gustarte
- Anemias MegaloblásticasDocumento14 páginasAnemias MegaloblásticasKevin MendizábalAún no hay calificaciones
- Deficit B12Documento15 páginasDeficit B12Marta AlarconAún no hay calificaciones
- Anemias CarencialesDocumento92 páginasAnemias CarencialesOscar OrtegaAún no hay calificaciones
- Vitaminas Liposolubles e Hidrosolubles, Funciones, Deficiencias. ROSIO PANDO LAZODocumento61 páginasVitaminas Liposolubles e Hidrosolubles, Funciones, Deficiencias. ROSIO PANDO LAZOJhonatan Portilla Suarez100% (2)
- Anemia MegaloblasticaDocumento20 páginasAnemia MegaloblasticaJazmin CrAún no hay calificaciones
- Anemias Megalobásticas MED4 23Documento34 páginasAnemias Megalobásticas MED4 23Juan Jesús SaenzAún no hay calificaciones
- Anemia PerniciosaDocumento31 páginasAnemia PerniciosaFrida Mdz RmrAún no hay calificaciones
- Anemia MegaloblsticaDocumento7 páginasAnemia MegaloblsticaDiana JimenezAún no hay calificaciones
- Anemia MegaloblasticaDocumento36 páginasAnemia MegaloblasticaBryan ToapantaAún no hay calificaciones
- Vitamina B12Documento3 páginasVitamina B12Cade CasAún no hay calificaciones
- Anemia Perniciosa 1Documento11 páginasAnemia Perniciosa 1jhonparck394Aún no hay calificaciones
- Presentacion de Anemia MegaloblasticaDocumento40 páginasPresentacion de Anemia MegaloblasticaByron AlbertoAún no hay calificaciones
- ANEMIA Por Deficiencia de Folatos y Vitamina B12Documento35 páginasANEMIA Por Deficiencia de Folatos y Vitamina B12Fernando Garcia0% (1)
- Anemias MegaloblasticasDocumento5 páginasAnemias MegaloblasticasDanielaAún no hay calificaciones
- Anemia MegaloblasticaDocumento30 páginasAnemia MegaloblasticaQUIMICO CLINICO WILLIANS SANCHEZ100% (6)
- Anemia: causas, tipos y tratamientoDocumento27 páginasAnemia: causas, tipos y tratamientoJosemaria Cambillo MartinezAún no hay calificaciones
- Farmacos de AnemiaDocumento4 páginasFarmacos de AnemiaOliver AyalaAún no hay calificaciones
- Anemias CarencialesDocumento39 páginasAnemias CarencialesFer GonzalezAún no hay calificaciones
- Anemia MegaloblasticaDocumento27 páginasAnemia MegaloblasticaDiego AramburoAún no hay calificaciones
- Anemia MegaloblásticaDocumento23 páginasAnemia MegaloblásticaJavier López CastellanosAún no hay calificaciones
- Anemia Por Deficiencia de Ácido FólicoDocumento8 páginasAnemia Por Deficiencia de Ácido FólicoLeslie CordovaAún no hay calificaciones
- Vitaminas Liposolubles e Hidrosolubles, Funciones, Deficiencias. ROSIO PANDO LAZODocumento91 páginasVitaminas Liposolubles e Hidrosolubles, Funciones, Deficiencias. ROSIO PANDO LAZOMax George Samame GomezAún no hay calificaciones
- Patología Del Metabolismo y La NutriciónDocumento33 páginasPatología Del Metabolismo y La Nutriciónmelisa sanchezAún no hay calificaciones
- VitaminasDocumento19 páginasVitaminasAntonellaAún no hay calificaciones
- Deficiencias de Vitaminas HidrosolublesDocumento17 páginasDeficiencias de Vitaminas Hidrosolublesvelvetfleur.9Aún no hay calificaciones
- Caso Clinico Vitamina B12Documento13 páginasCaso Clinico Vitamina B12Alexander Mango TrejosAún no hay calificaciones
- Anemia MegaloblasticaDocumento19 páginasAnemia MegaloblasticaVanessa OrtegaAún no hay calificaciones
- T12 Desnutrición y AvitaminosisDocumento45 páginasT12 Desnutrición y AvitaminosisJoe VilchezAún no hay calificaciones
- Anemia MegaloblásticaDocumento22 páginasAnemia MegaloblásticaLuis Eduardo Padilla CanalesAún no hay calificaciones
- MalnutricionDocumento8 páginasMalnutricionvaleAún no hay calificaciones
- Anemia MegaloblasticaDocumento15 páginasAnemia MegaloblasticaRocio Sanchez FloresAún no hay calificaciones
- Vitaminas HidrosolublesDocumento54 páginasVitaminas HidrosolublesIsrap Yambay100% (1)
- Nutricion Del Gallo, B12 PDFDocumento4 páginasNutricion Del Gallo, B12 PDFFernando Chavez QuinterosAún no hay calificaciones
- Anemia Perniciosa Descripcion de Cuadro ClinicoDocumento6 páginasAnemia Perniciosa Descripcion de Cuadro ClinicoRoberto AnguianoAún no hay calificaciones
- Caso Clínico Deficiencia Vitamina B12 2008Documento6 páginasCaso Clínico Deficiencia Vitamina B12 2008Pancho Francisco Adam VegaAún no hay calificaciones
- Anemia MacrociticaDocumento23 páginasAnemia MacrociticaLeo SuazoAún no hay calificaciones
- MATERIAL-PRINCIPAL-DEL-CURSO-B12Documento75 páginasMATERIAL-PRINCIPAL-DEL-CURSO-B12Agustina DaricoAún no hay calificaciones
- 4 Nutrición Clínica - Micronutrientes IIDocumento74 páginas4 Nutrición Clínica - Micronutrientes IIUSMP FN ARCHIVOSAún no hay calificaciones
- Anemia megaloblástica: causas, síntomas y tratamientoDocumento6 páginasAnemia megaloblástica: causas, síntomas y tratamientoKaty rc0% (1)
- Vitamina b12Documento6 páginasVitamina b12Cristian_Romer_1852Aún no hay calificaciones
- Desnut 2017Documento48 páginasDesnut 2017Nicole ÁlvarezAún no hay calificaciones
- Farmacología de Las VitaminasDocumento37 páginasFarmacología de Las VitaminasPeter Jano Rodriguez GranadosAún no hay calificaciones
- Anemia MegaloblásticaDocumento33 páginasAnemia MegaloblásticaSaulDAún no hay calificaciones
- Anemia megaloblástica: causas y síntomasDocumento7 páginasAnemia megaloblástica: causas y síntomasSharAún no hay calificaciones
- BAYRO Vitaminas Del Complejo BDocumento5 páginasBAYRO Vitaminas Del Complejo BBremel Gallegos SegundoAún no hay calificaciones
- Anemias MacrociticasDocumento3 páginasAnemias MacrociticasKim FernándezAún no hay calificaciones
- Alteraciones metabólicas y trastornos nutricionalesDocumento15 páginasAlteraciones metabólicas y trastornos nutricionalesAna Meza0% (1)
- VITAMINAS HIDROSOLUBLES Y SUS FUNCIONESDocumento62 páginasVITAMINAS HIDROSOLUBLES Y SUS FUNCIONESAlex VillanuevaAún no hay calificaciones
- Vitaminas Liposolubles e Hidrosolubles Funciones Deficiencias Rosio Pando LazoDocumento56 páginasVitaminas Liposolubles e Hidrosolubles Funciones Deficiencias Rosio Pando Lazofmh2009100% (1)
- 2 VitaminasDocumento44 páginas2 VitaminasConsultorioDeNutricionIntegralConutriAún no hay calificaciones
- Anemia MegaloblasticaDocumento9 páginasAnemia Megaloblasticacachorro_dcAún no hay calificaciones
- Medicamentos para mejorar glóbulos rojosDocumento2 páginasMedicamentos para mejorar glóbulos rojosRoger Alejandro MontoyaAún no hay calificaciones
- Biologia PPT - Vitaminas em EspanholDocumento52 páginasBiologia PPT - Vitaminas em EspanholBiologia ppt100% (2)
- A4 AnemiasmegaloblastivDocumento8 páginasA4 AnemiasmegaloblastivEsmeralda VargasAún no hay calificaciones
- Anemia MacrocíticaDocumento47 páginasAnemia MacrocíticaPepe UriAún no hay calificaciones
- Anemia Megaloblástica (8-9)Documento24 páginasAnemia Megaloblástica (8-9)Julio RiosAún no hay calificaciones
- Anemia Megaloblastica FinalDocumento18 páginasAnemia Megaloblastica FinalMarleny Ccorahua EscobedoAún no hay calificaciones
- CianocobalaminaDocumento18 páginasCianocobalaminaDeysi Katterine Ramirez OliveraAún no hay calificaciones
- Intolerancia a la Histamina: Dieta Baja en Histamina, #2De EverandIntolerancia a la Histamina: Dieta Baja en Histamina, #2Aún no hay calificaciones
- Fármacología básica para el odontólogo: Conocimientos básicos odontológicos, #1De EverandFármacología básica para el odontólogo: Conocimientos básicos odontológicos, #1Calificación: 5 de 5 estrellas5/5 (4)
- Ejemplo de CalculoDocumento10 páginasEjemplo de CalculoELMER ELOY MAQUI SANTOAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Hemostasia Trombosis EmboliaDocumento13 páginasHemostasia Trombosis EmboliaELMER ELOY MAQUI SANTOAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Caracatizacion Del Material CebadaDocumento3 páginasCaracatizacion Del Material CebadaELMER ELOY MAQUI SANTOAún no hay calificaciones
- Sangre AnemiasDocumento12 páginasSangre AnemiasELMER ELOY MAQUI SANTOAún no hay calificaciones
- Texto Largo 2Documento6 páginasTexto Largo 2heberth sarriaAún no hay calificaciones
- Infarto de MiocardioDocumento14 páginasInfarto de MiocardioELMER ELOY MAQUI SANTOAún no hay calificaciones
- 4.0 Tornillo de PotenciaDocumento17 páginas4.0 Tornillo de PotenciaELMER ELOY MAQUI SANTOAún no hay calificaciones
- Resolucion de Prorroga - Noviembre 2021-15Documento1 páginaResolucion de Prorroga - Noviembre 2021-15ELMER ELOY MAQUI SANTOAún no hay calificaciones
- Columna de Agua Oscilante DEM2Documento32 páginasColumna de Agua Oscilante DEM2ELMER ELOY MAQUI SANTOAún no hay calificaciones
- 2.2 Cálculo y Diseño de Engranajes - Esfuerzos - ProblemasDocumento11 páginas2.2 Cálculo y Diseño de Engranajes - Esfuerzos - ProblemasELMER ELOY MAQUI SANTOAún no hay calificaciones
- Informe Refrendado, Tronzado, Roscado y ConidadDocumento28 páginasInforme Refrendado, Tronzado, Roscado y ConidadGladys Xiomara CcapaAún no hay calificaciones
- Tif Tecnologia Mecanica Torno CNCDocumento61 páginasTif Tecnologia Mecanica Torno CNCELMER ELOY MAQUI SANTOAún no hay calificaciones
- Guia Prope TerminologiaDocumento7 páginasGuia Prope TerminologiaEmily GalindoAún no hay calificaciones
- Determinación del hematocritoDocumento10 páginasDeterminación del hematocritoAlejandraOzunaSolanoAún no hay calificaciones
- HEMOSTACIADocumento7 páginasHEMOSTACIAJacky OliveraAún no hay calificaciones
- Clasificación de Factores de Riesgo Higiénicos y de SeguridadDocumento18 páginasClasificación de Factores de Riesgo Higiénicos y de SeguridadNubia Esperanza Cortes Vidal88% (17)
- HemocomponentesDocumento63 páginasHemocomponentesJavo04Aún no hay calificaciones
- Arancel 2Documento61 páginasArancel 2Igor SaavedraAún no hay calificaciones
- 1era ExposiciónDocumento39 páginas1era ExposiciónArgelia Calle PeralesAún no hay calificaciones
- CNTS-01-003-ADocumento2 páginasCNTS-01-003-ARussell RodriguezAún no hay calificaciones
- Sistemas automatizados para pruebas de hemostasiaDocumento4 páginasSistemas automatizados para pruebas de hemostasiaGabby Alvarez OviedoAún no hay calificaciones
- 1410 - PPT - Farmviii - Practica N 4 Unid Interpretacion de Analisis ClinicosDocumento24 páginas1410 - PPT - Farmviii - Practica N 4 Unid Interpretacion de Analisis ClinicosAntonio TincopaAún no hay calificaciones
- Trombocitopenia (Recuento Bajo de Plaquetas) - Síntomas y Causas - Mayo ClinicDocumento1 páginaTrombocitopenia (Recuento Bajo de Plaquetas) - Síntomas y Causas - Mayo ClinicAndrés CerdaAún no hay calificaciones
- Transfusion MasivaDocumento8 páginasTransfusion MasivaJorgeGonzalezRiquelmeAún no hay calificaciones
- Síndrome antifosfolípido: manifestaciones, diagnóstico y tratamientoDocumento15 páginasSíndrome antifosfolípido: manifestaciones, diagnóstico y tratamientoOscar Mario Garcia BurgosAún no hay calificaciones
- PTA en niños y adolescentesDocumento10 páginasPTA en niños y adolescentesMaria Lucia VegaAún no hay calificaciones
- Pie diabético neuro-infeccioso tratado con ozonoterapiaDocumento8 páginasPie diabético neuro-infeccioso tratado con ozonoterapiaSilvia Sivelis Duany OrtízAún no hay calificaciones
- Hemostasia y Coagulación Sanguínea (Cascada Coagulación)Documento16 páginasHemostasia y Coagulación Sanguínea (Cascada Coagulación)Jonathan Salgado75% (4)
- Relacion Entre La Odontologia y El Sistema CardivascularDocumento22 páginasRelacion Entre La Odontologia y El Sistema CardivascularJezz GuilcapiAún no hay calificaciones
- Fisiopatología de Falla Orgánica MúltipleDocumento9 páginasFisiopatología de Falla Orgánica MúltipleManny BeatzAún no hay calificaciones
- Zonas del Quirófano: Negra, Gris y BlancaDocumento18 páginasZonas del Quirófano: Negra, Gris y BlancaJose Gabriel Topori100% (1)
- Síndrome coronario agudo manejo inicialDocumento8 páginasSíndrome coronario agudo manejo inicialvictorAún no hay calificaciones
- Clase 6. Megacariopoyesis y Fisiología PlaquetariaDocumento43 páginasClase 6. Megacariopoyesis y Fisiología PlaquetariaEstefany Nicol Saldaña RimarachinAún no hay calificaciones
- Expo Cicatrizacion DulceDocumento66 páginasExpo Cicatrizacion DulceSalinas SteffanyAún no hay calificaciones
- Tesis 2 PDFDocumento93 páginasTesis 2 PDFJenifer AlvarezAún no hay calificaciones
- Guia de Práctica de Interpretación de Análisis Clínicos 2021 IDocumento74 páginasGuia de Práctica de Interpretación de Análisis Clínicos 2021 IRoy Mendoza100% (1)
- CARACTERÍSTICAS Y FUNCIONES DE LOS PRINCIPALES TIPOS DE CÉLULAS SANGUÍNEASDocumento6 páginasCARACTERÍSTICAS Y FUNCIONES DE LOS PRINCIPALES TIPOS DE CÉLULAS SANGUÍNEASKatti PerezAún no hay calificaciones
- Teoria Celular de La HemostasiaDocumento3 páginasTeoria Celular de La HemostasiaDaniel Franco100% (1)
- Citopenias InmunológicasDocumento11 páginasCitopenias InmunológicasMaria teresa salinas merello100% (1)
- Arteritis de TakayasuDocumento30 páginasArteritis de TakayasuFabiola MaqueraAún no hay calificaciones
- 5p - Biometria Hematica, Tiempo de Sangrado y Tiempo de Coagulación - BravopérezDocumento20 páginas5p - Biometria Hematica, Tiempo de Sangrado y Tiempo de Coagulación - BravopérezHelen BPAún no hay calificaciones
- Infarto Agudo Al MiocardioDocumento2 páginasInfarto Agudo Al MiocardioSteeven Britckmand Cabrera YufraAún no hay calificaciones