Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Principales Tipos de Reacción Química
Cargado por
Sbsagamer09Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Principales Tipos de Reacción Química
Cargado por
Sbsagamer09Copyright:
Formatos disponibles
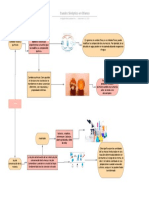
PRINCIPALES TIPOS DE REACCIÓN QUÍMICA
Existen una gran cantidad de posibles maneras de que se produzca la interacción entre
compuestos, presentando diferentes características y peculiaridades. Algunas de los
principales tipos de reacciones químicas entre compuestos son las siguientes.
1. Reacciones de síntesis o adición
En este tipo de reacciones químicas se combinan dos o más sustancias para formar un
único compuesto. La combinación de metal y oxígeno para formar óxidos es un ejemplo, dado
que da pie a moléculas relativamente estables que en algunos casos pueden ser utilizadas
para fabricar materiales frecuentes en nuestra vida cotidiana.
Ca + O2 CaO
2. Reacciones de descomposición
Las reacciones de descomposición son aquellas en las que un compuesto concreto se
descompone y divide en dos o más sustancias. Es lo que ocurre por ejemplo cuando se
produce la electrólisis del agua, separándose el agua en hidrógeno y oxígeno.
CaO Ca + O2
3. Reacciones de desplazamiento, sustitución o intercambio
Uno de los tipos de reacción química en que un elemento de un compuesto pasa a otro
debido a su interacción. En este caso el elemento traspasado se ve atraído por el otro
componente, que debe tener mayor fuerza que el compuesto inicial.
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
4. Reacciones iónicas
Se trata de un tipo de reacción química que se produce ante la exposición de
compuestos iónicos a un disolvente. El compuesto soluble se disuelve, disociándose en
iones.
5. Reacciones de doble sustitución
Se trata de una reacción semejante a la de la sustitución, con la excepción de que en en
este caso uno de los elementos que forman uno de los compuestos pasa el otro a la vez que
este segundo compuesto pasa al primero uno de sus propios componentes. Es necesario para
que se produzca la reacción que al menos uno de los compuestos no se disuelva.
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
6. Reacciones de óxido reducción o REDOX
Se denomina como tal a aquel tipo de reacción química en que existe intercambio de
electrones. En las reacciones de oxidación uno de compuestos pierde electrones en favor del
otro, oxidándose. El otro compuesto se reduciría al aumentar su número de electrones.
Este tipo de reacciones ocurren tanto en la naturaleza como de manera artificial. Por ejemplo,
es el tipo de reacción que hace que necesitemos respirar (adquiriendo oxígeno del medio) o
que las plantas realicen la fotosíntesis.
Ca + O2→ CaO
Acá se aplica los números de oxidación a los elementos o
compuestos para ver si cambiaron el numero en los reactivos y
en los productos.
7. Reacciones de combustión
Un tipo de oxidación extremadamente rápida y enérgica, en el que una sustancia
orgánica reacciona con oxígeno. Esta reacción genera energía (generalmente calorífica y
lumínica) y puede generar llamas y que suele tener como resultado un producto en forma de
gas. Un ejemplo típico es la combustión de un hidrocarburo o del consumo de glucosa.
Ca(s) + 1/2O2(g) → CaO(s) + calor
2Fe(s) + 3/2O2(g) → Fe2O3(s) + calor
Si los compuestos incluidos C y los elementos de H quemadura con O2 es necesario, los
productos son H2O y CO2.
8. Reacciones de neutralización
Este tipo de reacción química se produce cuando una sustancia básica y otra
ácida interaccionan de tal manera que se neutralizan formando un compuesto neutro y agua.
HCl + NaOH → NaCl + H2O
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
9. Reacciones nucleares
Se denomina como tal toda aquella reacción química en la que se provoca una
modificación no de los electrones de los átomos, sino de su núcleo. Esta combinación o
fragmentación va a provocar un elevado nivel de energía. Se denomina fusión a la combinación
de átomos, mientras que su fragmentación recibe el nombre de fisión.
10. Reacciones exotérmicas
Se denomina reacción endotérmica a toda aquella reacción química que provoca la emisión
de energía. Por lo general, estas emisiones de energía se dan al menos en forma de calor, si
bien en los casos en los que ocurren explosiones también aparece la energía cinética.
2H2 (g) + O2 (g) → 2H2O + 68 kcal
11. Reacciones endotérmicas
Las reacciones endotérmicas son todos aquellos tipos de reacción química en la que la
interacción entre elementos absorbe energía del medio, siendo el producto final mucho más
enérgico que los reactivos.
2NH3 + 22kcal → N2 + 3H2
TAREA
EN LA SIGUIENTE REACCION QUÍMICA SEÑALAR SUS PARTES Y
COLOCAR CON SU DEFINICION LOS SIMBOLOS QUE ALLI APARECEN:
3. CLASIFIQUE LAS SIGUIENTES REACCIONES ( MINIMO 3)
A. 3 O2 + Kcal 2 O 3 + O2
-------------------,-----------------------------,----------------------------------
B. MnO2 + KClO3 + KOH K 2MnO4 + KCl +
H2O-------------------------------------------------------------------------------------
C. Al + Cl2 AlCl 3
---------------------------------------,--------------------------------------------------,---------------
-----------------------
D, NaCl + AgNO3 NaNO3 + AgCl + CAL
-------------------‘------------------------,-------------------------
E. C6H12O6 +O2 + e- ATP + CO 2 +
H2O---------------------------------,---------------------------,--------------------------
También podría gustarte
- AP09-AA10-EV05. ForoDocumento3 páginasAP09-AA10-EV05. ForoSbsagamer09Aún no hay calificaciones
- AP09-AA10-EV05. ForoDocumento3 páginasAP09-AA10-EV05. ForoSbsagamer09Aún no hay calificaciones
- Ap09 - Aa10 - Ev04 Diseño Del Plan de MantenimientoDocumento13 páginasAp09 - Aa10 - Ev04 Diseño Del Plan de MantenimientoSbsagamer09Aún no hay calificaciones
- Ap09 - Aa10 - Ev04 Diseño Del Plan de MantenimientoDocumento13 páginasAp09 - Aa10 - Ev04 Diseño Del Plan de MantenimientoSbsagamer09Aún no hay calificaciones
- Reconocimiento AeronavesDocumento282 páginasReconocimiento AeronavesSbsagamer09Aún no hay calificaciones
- Normatividad Aeronáutica Señalero PDFDocumento35 páginasNormatividad Aeronáutica Señalero PDFSbsagamer09Aún no hay calificaciones
- SMS PDFDocumento26 páginasSMS PDFSbsagamer09Aún no hay calificaciones
- Familiarización Aeronaves PDFDocumento98 páginasFamiliarización Aeronaves PDFSbsagamer09Aún no hay calificaciones
- Introducción Curso Señalero PDFDocumento10 páginasIntroducción Curso Señalero PDFSbsagamer09Aún no hay calificaciones
- Señales de Mano RampaDocumento27 páginasSeñales de Mano RampaEstebanAún no hay calificaciones
- Asistencia en Tierra 1227149712789245 8Documento14 páginasAsistencia en Tierra 1227149712789245 8EstebanAún no hay calificaciones
- Seguridad y Salud en El Trabajo PDFDocumento11 páginasSeguridad y Salud en El Trabajo PDFSbsagamer09Aún no hay calificaciones
- Aeropuerto y Señalización JJLDocumento15 páginasAeropuerto y Señalización JJLSbsagamer09Aún no hay calificaciones
- PendienteDocumento1 páginaPendienteSbsagamer09Aún no hay calificaciones
- Transversal-Brochure Interactivocon Planteamiento de Coordinación Motriz Fina y Gruesa.Documento5 páginasTransversal-Brochure Interactivocon Planteamiento de Coordinación Motriz Fina y Gruesa.Sbsagamer09Aún no hay calificaciones
- Elaboración Del Prototipo Del Sistema de Información A Desarrollar.Documento8 páginasElaboración Del Prototipo Del Sistema de Información A Desarrollar.Sbsagamer09Aún no hay calificaciones
- 63 A 71 Con Tabla OxisalesDocumento2 páginas63 A 71 Con Tabla OxisalesSbsagamer09100% (1)
- Organizaciones SupranacionalesDocumento2 páginasOrganizaciones SupranacionalesSbsagamer09Aún no hay calificaciones
- Foro TemáticoDocumento1 páginaForo Temáticoanetrtuid75% (12)
- Actividad3 Evidencia2 DesarrolladaDocumento13 páginasActividad3 Evidencia2 DesarrolladaSbsagamer09Aún no hay calificaciones
- Solucion Interfaz UsuarioDocumento6 páginasSolucion Interfaz UsuarioSbsagamer09Aún no hay calificaciones
- Ecuaciones QuímicasDocumento8 páginasEcuaciones QuímicasSbsagamer09Aún no hay calificaciones
- Ejercicio Tipos de Reacciones Quimicas 969Documento1 páginaEjercicio Tipos de Reacciones Quimicas 969Sbsagamer09Aún no hay calificaciones
- Actividad3 Evidencia2 DesarrolladaDocumento13 páginasActividad3 Evidencia2 DesarrolladaSbsagamer09Aún no hay calificaciones
- Actividad 3 - Evidencia 1 - ..Documento3 páginasActividad 3 - Evidencia 1 - ..elvis jose50% (2)
- Libreto de La ExposiciónDocumento2 páginasLibreto de La ExposiciónSbsagamer09Aún no hay calificaciones
- Falso AmigoDocumento6 páginasFalso AmigoSbsagamer09Aún no hay calificaciones
- Solucion Tipos de Reacciones Quimicas 969Documento2 páginasSolucion Tipos de Reacciones Quimicas 969Sbsagamer09Aún no hay calificaciones
- Ejercicio Tipos de Reacciones Quimicas 969Documento1 páginaEjercicio Tipos de Reacciones Quimicas 969Sbsagamer09Aún no hay calificaciones
- Solucion Tipos de Reacciones Quimicas 969Documento2 páginasSolucion Tipos de Reacciones Quimicas 969Sbsagamer09Aún no hay calificaciones
- Yacimientos KurokoDocumento1 páginaYacimientos KurokoramonAún no hay calificaciones
- Manual FanoxDocumento219 páginasManual FanoxAndres RodriguezAún no hay calificaciones
- Fundamentos de Suelos y PlantasDocumento7 páginasFundamentos de Suelos y PlantasFabiola MendozaAún no hay calificaciones
- Forma y Diseño PDFDocumento19 páginasForma y Diseño PDFpati.gualterosb0% (1)
- Descargar Guía AERMOD - Cub 7007 - CubaenergíaDocumento17 páginasDescargar Guía AERMOD - Cub 7007 - CubaenergíaEder Samaniego100% (1)
- TRIPTICO Los Ecositemas - AdrianaDocumento2 páginasTRIPTICO Los Ecositemas - AdrianaJhonatan smith Manuyama armasAún no hay calificaciones
- PDF La Relacion de Compresion de Un Ciclo de Otto de Aire Estandar Es 9 - CompressDocumento3 páginasPDF La Relacion de Compresion de Un Ciclo de Otto de Aire Estandar Es 9 - CompressBernardo Josué Cornelio CañaAún no hay calificaciones
- Cuadro Sinóptico en BlancoDocumento1 páginaCuadro Sinóptico en BlancoKarla VásquezAún no hay calificaciones
- 03 06 20 Medio Natural y Salud 2° GradoDocumento4 páginas03 06 20 Medio Natural y Salud 2° GradoJanireth LozanoAún no hay calificaciones
- Minimizar la tortuosidad con VertiTrakDocumento151 páginasMinimizar la tortuosidad con VertiTrakRonald Pinto MamaniAún no hay calificaciones
- Atlas de Radiacion Solar Colombia PDFDocumento12 páginasAtlas de Radiacion Solar Colombia PDFIvan Giraldo ArdilaAún no hay calificaciones
- Planta portátil trata agua potableDocumento2 páginasPlanta portátil trata agua potableEduin CuevaAún no hay calificaciones
- Meditaciones Diarias Yo SoyDocumento36 páginasMeditaciones Diarias Yo SoyHRGAún no hay calificaciones
- Diseño de un ciclo de refrigeración de dos etapas con compresor centrífugoDocumento6 páginasDiseño de un ciclo de refrigeración de dos etapas con compresor centrífugoJavier EndaraAún no hay calificaciones
- Unidad 1Documento10 páginasUnidad 1Angibel CanoAún no hay calificaciones
- (Monografia) Historia de La Ingeniería de Los YacimientosDocumento1 página(Monografia) Historia de La Ingeniería de Los YacimientosDuban HernandezAún no hay calificaciones
- Estudio de Impacto Ambiental de La Planta de Tratamiento-2017Documento143 páginasEstudio de Impacto Ambiental de La Planta de Tratamiento-2017Ec Christian Asanza ReyesAún no hay calificaciones
- QUÍMICA 2°BGU Semana 1 Diagnóstica (Mayo 10 - 14)Documento4 páginasQUÍMICA 2°BGU Semana 1 Diagnóstica (Mayo 10 - 14)Margarita FlorAún no hay calificaciones
- Marco legal ambiental VzlaDocumento14 páginasMarco legal ambiental VzlaLuggerOnemar100% (1)
- Tipos de Sistemas AmbientalesDocumento8 páginasTipos de Sistemas AmbientalesVania RevillamelgarAún no hay calificaciones
- Organismos Euritermos y EndotermosDocumento4 páginasOrganismos Euritermos y EndotermosNayeli CabezasAún no hay calificaciones
- Informe Taller de Obervacion y Experimentacion Damian SaltarenDocumento11 páginasInforme Taller de Obervacion y Experimentacion Damian SaltarenDiana MorenoAún no hay calificaciones
- Matriz DofaDocumento11 páginasMatriz DofaDiego CastrillonAún no hay calificaciones
- Sonido y LuzDocumento27 páginasSonido y LuzAndres Palma Barros0% (1)
- Equivalente Del Agua en El CalorimetroDocumento6 páginasEquivalente Del Agua en El Calorimetrodayimar01Aún no hay calificaciones
- Difusión Con Reacción QuímicaDocumento41 páginasDifusión Con Reacción Químicaangus a.75% (4)
- Taller #3 Factores Abióticos de Un EcosistemaDocumento3 páginasTaller #3 Factores Abióticos de Un EcosistemaKat ShiAún no hay calificaciones
- Empaque Manejo PostcosechaDocumento24 páginasEmpaque Manejo PostcosechaMaite PerezAún no hay calificaciones
- Cadenas Carbonadas ClasificaciónDocumento27 páginasCadenas Carbonadas ClasificaciónRosmary Pardo50% (2)
- Evaporadores de Multiple EfectoDocumento6 páginasEvaporadores de Multiple EfectolightninfireAún no hay calificaciones