Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Hielo Seco. Estudiamos Sublimación
Cargado por
JOSE RUIZ0 calificaciones0% encontró este documento útil (0 votos)
108 vistas3 páginasTítulo original
11.-Hielo-seco.-Estudiamos-sublimación
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
108 vistas3 páginasHielo Seco. Estudiamos Sublimación
Cargado por
JOSE RUIZCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
1º, 2º y 3º de Educación Secundaria Obligatoria.
Interpretar los estados de agregación de la materia y los cambios de estado a
la luz de la teoría cinético-molecular.
Comprender la importancia de respetar las normas de seguridad del
laboratorio. Aprender a usar correctamente el material de laboratorio y los
productos químicos.
Expresar mensajes con contenido científico utilizando el lenguaje oral y
escrito con propiedad.
Trabajar el aprendizaje cooperativo haciendo que los resultados personales y
colectivos, las relaciones sociales y el respeto hacia los demás mejoren y se
potencien.
Cambios de estado.
Sublimación y condensación a sólido.
Jabón líquido concentrado.
1 bol redondo grande.
1 bol pequeño.
Agua.
1 camiseta vieja o trozo grande de tela.
Hielo seco.
Tijeras.
Elaboramos una mezcla de agua y jabón en el bol pequeño. Para ello,
echamos un poco de agua, un chorrito de jabón líquido concentrado y removemos
bien.
Cogemos una camiseta vieja que tengamos por casa o simplemente un
trozo grande de tela y le cortamos una tira del tamaño del diámetro del bol
grande. Introducimos esta banda en el bol pequeño y la empapamos bien con la
mezcla.
Cogemos el bol redondo grande y le echamos una buena cantidad de hielo
seco. Lo llenamos de agua y pasamos rápidamente la banda de tela empapada por
el borde, de manera que se cree una capa jabonosa.
Poco a poco veremos cómo la capa jabonosa se empieza a hinchar hasta
formar una burbuja gigante, que finalmente se romperá y observaremos el
espectacular efecto del humo cayendo por los laterales.
Lo que hemos hecho en este experimento
ha sido una especie de pompero gigante. En vez
del aire que expulsamos al soplar, el encargado de
inflar la burbuja ha sido el hielo seco, que con el
cambio de temperatura acelerado por el agua, ha
pasado a estado gaseoso (sublimación).
El hielo seco es en realidad dióxido de carbono (CO2) en estado sólido, y sólo se
consigue a una temperatura aproximada de -78°C. Cuando la temperatura es más
alta, cambia directamente a estado gaseoso por el proceso de sublimación. Como
todo gas, el CO2 se expande y ocupa más espacio, inflando la burbuja.
Pero, ¿por qué al explotar el humo cae hacia abajo en vez de ascender? Esto
se debe a que el dióxido de carbono es un gas muy denso, tanto que pesa más que
el aire y por ello desciende.
El hielo seco es extremadamente frío y alcanza temperaturas de alrededor de
−78,5 °C (o 194.65 °K). Debido a esto, es importante manejar el hielo seco con
precaución. Si se utiliza incorrectamente, el hielo seco puede causar quemaduras
por frío o cualquier otro daño al cuerpo, otras personas o animales. Es importante
entender todos los procedimientos adecuados de manipulación antes de usar
hielo seco. Estos incluyen usar guantes aislantes, el uso de pinzas y gafas de
seguridad.
El dióxido de carbono también se puede utilizar para fijar metal, para
eliminar baldosas del suelo y para eliminar las verrugas. También se puede
encontrar en herramientas tales como extintores de incendios. Uno de los
principales usos del hielo seco es la conservación de los alimentos perecederos.
También es usado por los heladeros para conservar fríos los helados que venden.
En el mundo del espectáculo también se usa en ocasiones para liberar a ras de
suelo un vapor blanco muy visible, similar a una niebla fría.
Entre 10 y 15 minutos.
Elena Morales García, profesora de ciencias del segundo ciclo de ESO en el
Colegio Ciudad de los Niños de Málaga.
También podría gustarte
- Taller Adultos MayoresDocumento23 páginasTaller Adultos MayoresGael J. Beat100% (1)
- TP N°2 - CALOR Y TEMPERATURA - 2año - CS - Cardenas VDocumento10 páginasTP N°2 - CALOR Y TEMPERATURA - 2año - CS - Cardenas VIgnacio Montaña8Aún no hay calificaciones
- Catálogo Animal para El Parque Zoológico de HuachipaDocumento5 páginasCatálogo Animal para El Parque Zoológico de HuachipaMás que PatasAún no hay calificaciones
- Borrador Biodiesel Con Aceite Residual de CocinaDocumento24 páginasBorrador Biodiesel Con Aceite Residual de CocinaJuan RomeroAún no hay calificaciones
- Hoja de Seguridad Pinturas A Base de AguaDocumento5 páginasHoja de Seguridad Pinturas A Base de AguaNESTOR RAUL BERGANO HERRERA100% (1)
- Lab 3 TermodinamicaDocumento8 páginasLab 3 TermodinamicaPedro Hector Ignacio VillalobosAún no hay calificaciones
- BitacoraDocumento5 páginasBitacoraErick Fernando ChanchavacAún no hay calificaciones
- Brazo HidraulicoDocumento12 páginasBrazo HidraulicoEro Emir Cravioto ContrerasAún no hay calificaciones
- Fluidos no Newtonianos: qué son y cómo se creanDocumento6 páginasFluidos no Newtonianos: qué son y cómo se creanAnaMoraMeyer0% (1)
- Introduccion A La Presión Hidrostatica PDFDocumento14 páginasIntroduccion A La Presión Hidrostatica PDFricardoad23100% (1)
- Determinacion de La Viscosidad de Un Fluido Usando Viscosimetro de Tubo Capilar 1 PDFDocumento19 páginasDeterminacion de La Viscosidad de Un Fluido Usando Viscosimetro de Tubo Capilar 1 PDFClaudia MendozaAún no hay calificaciones
- La Mano HidraulicaDocumento33 páginasLa Mano HidraulicaEdwinMaldonadoAún no hay calificaciones
- Informe Brazo HidraulicoDocumento4 páginasInforme Brazo HidraulicoKatherine ArmasAún no hay calificaciones
- Informe Brazo HidraulicoDocumento19 páginasInforme Brazo HidraulicoDymateo Conquien100% (2)
- Acuifero GuaraniDocumento3 páginasAcuifero GuaraniKaren DaviesAún no hay calificaciones
- 267 EletroDocumento4 páginas267 EletroRichard Andrew Grisales CastellanosAún no hay calificaciones
- Trabajo Individual Agua Disolvente UniversalDocumento27 páginasTrabajo Individual Agua Disolvente UniversalSALAS2131Aún no hay calificaciones
- Informe 2 Cambio de Fase Del Hielo SecoDocumento7 páginasInforme 2 Cambio de Fase Del Hielo SecoVanesaMontañaAún no hay calificaciones
- Ciclos Del AguaDocumento3 páginasCiclos Del AguaYaseniMoreno100% (1)
- BarómetroDocumento2 páginasBarómetroCarlos SantizoAún no hay calificaciones
- Mapa Conceptual Mecanica de FluidosDocumento4 páginasMapa Conceptual Mecanica de FluidospabelAún no hay calificaciones
- Investigacion Sobre La Presion Atmosferica Edgardo GuerreroDocumento8 páginasInvestigacion Sobre La Presion Atmosferica Edgardo GuerreroEdgardo Guerrero GodoyAún no hay calificaciones
- Actividad SOPA DE LETRASDocumento2 páginasActividad SOPA DE LETRASVictor EmmanuelAún no hay calificaciones
- Informe Principio de PascalDocumento3 páginasInforme Principio de PascalssssttttttAún no hay calificaciones
- TP Principio de PascalDocumento5 páginasTP Principio de PascalFelipe Nehuen RodriguezAún no hay calificaciones
- Calor Latente de Fusion - Ejercicios PropuestosDocumento1 páginaCalor Latente de Fusion - Ejercicios PropuestosJose Adalberto Sarricolea ValenciaAún no hay calificaciones
- Ambiente operacional y factores de estrés en plantasDocumento59 páginasAmbiente operacional y factores de estrés en plantasVianis Ibeth Gomez Arias100% (1)
- Práctica de GloboDocumento4 páginasPráctica de GloboJesús Francisco Ramírez Cruz100% (1)
- Arañas de importancia médica en ArgentinaDocumento11 páginasArañas de importancia médica en ArgentinaAdonai SalaAún no hay calificaciones
- Instrucciones visuales para armar un DanboDocumento3 páginasInstrucciones visuales para armar un DanboGustavo Alonso Garcia LopezAún no hay calificaciones
- Cando Eddy Consulta Ing - Automotriz NRC 8163.Documento8 páginasCando Eddy Consulta Ing - Automotriz NRC 8163.Agustin MauricioAún no hay calificaciones
- Practica 1 - Grupo 2Documento31 páginasPractica 1 - Grupo 2Hansel Enmanuel Bonilla LizardoAún no hay calificaciones
- Determinación densidad picnómetroDocumento9 páginasDeterminación densidad picnómetroWilmerAlbertoCáceresGuillénAún no hay calificaciones
- Consejos para Ahorrar Energía Eléctrica y Cuidar El Medio AmbienteDocumento4 páginasConsejos para Ahorrar Energía Eléctrica y Cuidar El Medio AmbienteJL32Aún no hay calificaciones
- Proyecto ExperimentoDocumento7 páginasProyecto ExperimentobrayanAún no hay calificaciones
- ULTIMO QUIZZ tERMODDocumento1 páginaULTIMO QUIZZ tERMODBeatriz Mayda Sanca Morochara0% (1)
- ANEXODocumento2 páginasANEXOquiksilver21Aún no hay calificaciones
- Aplicaciones en La Vida DiariaDocumento3 páginasAplicaciones en La Vida DiariaJesús Argandoña Aguirre67% (3)
- CALORIMETRODocumento2 páginasCALORIMETROALAN GONZALEZ TERRAZASAún no hay calificaciones
- Graficos BotellaDocumento4 páginasGraficos BotellaMiguel G. VélezAún no hay calificaciones
- Laboratorio de Energia - DensidadDocumento15 páginasLaboratorio de Energia - DensidadOmar Antonio Arango FloresAún no hay calificaciones
- Mano Hidráulica 2Documento16 páginasMano Hidráulica 2marion grandonAún no hay calificaciones
- Experimento de FisícaDocumento3 páginasExperimento de FisícaMaria Jose Baquero GuerraAún no hay calificaciones
- HidrostaticaDocumento3 páginasHidrostaticazulmaqv1Aún no hay calificaciones
- Estado de Clima de PR CCCPR - ResumenEjecutivo 2010-2013Documento28 páginasEstado de Clima de PR CCCPR - ResumenEjecutivo 2010-2013LOLA CostaneraAún no hay calificaciones
- Práctica 1 - Principio de ArquímedesDocumento8 páginasPráctica 1 - Principio de ArquímedespinksiderdAún no hay calificaciones
- Litro de LuzDocumento13 páginasLitro de LuzPamela Acosta GerraAún no hay calificaciones
- Aplicaciones de crecimiento fundamentos de fluidosDocumento1 páginaAplicaciones de crecimiento fundamentos de fluidosJOSE DANIEL GOMEZ ALVAREZ0% (1)
- Leyes de Gases IdealesDocumento13 páginasLeyes de Gases IdealesNidi MejiaAún no hay calificaciones
- Principio de ArquímedesDocumento11 páginasPrincipio de ArquímedesAlexander FloresAún no hay calificaciones
- Transferencia de calor por conducción, convección y radiaciónDocumento15 páginasTransferencia de calor por conducción, convección y radiaciónMiguel MottaAún no hay calificaciones
- Energia HidricaDocumento28 páginasEnergia Hidricadaact callasAún no hay calificaciones
- Principio de Pascal 1Documento2 páginasPrincipio de Pascal 1Emilio Castillo TamayoAún no hay calificaciones
- Funcionamiento Del Sistema de RefrigeraciónDocumento7 páginasFuncionamiento Del Sistema de RefrigeraciónrojasjosAún no hay calificaciones
- MétodoCientíficoDocumento5 páginasMétodoCientíficoCésar Antonio R PAún no hay calificaciones
- Presión manométrica y diferencial en sistemas de fluidosDocumento1 páginaPresión manométrica y diferencial en sistemas de fluidostito pazAún no hay calificaciones
- Biorreactores para El Cultivo de Células de Animales y PlantasDocumento37 páginasBiorreactores para El Cultivo de Células de Animales y PlantasRicardoAún no hay calificaciones
- Solucion Problema 4 IntercambiadoresDocumento4 páginasSolucion Problema 4 IntercambiadoresGabriela BuendiaAún no hay calificaciones
- Mecanica Fluidos Tarea 01Documento2 páginasMecanica Fluidos Tarea 01Gerardo Lozano0% (3)
- Teoría Cinética de Los GasesDocumento12 páginasTeoría Cinética de Los GasesQui SánchezAún no hay calificaciones
- Agua Fresca Sin Gastar EnergíaDocumento10 páginasAgua Fresca Sin Gastar EnergíaPatricio Torres InostrozaAún no hay calificaciones
- Cambio Climático ExperimentosDocumento8 páginasCambio Climático Experimentosiactinspain67% (3)
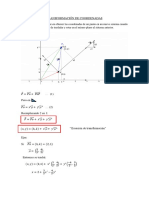
- Transformación de CoordenadasDocumento3 páginasTransformación de CoordenadasJimy el rosqueteAún no hay calificaciones
- Rne Grupo 14Documento6 páginasRne Grupo 14VALERY RENGIFOAún no hay calificaciones
- MODULO 2 Filosofia UncausDocumento7 páginasMODULO 2 Filosofia UncausMarcelo FleitaAún no hay calificaciones
- Diagnostico - Caminos - 9930Documento15 páginasDiagnostico - Caminos - 9930Franco Medina LlanosAún no hay calificaciones
- Malla Curricular Ciencias 2013 Biologia Quimica y FisicaDocumento13 páginasMalla Curricular Ciencias 2013 Biologia Quimica y Fisicadarkan22Aún no hay calificaciones
- Pact. Preoperatorio Esquema LlaveDocumento3 páginasPact. Preoperatorio Esquema LlaveLizeth Johanny Huaypar RamosAún no hay calificaciones
- Ficha-Tecnica-policarbonato ALVEOLAR - Glanze 2019 PDFDocumento2 páginasFicha-Tecnica-policarbonato ALVEOLAR - Glanze 2019 PDFEdwin Ronald ChukeAún no hay calificaciones
- Análisis de material de subbase granular para vía secundariaDocumento2 páginasAnálisis de material de subbase granular para vía secundariaFabio Garzón BernalAún no hay calificaciones
- Procesos de reproducción asexual y sexualDocumento7 páginasProcesos de reproducción asexual y sexualmguadalupe2Aún no hay calificaciones
- Envejecimiento Poblacional PDFDocumento4 páginasEnvejecimiento Poblacional PDFAlfonsina AlbornozAún no hay calificaciones
- 3-Abas - Captacion de FondoDocumento4 páginas3-Abas - Captacion de FondoCarlos Maldonado Lopez100% (1)
- Determinacion de Azufre en DieselDocumento10 páginasDeterminacion de Azufre en DieselLaboratorio TLPAún no hay calificaciones
- Riesgos y medidas de seguridad en maquinaria de construcciónDocumento4 páginasRiesgos y medidas de seguridad en maquinaria de construcciónJose Randolph Rodriguez HuamaniAún no hay calificaciones
- Práctica Solicitaciones Internas para PublicarDocumento11 páginasPráctica Solicitaciones Internas para PublicarBrian OeschgerAún no hay calificaciones
- La Voz De La Sangre Vampiros 01 - Jemiah JeffersonDocumento190 páginasLa Voz De La Sangre Vampiros 01 - Jemiah Jeffersonvarias tareasAún no hay calificaciones
- CancioneroDocumento5 páginasCancioneroNatalí MirandaAún no hay calificaciones
- Apuntes de Fisicoquimica UtemDocumento110 páginasApuntes de Fisicoquimica UtemAlan Cereceda EscalonaAún no hay calificaciones
- Libro MalvicheDocumento5 páginasLibro MalvicheAlexAnderAngeloAún no hay calificaciones
- 2016-03 Top Value Computing v1 PDFDocumento24 páginas2016-03 Top Value Computing v1 PDFJaime TraverAún no hay calificaciones
- Investigacion Dise o Con Disipadores ASCE 7-10Documento259 páginasInvestigacion Dise o Con Disipadores ASCE 7-10Anonymous ENkZKEXwRAún no hay calificaciones
- Aristóteles La Ética A NicómacoDocumento6 páginasAristóteles La Ética A NicómacoBeatriz LasherasAún no hay calificaciones
- Balance de Materia PortafolioDocumento73 páginasBalance de Materia Portafolioselena suarezAún no hay calificaciones
- Taller 4Documento30 páginasTaller 4John CoronadoAún no hay calificaciones
- SERIAMOS OBJETOSDocumento16 páginasSERIAMOS OBJETOSSueña Desea ObtendrásAún no hay calificaciones
- Ben Cil Piper A ZinaDocumento12 páginasBen Cil Piper A ZinaMoises Valdivia BaldomeroAún no hay calificaciones
- González García, Agalmatofilia PDFDocumento20 páginasGonzález García, Agalmatofilia PDFArturo García ToralAún no hay calificaciones
- Contenidos Carretillas ElevatorasDocumento122 páginasContenidos Carretillas Elevatorasneamt59100% (1)