Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Problemas Enzimas 2
Cargado por
Kamila KbelloDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Problemas Enzimas 2
Cargado por
Kamila KbelloCopyright:
Formatos disponibles
CURSO QUIMICA CLINICA GENERAL
LABORATORIO CLINICO Y PATOLOGIA
PROBLEMAS ENZIMAS
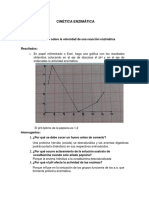
1. En cierto estudio de la enzima ribonucleasa A, se obtuvieron datos de dos
isoenzimas, denominadas Isoenzima I e Isoenzima II. Se midió la velocidad
inicial de la reacción a varias concentraciones de sustrato. Para ambas
isoenzimas la concentración de enzima total usada en los ensayos fue de 0.1
M a partir de los datos de actividad se calcularon los parámetros cinéticos,
que se presentan a continuación. Dato Kcat=Vmax/ [Et]
2.
Vmax (M / min) Km (mM)
Isoenzima I 100 10
Isoenzima II 10 0.1
¿Cuál de las dos enzimas presentará menor eficiencia catalítica y cuál de ellas
presentará el mayor número de recambio? Sustentar su respuesta.
3. Ejemplo: En un experimento de laboratorio usted completó un estudio de
cinética enzimática, obteniendo los siguientes resultados:
Calcular el Km y la velocidad máxima, hacer los gráficos en papel milimétrico o
Excel para Michaelis & Menten y plot de las inversas (Lineweaver & Burk).
[S] (Molar) Vo (Molar/min) 1/[S] 1/Vo
1 40
5 75
15 91
40 96
65 98
80 98,5
90 99
100 100
4. La actividad de la enzima Ciclooxigenasa sobre el ácido Araquidonico es muy
importante para la formación de prostaglandinas (hormona de señal corta
responsable del dolor e inflamación), en un experimento la enzima
Ciclooxigenasa y su sustrato el ácido Araquidonico fueron sometidos a la
acción inhibidora de un fármaco llamado Ibuprofeno, obteniéndose los
siguientes valores indicados en la Tabla. Determinar los Kms respectivos, así
como la velocidad máxima sin inhibidor y con inhibidor, así mismo determine
qué tipo de inhibidor es el Ibuprofeno, realizar los gráficos en papel milimétrico
o Excel para Michaelis & Menten y plot de las inversas (Lineweaver & Burk).
CURSO QUIMICA CLINICA GENERAL
LABORATORIO CLINICO Y PATOLOGIA
Sustrato E+S E+S+I E+S E+S+I
[S] (Molar) Vo (Molar/min) Vo (Molar/min) 1/[S] 1/Vo 1/Vo
0.5 23.5 16.07
1 32.2 25.25
1.5 36.9 30.49
2.5 41.8 37.04
3.5 44.0 38.91
4.- La enzima muscular Lactato deshidrogenasa cataliza la siguiente reacción:
LD
NADH y NAD+ son la forma reducida y oxidada respectivamente, de la
coenzima NAD, las disoluciones de NADH, pero no las de NAD+, absorben luz
a 340nm. Esta propiedad se utiliza para determinar la concentración de NADH
en disolución midiendo espectrofometricamente la absorbancia a 340 nm.
Explique cómo se puede utilizar esta propiedad del NADH para diseñar
métodos para determinar cuantitativamente la actividad de Lactato
deshidrogenasa, así como de otras enzimas en la cual dentro de la
estequiometria de la reacción no se encuentra el NADH ni el NAD+.
5.- En el laboratorio Clínico es muy importante entender cómo obtenemos los
resultados de actividad enzimática, siempre utilizamos el promedio del cambio
de absorbancia (ΔA), y lo multiplicamos por un factor ya predispuesto por el kit
que estamos utilizando, sin embargo, que hay detrás de ese factor ¿cómo? es
calculado realmente, la mayoría desconoce que parámetros intervienen en ello.
Por ello en el siguiente ejemplo para una reacción catalizada por la enzima
Alanina Amino Transferasa GPT (ALT), calcular la actividad enzimática, en
una muestra de suero en Unidades Internacionales por litro (UI/L) y cuál
sería el factor para este ensayo enzimático, si quisiéramos implementarlo
como un kit.
Utilizar los siguientes datos:
Coeficiente de absortividad molecular NADH a 340nm=6.22x103 L/mol x cm
Longitud de la cubeta= 1 cm
Volumen de suero= 20 uL
Volumen de reactivo=3.0 mL
CURSO QUIMICA CLINICA GENERAL
LABORATORIO CLINICO Y PATOLOGIA
Tiempo Absorbancia
1 min 1.104
2 min 1.025
3 min 0.950
4 min 0.873
También podría gustarte
- Problemas EnzimasDocumento5 páginasProblemas EnzimasKevin O. BallardoAún no hay calificaciones
- Ejercicios de Cinetica EnzimaticaDocumento28 páginasEjercicios de Cinetica EnzimaticaJose Orbegoso LopezAún no hay calificaciones
- Seminario 5Documento4 páginasSeminario 5Mar ValenciaAún no hay calificaciones
- Informe Cinetica EnzimaticaDocumento10 páginasInforme Cinetica EnzimaticaMarcelo CucasAún no hay calificaciones
- Practica 2Documento9 páginasPractica 2Andrés SerranoAún no hay calificaciones
- Laboratorio de Actividad EnzimáticaDocumento17 páginasLaboratorio de Actividad EnzimáticaMariaHelenaAún no hay calificaciones
- Taller Parcial 1Documento5 páginasTaller Parcial 1William Camilo Díaz GonzálezAún no hay calificaciones
- Informe Práctica 4 BioquímicaDocumento5 páginasInforme Práctica 4 BioquímicaJUAN DANIEL RUELAS HUAMANAún no hay calificaciones
- Cinética Enzimática Jesaya Rios.mDocumento12 páginasCinética Enzimática Jesaya Rios.mJesaya RiosAún no hay calificaciones
- Cinetica EnzimaticaDocumento50 páginasCinetica EnzimaticaMARIA DEL PILAR SANCHEZ VALDEZAún no hay calificaciones
- Informe Final Tirosinasa - Fosfatasa PDFDocumento21 páginasInforme Final Tirosinasa - Fosfatasa PDFcamilo432100% (1)
- UntitledDocumento8 páginasUntitledJorgeAún no hay calificaciones
- Practica N°7 Lili LpezDocumento9 páginasPractica N°7 Lili LpezLili LopezAún no hay calificaciones
- Taller 2. Catálisis EnzimáticaDocumento2 páginasTaller 2. Catálisis EnzimáticaANA MARIA ARANGO SEPULVEDAAún no hay calificaciones
- Probl CineticaDocumento3 páginasProbl Cineticaputa materia0% (1)
- Informe de Actividad EnzimaticaaaaaaDocumento22 páginasInforme de Actividad Enzimaticaaaaaalizbet perez mezaAún no hay calificaciones
- Whidalgo - Taller EnzimasDocumento5 páginasWhidalgo - Taller EnzimasAllan DuranAún no hay calificaciones
- Taller I - Bioquímica (Química-Farmacia)Documento8 páginasTaller I - Bioquímica (Química-Farmacia)Oscar Andres Pinzon GarciaAún no hay calificaciones
- Práctica 2Documento7 páginasPráctica 2ppchuy344Aún no hay calificaciones
- Introduccion A Las EnzimasDocumento7 páginasIntroduccion A Las EnzimasManuel Alejandro PeñafielAún no hay calificaciones
- Coloquio 5Documento13 páginasColoquio 5Alex AlustizaAún no hay calificaciones
- Cuestionario 2 Enzimas 2023Documento3 páginasCuestionario 2 Enzimas 2023karmaAún no hay calificaciones
- Taller Cin EnzDocumento4 páginasTaller Cin EnzDaniel Alonso De Gracia SantiagoAún no hay calificaciones
- Cinética enzimática y regulación enzimáticaDocumento5 páginasCinética enzimática y regulación enzimáticaRené PonceAún no hay calificaciones
- Práctica #4Documento7 páginasPráctica #4Erick NestaresAún no hay calificaciones
- Resumen Analitico en Educacion RaeDocumento8 páginasResumen Analitico en Educacion RaeJorge Alberto Carrillo BernalAún no hay calificaciones
- CINÉTICA ENZIMÁTICA Y FACTORES QUE AFECTAN LA ACTIVIDAD ENZIMÁTICA InformeDocumento10 páginasCINÉTICA ENZIMÁTICA Y FACTORES QUE AFECTAN LA ACTIVIDAD ENZIMÁTICA InformePaula Michelle PolaniaAún no hay calificaciones
- Practica Concentracion de EnzimaDocumento4 páginasPractica Concentracion de EnzimaDante LlerenaAún no hay calificaciones
- Rxns EnzDocumento7 páginasRxns EnzLuis Gustavo Nolasco LeónAún no hay calificaciones
- Proteínas y EnzimasDocumento7 páginasProteínas y Enzimasmaria100% (1)
- ADA 2. Enzimas y BioenergéticaDocumento13 páginasADA 2. Enzimas y BioenergéticaPerla EstrellaAún no hay calificaciones
- Reporte Cinética Enzimática ACTUAL 2023-1Documento9 páginasReporte Cinética Enzimática ACTUAL 2023-1Alta Gracia ArguellesAún no hay calificaciones
- Informe 4 Actividad EnzimaticaDocumento8 páginasInforme 4 Actividad EnzimaticaAnniee FelizAún no hay calificaciones
- Ejercicios Cinetica EnzimaticaDocumento4 páginasEjercicios Cinetica EnzimaticaAlejandra PeñaAún no hay calificaciones
- Laboratorio N°4 - Inhibición de La Actividad Enzimática en Procesos de TransformaciónDocumento16 páginasLaboratorio N°4 - Inhibición de La Actividad Enzimática en Procesos de TransformaciónPaula Camila Baron Tovar100% (1)
- Determinación de La Actividad Enzimática de La Peroxidasa Extraída de Hojas de PlantaDocumento6 páginasDeterminación de La Actividad Enzimática de La Peroxidasa Extraída de Hojas de PlantaSiju NaraAún no hay calificaciones
- 2 Enzimologia Y BioenergeticaDocumento50 páginas2 Enzimologia Y BioenergeticaJuliio CesarAún no hay calificaciones
- Curvas Patrón - Evaluación Cuantitativa 2030Documento21 páginasCurvas Patrón - Evaluación Cuantitativa 2030Johana Sierra BernalAún no hay calificaciones
- TPDocumento4 páginasTPAlfonso PepeAún no hay calificaciones
- Estudio de las peroxidasas en distintas fuentes vegetalesDocumento9 páginasEstudio de las peroxidasas en distintas fuentes vegetalesDany PandaAún no hay calificaciones
- Determinación KM Vmax Fosfatasa Ácida Hígado PolloDocumento3 páginasDeterminación KM Vmax Fosfatasa Ácida Hígado PolloDayanna MendozaAún no hay calificaciones
- Taller de EnzimasDocumento5 páginasTaller de EnzimasKevin ParraAún no hay calificaciones
- Problemas de Enzimas. AGRONOMÍA 2015Documento3 páginasProblemas de Enzimas. AGRONOMÍA 2015andrewn21Aún no hay calificaciones
- Guía Enzimas BioquímicaDocumento2 páginasGuía Enzimas BioquímicaAntonia Madrid100% (1)
- Taller 2015-IDocumento6 páginasTaller 2015-IBRAYAN ALEXIS DE SOUSA LORAAún no hay calificaciones
- Clase Práctica No.18 Cap. III EnzimasDocumento9 páginasClase Práctica No.18 Cap. III EnzimasAiden PalafoxAún no hay calificaciones
- Factores Que Influyen en La Actividad EnzimáticaDocumento5 páginasFactores Que Influyen en La Actividad EnzimáticaDIANA CAROLINA RIOS VASQUEZAún no hay calificaciones
- Cinética Enzimática - Pareja Maria 1Documento13 páginasCinética Enzimática - Pareja Maria 1MariaAún no hay calificaciones
- Reporte P5.equipo#11Documento7 páginasReporte P5.equipo#11Reyes Martínez Pamela MontserrathAún no hay calificaciones
- Problemas Aqf Tema7 Inhibicion 19may13Documento4 páginasProblemas Aqf Tema7 Inhibicion 19may13Juan Gabriel FernándezAún no hay calificaciones
- Practica Nº2Documento5 páginasPractica Nº2xchinodanyAún no hay calificaciones
- Lectura Sesion 2. EnzimasDocumento8 páginasLectura Sesion 2. EnzimasCamila MoralesAún no hay calificaciones
- Actividad catalasa Solanum tuberosumDocumento7 páginasActividad catalasa Solanum tuberosumPiero Juarez100% (1)
- Reporte de Laboratorio BMDocumento11 páginasReporte de Laboratorio BMwj tjAún no hay calificaciones
- LDH GGTDocumento13 páginasLDH GGTKatherine Laveriano Solis100% (1)
- BiocatalisisDocumento8 páginasBiocatalisisAlejandraAún no hay calificaciones
- Guía LABORATORIO 3 PDFDocumento4 páginasGuía LABORATORIO 3 PDFCamila Javiera VergaraAún no hay calificaciones
- Cinetica Enzimatica Ejercicios ResueltosDocumento26 páginasCinetica Enzimatica Ejercicios Resueltospvv1963100% (1)
- Duration of SARSCoV-2 InfectivityDocumento8 páginasDuration of SARSCoV-2 InfectivityKamila KbelloAún no hay calificaciones
- Proteinas Totales y FraccionadasDocumento3 páginasProteinas Totales y FraccionadasKamila Kbello100% (1)
- Lectura ElispotDocumento3 páginasLectura ElispotKamila KbelloAún no hay calificaciones
- 144683-Text de L'article-254294-1-10-20100602Documento6 páginas144683-Text de L'article-254294-1-10-20100602Kamila KbelloAún no hay calificaciones
- Calculadora de NotasDocumento2 páginasCalculadora de NotasKamila KbelloAún no hay calificaciones
- Formato Trabajo de InvestigaciónDocumento3 páginasFormato Trabajo de InvestigaciónKamila KbelloAún no hay calificaciones
- Expo Colecisto ColedocolitiasisDocumento30 páginasExpo Colecisto ColedocolitiasisKamila KbelloAún no hay calificaciones
- 144683-Text de L'article-254294-1-10-20100602Documento6 páginas144683-Text de L'article-254294-1-10-20100602Kamila KbelloAún no hay calificaciones
- DS012 2013 SA EP C PDFDocumento62 páginasDS012 2013 SA EP C PDFKamila KbelloAún no hay calificaciones
- Tema 1 - El Laboratorio de Anatomia PatológicaDocumento11 páginasTema 1 - El Laboratorio de Anatomia PatológicachemallinkyAún no hay calificaciones
- Excitación y Contracción de Musculo Cardiaco PDFDocumento5 páginasExcitación y Contracción de Musculo Cardiaco PDFCarolina FaleraAún no hay calificaciones
- Medula EspinalDocumento7 páginasMedula EspinalKamila KbelloAún no hay calificaciones
- 144683-Text de L'article-254294-1-10-20100602Documento6 páginas144683-Text de L'article-254294-1-10-20100602Kamila KbelloAún no hay calificaciones
- Material de Clase 11. El Texto ExpositivoDocumento10 páginasMaterial de Clase 11. El Texto ExpositivoKamila KbelloAún no hay calificaciones
- Lecturas de Barreras de ComunicaciónDocumento4 páginasLecturas de Barreras de ComunicaciónKamila KbelloAún no hay calificaciones
- Técnicas de La ComunicaciónDocumento169 páginasTécnicas de La ComunicaciónNathalia CardonaAún no hay calificaciones
- Practica 7 Tec MoleDocumento2 páginasPractica 7 Tec MoleSofia CuevasAún no hay calificaciones
- Ciclo de Krebs Guía de EstudioDocumento3 páginasCiclo de Krebs Guía de EstudioElda Fernanda MatosAún no hay calificaciones
- Enzimas de Restricción Nov2020Documento42 páginasEnzimas de Restricción Nov2020jhonatan ascanioAún no hay calificaciones
- Actividad EnzimáticaDocumento15 páginasActividad EnzimáticaUSMP FN ARCHIVOSAún no hay calificaciones
- Maldonado Analisis Informatico de Cinetica Enzimatica Por Medio de Macros de Ms ExcelDocumento0 páginasMaldonado Analisis Informatico de Cinetica Enzimatica Por Medio de Macros de Ms ExcelXimi Mena XiAún no hay calificaciones
- Diapositivas Enzimas IDocumento18 páginasDiapositivas Enzimas IEVELYN ARIVILCA NINAAún no hay calificaciones
- Clase EnzimasDocumento55 páginasClase Enzimasadolfo moralesAún no hay calificaciones
- EnzimasDocumento95 páginasEnzimas3F Rodríguez Alcocer NataliaAún no hay calificaciones
- 6.inhibición Irreversible y Cooperativa PDFDocumento8 páginas6.inhibición Irreversible y Cooperativa PDFfernanda Anabella lobos Moreira100% (1)
- Cinetica Quimica y Biologica - Ing Bioq.Documento9 páginasCinetica Quimica y Biologica - Ing Bioq.Fernanda Vegga0% (1)
- Demostracion de ActividadenzimaticaDocumento8 páginasDemostracion de ActividadenzimaticaDiaz Siesquen LeslyAún no hay calificaciones
- Enzimas: catalizadores biológicosDocumento35 páginasEnzimas: catalizadores biológicosscancian2000Aún no hay calificaciones
- Mecanismos de las enzimas para facilitar la catalisisDocumento1 páginaMecanismos de las enzimas para facilitar la catalisisAna ReyesAún no hay calificaciones
- EnzimasDocumento5 páginasEnzimasAdrian LeónAún no hay calificaciones
- Efecto de la temperatura en las enzimasDocumento36 páginasEfecto de la temperatura en las enzimasHarold JoseAún no hay calificaciones
- Cinética enzimática: problemas de Michaelis-Menten y cinética competitivaDocumento1 páginaCinética enzimática: problemas de Michaelis-Menten y cinética competitivaJeffry Daza CorzoAún no hay calificaciones
- ENZIMASDocumento31 páginasENZIMASpablo escobarAún no hay calificaciones
- Problen Zimas MHDocumento6 páginasProblen Zimas MHGaby BorjaAún no hay calificaciones
- EnzimasDocumento55 páginasEnzimasgabrielaibetacostadeledesmaAún no hay calificaciones
- Problemario Cinética Enzimática UpibiDocumento8 páginasProblemario Cinética Enzimática UpibiLillian Alexa González IslasAún no hay calificaciones
- Problemas Enzimas 2Documento3 páginasProblemas Enzimas 2Kamila KbelloAún no hay calificaciones
- Velocidad de Reaccion Enzimatica 2023aDocumento20 páginasVelocidad de Reaccion Enzimatica 2023aHUERTA ESPINOZA LESSLYAún no hay calificaciones
- Bioquimica 57 Enzimologia y Bioenergetica DanielaMoralesDocumento11 páginasBioquimica 57 Enzimologia y Bioenergetica DanielaMoralesNestor Perea GamboaAún no hay calificaciones
- Ejercicios Cinética EnzimáticaDocumento6 páginasEjercicios Cinética EnzimáticaSambita MaryAún no hay calificaciones
- Bioquímica y Metabolismo Humano, Dr. Samuel Román Ledesma: Actividades para Clase Numero 3 EnzimasDocumento8 páginasBioquímica y Metabolismo Humano, Dr. Samuel Román Ledesma: Actividades para Clase Numero 3 EnzimasYeniffer S. SanchezAún no hay calificaciones
- 05 EnzimasDocumento7 páginas05 Enzimasbeabergamo87Aún no hay calificaciones
- EnzimasDocumento9 páginasEnzimastech_teacher100% (13)
- Practica 2 VIRTUAL. Actividad Enzimatica de La AmilasaDocumento8 páginasPractica 2 VIRTUAL. Actividad Enzimatica de La AmilasaVALENTINA JIMENEZ HERNANDEZAún no hay calificaciones
- En ZimasDocumento21 páginasEn ZimasVictor Temponi100% (1)
- Cinética Química: Catálisis HeterogéneaDocumento5 páginasCinética Química: Catálisis HeterogéneaDan MoralesAún no hay calificaciones