Documentos de Académico
Documentos de Profesional
Documentos de Cultura
U1 - S1 - 3.ejercicios Resueltos Con Redox
Cargado por
GIANCARLO ALANIZ0 calificaciones0% encontró este documento útil (0 votos)
66 vistas1 páginaEste documento trata sobre reacciones redox en química inorgánica. Explica cómo determinar los estados de oxidación de elementos químicos en compuestos, identificar agentes oxidantes y reductores, y verificar que una reacción es redox mediante el cálculo de los estados de oxidación antes y después de la reacción. También muestra ejemplos numéricos de cálculos relacionados con reacciones redox.
Descripción original:
U1_S1_3.Ejercicios Resueltos Con Redox química inorgánica
Título original
U1_S1_3.Ejercicios Resueltos Con Redox
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento trata sobre reacciones redox en química inorgánica. Explica cómo determinar los estados de oxidación de elementos químicos en compuestos, identificar agentes oxidantes y reductores, y verificar que una reacción es redox mediante el cálculo de los estados de oxidación antes y después de la reacción. También muestra ejemplos numéricos de cálculos relacionados con reacciones redox.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
66 vistas1 páginaU1 - S1 - 3.ejercicios Resueltos Con Redox
Cargado por
GIANCARLO ALANIZEste documento trata sobre reacciones redox en química inorgánica. Explica cómo determinar los estados de oxidación de elementos químicos en compuestos, identificar agentes oxidantes y reductores, y verificar que una reacción es redox mediante el cálculo de los estados de oxidación antes y después de la reacción. También muestra ejemplos numéricos de cálculos relacionados con reacciones redox.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
QUIMICA INORGANICA
UNIDAD 1: Reacciones Redox
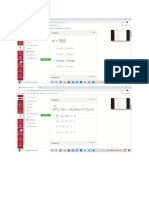
1. Determine el estado de oxidación de los elementos químicos remarcados con
negrita en los siguientes compuestos o especies químicas:
a. Fe(NO3)3 b. Na2Zn O2 c. Ni (ClO4)3 d) (MnO4)2-
Solución:
a) Fe3+ O2- N5+ b) Na+ O2- Zn2+
c) Ni+3 O2- Cl7+ d) O2- Mn6+
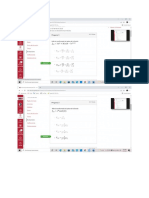
2. El ácido hipocloroso (HClO) reacciona con NaCl según la siguiente reacción:
HClO + NaCl → NaClO + H2O + Cl2
a. Determine el agente oxidante y el reductor sabiendo que el grupo
hipoclorito y el cloruro se transforman en cloro gaseoso.
b. ¿Cuántos gramos de HClO se requiere para producir 112 litros de gas cloro
medido en condiciones normales?
Solución:
a) El agente oxidante es el hipoclorito ya que el cloro de 7+ pasa a cloro 0 y el
reductor es el cloruro de sodio pasando el cloro de 1- a 0.
b) 2 HClO + NaCl → NaClO + H2O + Cl2
105g 22,5L (cn)
Xg 112L
X= 522,67g
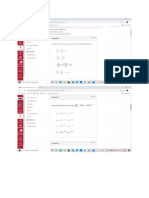
3. Comprobar que la reacción de formación de hierro: Fe 2O3 + 3 CO 2 Fe + 3 CO2
es una reacción redox. Indicar los E.O. de todos los elementos antes y después de la
reacción.
Solución:
E.O.: +3 –2 +2 –2 0 +4 –2
Fe2O3 + 3 CO 2 Fe + 3 CO2
Reducción: El Fe disminuye su E.O. de “+3” a “0” luego se reduce (cada átomo de Fe
captura 3 electrones).
Oxidación: El C aumenta su E.O. de “+2” a “+4” luego se oxida (en este caso pasa de
compartir 2e– con el O a compartir los 4 electrones).
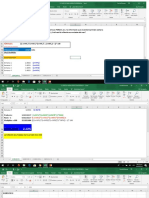
4. Indicar los E.O. de todos los elementos de la reacción.
KMnO4 + H2SO4 + KI MnSO4 + I2 + K2SO4 + H2O.
Solución:
+1+7 –2 +1+6 –2 +1–1 +2 +6 –2 0 +1 +6 –2 +1 –2
KMnO4 + H2SO4 + KI MnSO4 + I2 + K2SO4 + H2O
También podría gustarte
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Unidad 2 REDOXDocumento54 páginasUnidad 2 REDOXCatalina CelisAún no hay calificaciones
- Oxido Reducción Parte 1Documento44 páginasOxido Reducción Parte 1Mad KingAún no hay calificaciones
- Solucionestema 1o Oxi ReducoDocumento20 páginasSolucionestema 1o Oxi Reducorosa100% (1)
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Eacciones Oxidacion Reduccion Transferencia ElectronesDocumento11 páginasEacciones Oxidacion Reduccion Transferencia ElectronesAMYNNXXXXAún no hay calificaciones
- Óxido-Reducción - PreguntasDocumento4 páginasÓxido-Reducción - PreguntasAngelina Aparicio tapiaAún no hay calificaciones
- Balance Redox Ion - Electrón 2021Documento37 páginasBalance Redox Ion - Electrón 2021FelicianoAún no hay calificaciones
- REDOXDocumento71 páginasREDOXJuan Sebastian Aranguren Angulo0% (1)
- Clase 10 Redox ReducidaDocumento52 páginasClase 10 Redox ReducidaIgnacio Barría Llanca100% (1)
- Semana 1 - Ejercicios Resueltos de Redox PDFDocumento3 páginasSemana 1 - Ejercicios Resueltos de Redox PDFErick NavarroAún no hay calificaciones
- Semana 1 - Ejercicios Resueltos de RedoxDocumento3 páginasSemana 1 - Ejercicios Resueltos de RedoxJUAN CARLOS DELGADO MEDINAAún no hay calificaciones
- Fisica IDocumento3 páginasFisica IMesha RockefellerAún no hay calificaciones
- Equilibrios RedoxDocumento18 páginasEquilibrios RedoxBryan VelasquezAún no hay calificaciones
- Igualacion Oxido-ReduccionDocumento8 páginasIgualacion Oxido-ReduccionVivi SaloAún no hay calificaciones
- Cuestiones Problemas RedoxDocumento43 páginasCuestiones Problemas Redoxrodolfob23Aún no hay calificaciones
- Clase Reacciones QuímicasDocumento26 páginasClase Reacciones QuímicasChapu Banderas Di CaprioAún no hay calificaciones
- RedoxDocumento12 páginasRedoxMatias Duran Del Valle100% (1)
- Reacciones de Óxido ReducciónDocumento26 páginasReacciones de Óxido ReducciónLicedAún no hay calificaciones
- Reacciones QuímicasDocumento28 páginasReacciones QuímicasErick ReyesAún no hay calificaciones
- Electroquímica Parte 1Documento20 páginasElectroquímica Parte 1SantiagoAún no hay calificaciones
- Guia Ejercicios RedoxDocumento4 páginasGuia Ejercicios RedoxMarxe PazAún no hay calificaciones
- Guía de RedoxDocumento7 páginasGuía de RedoxjavierAún no hay calificaciones
- Ejercicios de Balanceo Por Metodo Oxido Reducción y EstequiometriaDocumento6 páginasEjercicios de Balanceo Por Metodo Oxido Reducción y EstequiometriacafarosaAún no hay calificaciones
- Balanceo Ion Electron Acido y Basico Reaciones RedoxDocumento32 páginasBalanceo Ion Electron Acido y Basico Reaciones RedoxAnonymous JUTlOpL7Aún no hay calificaciones
- Rx. QuímicaDocumento10 páginasRx. QuímicaMaia TipismanaAún no hay calificaciones
- TEMA7Documento11 páginasTEMA7Catherine RealesAún no hay calificaciones
- Guía de Ácido Base-RedoxDocumento3 páginasGuía de Ácido Base-RedoxJoaquin Duvan Ortiz CasasAún no hay calificaciones
- Ejercicios Redox Con Solucion PDFDocumento5 páginasEjercicios Redox Con Solucion PDFFernando RamirezAún no hay calificaciones
- Ejercicios Redox Con SolucionDocumento5 páginasEjercicios Redox Con SolucionSuyapa Sierra AgueroAún no hay calificaciones
- Cartilla Grado 10° (Nivel II)Documento9 páginasCartilla Grado 10° (Nivel II)francofordiaAún no hay calificaciones
- Practica CuestionarioDocumento8 páginasPractica CuestionarioJanCarlosPinedoSolanoAún no hay calificaciones
- PRÁCTICA N 5 TareaDocumento13 páginasPRÁCTICA N 5 TareaMaykol MacedoAún no hay calificaciones
- Reacciones RedoxDocumento28 páginasReacciones RedoxEmilda GutiérrezVegaAún no hay calificaciones
- Balanceo de Ecuaciones Quimicas Por RedoxDocumento5 páginasBalanceo de Ecuaciones Quimicas Por RedoxRoberto SantiagoAún no hay calificaciones
- REDOXDocumento17 páginasREDOXagustinchoque560Aún no hay calificaciones
- Redox y La Aplicación de La Estequiometría PDFDocumento35 páginasRedox y La Aplicación de La Estequiometría PDFwilmer vargasAún no hay calificaciones
- RedoxDocumento47 páginasRedoxcamila CaroAún no hay calificaciones
- Capítulo 7Documento9 páginasCapítulo 7Axel Pullaguari CedeñoAún no hay calificaciones
- Cuestionario N°5Documento5 páginasCuestionario N°5Johan MendezAún no hay calificaciones
- 3.1 - Reacciones (TA)Documento3 páginas3.1 - Reacciones (TA)Percy JhonnAún no hay calificaciones
- Química BásicaDocumento8 páginasQuímica BásicaMauricio RemacheAún no hay calificaciones
- Redox Ion ElectronDocumento24 páginasRedox Ion ElectronROSARIOMARTINEZ25Aún no hay calificaciones
- Reacciones QuimicaDocumento4 páginasReacciones QuimicaLuis Jimenez Montañez0% (1)
- Redox QuímicaDocumento23 páginasRedox QuímicacristianAún no hay calificaciones
- Q.G. 15Documento7 páginasQ.G. 15Lizeth GraciaAún no hay calificaciones
- Guia RedoxDocumento8 páginasGuia RedoxjorgearandacorreaAún no hay calificaciones
- Unidad 2. Principios de ElectroquímicaDocumento9 páginasUnidad 2. Principios de ElectroquímicaElvis Anconeira ChecaAún no hay calificaciones
- Reacciones Quimicas II-1 PDFDocumento8 páginasReacciones Quimicas II-1 PDFartu9712Aún no hay calificaciones
- OAQ-Manual de Entrenamiento-Nivel 1-Serie 4Documento30 páginasOAQ-Manual de Entrenamiento-Nivel 1-Serie 4Patitas PatitasAún no hay calificaciones
- Clase 22 24 Reacciones REDOXDocumento44 páginasClase 22 24 Reacciones REDOXRodrigo Andres Calderon NaranjoAún no hay calificaciones
- ELECTROQUIMICADocumento49 páginasELECTROQUIMICAfelipeoviedo43610812Aún no hay calificaciones
- U2 - S4 - Ficha de Trabajo 4-Ejercicios Sobre Tipos y Balance de Reacciones QuímicasDocumento4 páginasU2 - S4 - Ficha de Trabajo 4-Ejercicios Sobre Tipos y Balance de Reacciones Químicasluder condori malagaAún no hay calificaciones
- Guía de Ejercicios RedoxDocumento11 páginasGuía de Ejercicios RedoxMac ArenaAún no hay calificaciones
- OpuhDocumento56 páginasOpuhQiaoqian ZhengAún no hay calificaciones
- Clase 1 Reacciones QuímicasDocumento28 páginasClase 1 Reacciones Químicasauristela sima pacayaAún no hay calificaciones
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Autoevaluación 4 - Calculo para La Toma de DecisionesDocumento4 páginasAutoevaluación 4 - Calculo para La Toma de DecisionesGIANCARLO ALANIZAún no hay calificaciones
- Autoevaluación 3 - Calculo para La Toma de DecisionesDocumento4 páginasAutoevaluación 3 - Calculo para La Toma de DecisionesGIANCARLO ALANIZAún no hay calificaciones
- Examen Final Pregunta 3b AAAADocumento2 páginasExamen Final Pregunta 3b AAAAGIANCARLO ALANIZAún no hay calificaciones
- (ACV-S04) Tarea Calificada 1 - EP1Documento14 páginas(ACV-S04) Tarea Calificada 1 - EP1GIANCARLO ALANIZAún no hay calificaciones
- (Acv-S03) Evaluación Calificada en Linea 1 - Ep1 Calculo para La Toma de DecisionesDocumento5 páginas(Acv-S03) Evaluación Calificada en Linea 1 - Ep1 Calculo para La Toma de DecisionesGIANCARLO ALANIZAún no hay calificaciones
- Flujo de Financiamiento NetoDocumento6 páginasFlujo de Financiamiento NetoGIANCARLO ALANIZAún no hay calificaciones
- Trabajo Final Gestión de ProcesosDocumento5 páginasTrabajo Final Gestión de ProcesosGIANCARLO ALANIZAún no hay calificaciones
- Pantallazos de Los Ejercicios de VCDocumento6 páginasPantallazos de Los Ejercicios de VCGIANCARLO ALANIZAún no hay calificaciones
- U1 S1 2.reacciones Quimicas REDOXDocumento22 páginasU1 S1 2.reacciones Quimicas REDOXGIANCARLO ALANIZAún no hay calificaciones
- S04.s1 - Ejercicios PropuestosDocumento2 páginasS04.s1 - Ejercicios PropuestosGIANCARLO ALANIZAún no hay calificaciones
- S04.s1 Ejercicios ResueltosDocumento9 páginasS04.s1 Ejercicios ResueltosGIANCARLO ALANIZAún no hay calificaciones