Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Quimica
Cargado por
Panchinni BarbaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Quimica
Cargado por
Panchinni BarbaCopyright:
Formatos disponibles
Átomo: es la unidad más pequeña de un elemento químico que mantiene su identidad o
sus propiedades y que no es posible dividir mediante procesos químicos.
Electron: es una partícula subatómica de tipo fermiónico. En un átomo los electrones
rodean el núcleo, compuesto únicamente de protones y neutrones.
Isotopo: son todos los tipos de átomos de un mismo elemento químico la tabla periódica
pero tiene diferente número másico (A).
La masa molar (símbolo M) de un átomo o una molécula es la masa de un mol de dicha
partícula expresada en gramos. Es una propiedad física característica de cada sustancia
pura. Sus unidades en química son g/mol.
moléculas a las partículas neutras formadas por un conjunto estable de al menos dos
átomos enlazados covalentemente. [1] [2] No es posible exagerar la importancia del
concepto de molécula para la química ordinaria, especialmente para la química de la
vida.
El mol (símbolo: mol) es la unidad con que se mide la cantidad de sustancia, una de las
siete magnitudes físicas fundamentales del Sistema Internacional de Unidades.
los niveles de energia se refiere a los orbitales de los electrones de valencia (los del
enlace), son7 y corresponden dependiendo a que clase pertenecen de la tabla periodica,
los s, p, d y f.
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos
clases:
Protones: Partícula de carga eléctrica positiva igual a una carga elemental, y 1,67262 ×
10–27 kg y una masa 1837 veces mayor que la del electrón.
Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del
protón (1,67493 × 10–27 kg).
Un orbital atómico es una determinada solución particular, espacial e independiente del
tiempo a la ecuación de Schrödinger para el caso de un electrón sometido a un potencial
coulombiano.
En la tabla periódica de los elementos, un periodo es cada fila de la tabla.
En química, la valencia, también conocida como número de valencia, es una medida de
la cantidad de enlaces químicos formados por los átomos de un elemento químico.
Los metales de transición o elementos de transición son aquellos elementos químicos
que están situados en la parte central del sistema periódico, en el bloque d, cuya
principal característica es la inclusión en su configuración electrónica del orbital d,
parcialmente lleno de electrones.
Lantánidos son un grupo de elementos que forman parte del periodo 6 de la tabla
periódica. Estos elementos son llamados tierras raras debido a que se encuentran en
forma de óxidos, y también, junto con los actínidos, forman los Elementos de
Transición Interna.
Actínidos son un grupo de elementos que forman parte del periodo 7 de la tabla
periódica. Estos elementos, junto con los lantánidos, son llamados elementos de
transición interna. El nombre procede del elemento químico actinio, que suele incluirse
dentro de este grupo, dando un total de 15 elementos, desde el de número atómico 89 (el
actinio) al 103 (laurencio).
PREGUNTA 2.
El modelo atómico de Dalton, surgido en el contexto de la química, fue el primer
modelo atómico con bases científicas, fue formulado en 1808 por John Dalton. El
siguiente modelo fue el Modelo atómico de Thomson
El modelo atómico de Thomson, también conocido como el "budin de pasas", es una
teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson,
descubridor del electrón[1] en 1897, mucho antes del descubrimiento del protón y del
neutrón.
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura
interna del átomo propuesto por el químico y físico británico-neozelandés Ernest
Rutherford para explicar los resultados de su "experimento de la lámina de oro",
realizado en 1911.
El modelo atómico de Bohr o de Bohr-Rutherford es un modelo cuantizado del
átomo propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los
electrones pueden tener órbitas estables alrededor del núcleo. Este modelo planetario es
un modelo funcional que no representa el átomo (objeto físico) en sí, sino que explica
su funcionamiento por medio de ecuaciones.
PREGUNTA 3.
El modelo atómico de Böhr no explicaba por qué la energía en las órbitas atómicas
estaba cuantizada, ni por qué algunas propiedades de los elementos se repetían
periódicamente. Es decir, no explicaban bien los espectros de emisión.
Además, se aventuraba a colocar a los electrones con exactitud en unas órbitas fijas.
PREGUNTA 4.
Según el principio de incertidumbre, ciertos pares de variables físicas, como la posición
y el momento (masa por velocidad) de una partícula, no pueden calcularse
simultáneamente con la precisión que se quiera. Así, si repetimos el cálculo de la
posición y el momento de una partícula cuántica determinada (por ejemplo, un
electrón), nos encontramos con que dichos cálculos fluctúan en torno a valores medíos.
PREGUNTA 5.
nicialmente la ecuación de Schrödinger se consideró simplemente como la ecuación de
movimiento de un campo material que se propagaba en forma de onda. De hecho puede
verse que en el límite clásico, cuando la ecuación de Schrödinger se reduce a la
ecuación clásica de movimiento en términos de acción o ecuación de Hamilton-Jacobi.
Para ver esto, trabajaremos con la función de onda típica que satisfaga la ecuación de
Schrödinger dependiente del tiempo que tenga la forma:
Donde es la fase de la onda si substituimos esta solución en la ecuación de
Schrödinger dependiente del tiempo después de un poco de álgebra llegamos a que:
(4)
Si se toma el límite el segundo miembro desaparece y tenemos que la fase de la
función de onda coincide con la magnitud de acción y esta magnitud puede tomarse
como real. Igualmente puesto que la magnitud de acción es proporcional a la masa de
una partícula puede verse que para partículas de masa grande el segundo
miembro es mucho más pequeño que el primero:
(5)
Y por tanto para partículas macroscópicas, dada la pequeñez de la constante de Planck,
los efectos cuánticos resumidos en el segundo miembro se anulan, lo cual explica
porqué los efectos cuánticos sólo son apreciables a escalas subatómicas.
De acuerdo con el principio de correspondencia las partículas clásicas de gran masa,
comparada con la escala cuántica, son partículas localizadas describibles mediante un
paquete de ondas altamente localizado que se desplaza por el espacio. La longitud de
onda de dicha de las ondas que conformaban dicho paquete material están en torno a la
longitud de De Broglie para la partícula, y la velocidad de grupo del paquete coincide
con la velocidad del movimiento de la partícula lo que reconcilia la naturaleza
corpuscular observada en ciertos experimentos con la naturaleza ondulatoria observada
para partículas subatómicas.
PREGUNTA 6.
PREGUNTA 7.
PREGUNTA 8.
PREGUNTA 9.
PREGUNTA 10.
También podría gustarte
- Analisis Por TamizadoDocumento48 páginasAnalisis Por TamizadoEdgar Jose Paez VicuñaAún no hay calificaciones
- Influencia de La Luna en La AgriculturaDocumento77 páginasInfluencia de La Luna en La AgriculturaAngel CaravantesAún no hay calificaciones
- Vigas Tipo T PuentesDocumento33 páginasVigas Tipo T PuentesLuis Fuertes FloresAún no hay calificaciones
- Guia N°1 7°Documento3 páginasGuia N°1 7°Julio Gomez HernándezAún no hay calificaciones
- Anatomia Radiografica Del Maxilar InferiorDocumento35 páginasAnatomia Radiografica Del Maxilar InferiorFrancisco AtimAún no hay calificaciones
- Limpieza de canaletas cementoDocumento8 páginasLimpieza de canaletas cementoDamaris Elizabeth Rojas CabreraAún no hay calificaciones
- Serie verbalDocumento44 páginasSerie verbalDaniel RAún no hay calificaciones
- AUTISMO - A Propósito Del AutismoDocumento44 páginasAUTISMO - A Propósito Del AutismoJuan Larbán VeraAún no hay calificaciones
- Programa de Mantenimiento Preventivo y Aseguramiento de Energias PeligrosasDocumento17 páginasPrograma de Mantenimiento Preventivo y Aseguramiento de Energias PeligrosasJUAN FERNANDO POSADA CASTAÑOAún no hay calificaciones
- Unidad 1 - Mantto EQ. ElectDocumento65 páginasUnidad 1 - Mantto EQ. ElectJairo MarinAún no hay calificaciones
- VITAMINASDocumento6 páginasVITAMINASWanda belen Ortiz fernandezAún no hay calificaciones
- Ingeniería Civil objetos estudio infraestructuraDocumento3 páginasIngeniería Civil objetos estudio infraestructuraSolangeAún no hay calificaciones
- Clase 01 - Leyes de CorteDocumento17 páginasClase 01 - Leyes de CorteÁlvaro Henríquez IbáñezAún no hay calificaciones
- Prueba de Lenguaje Quinto Básico InfografíasDocumento6 páginasPrueba de Lenguaje Quinto Básico InfografíasMichael Pinilla Cid100% (3)
- Solucionario PitagorasDocumento18 páginasSolucionario PitagorasErico Freddy Palacios Loayza50% (4)
- 2016-03 Top Value Computing v1 PDFDocumento24 páginas2016-03 Top Value Computing v1 PDFJaime TraverAún no hay calificaciones
- Pact. Preoperatorio Esquema LlaveDocumento3 páginasPact. Preoperatorio Esquema LlaveLizeth Johanny Huaypar RamosAún no hay calificaciones
- Diplomado en Administración Estratégica de las Operaciones en los Procesos ProductivosDocumento82 páginasDiplomado en Administración Estratégica de las Operaciones en los Procesos ProductivosJomara GonzálezAún no hay calificaciones
- Actividad #2 - Buenas Practicas de AlmacenamientoDocumento3 páginasActividad #2 - Buenas Practicas de AlmacenamientoDarinel BatistaAún no hay calificaciones
- Formacion VilquechicoDocumento1 páginaFormacion VilquechicoalexanderAún no hay calificaciones
- Transición de La Imprenta Al Ciberespacio y Sus Efectos en La Comunicación AcadémicaDocumento8 páginasTransición de La Imprenta Al Ciberespacio y Sus Efectos en La Comunicación AcadémicaFabiano CaschettoAún no hay calificaciones
- GUIA CLASE 6 CN 7°Documento5 páginasGUIA CLASE 6 CN 7°Anaz SaaAún no hay calificaciones
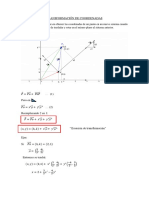
- Transformación de CoordenadasDocumento3 páginasTransformación de CoordenadasJimy el rosqueteAún no hay calificaciones
- Analisis de Un CuentoDocumento5 páginasAnalisis de Un Cuentonilsa yamile meloAún no hay calificaciones
- Proyecto de Capacitacion A La Poblacion Agricola y Sociedad Civil Acerca Del Daño Que Genera La Quema de Maleza en Cultivos de ArrosDocumento44 páginasProyecto de Capacitacion A La Poblacion Agricola y Sociedad Civil Acerca Del Daño Que Genera La Quema de Maleza en Cultivos de ArrosLaura FuentesAún no hay calificaciones
- Triptico de Prevencion de Riesgos Laborales.Documento2 páginasTriptico de Prevencion de Riesgos Laborales.Katherine Polo Valdez100% (2)
- AIEPIDocumento107 páginasAIEPIKari AndreaAún no hay calificaciones
- Infeccion Puerperal 2Documento24 páginasInfeccion Puerperal 2Kevin RiofrioAún no hay calificaciones
- Lab Teorema de THEVENIN y NORTON en Regimen ACDocumento6 páginasLab Teorema de THEVENIN y NORTON en Regimen ACLEONARDO BOLIVAR VILLEGASAún no hay calificaciones
- Anexo 4 Presupuesto Naves IndustrialesDocumento2 páginasAnexo 4 Presupuesto Naves IndustrialesJanet Farias CoveñasAún no hay calificaciones