Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Safrol
Cargado por
Moises Valdivia Baldomero0%(1)0% encontró este documento útil (1 voto)
872 vistas12 páginasSafrol
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoSafrol
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0%(1)0% encontró este documento útil (1 voto)
872 vistas12 páginasSafrol
Cargado por
Moises Valdivia BaldomeroSafrol
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 12
Safrol
...
Salvar
El safrol es un compuesto orgánico con la fórmula
CHOCHCHCH = CH. Es un líquido aceitoso incoloro, aunque las
muestras impuras pueden aparecer amarillas. Miembro de la
familia de productos naturales fenilpropenoides, se encuentra
en las plantas de sasafrás , entre otros. Pequeñas cantidades
se encuentran en una amplia variedad de plantas, donde
funciona como un antidepresivo natural . [2] Ocotea
pretiosa , [3] que crece en Brasil , y Sassafras
albidum , [4] que crece en el este de América del Norte , son
las principales fuentes naturales de safrol. Tiene un aroma
característico de "confitería".
Es un precursor en la síntesis
del insecticida sinergista piperonil butóxido , la
fragancia piperonal a través de isosafrol y el fármaco
empatógeno / entactógeno MDMA .
Historia
El safrol se obtuvo de varias plantas, pero especialmente del
árbol de sasafrás ( Sassafras albidum ), que es nativo de
América del Norte, y del anís estrellado japonés ( Illicium
anisatum , llamado shikimi en Japón). [5] En 1844, el químico
francés Édouard Saint-Evre determinó la fórmula empírica
de safrole . [6] En 1869, los químicos franceses Édouard
Grimaux (1835–1900) y J. Ruotte investigaron y nombraron
safrol. [7] Observaron su reacción con el bromo, lo que sugiere
la presencia de un grupo alilo . [8] En 1884, el químico
alemán Theodor Poleck(1821-1906) sugirieron que el safrol era
un derivado del benceno , al que se unieron dos átomos de
oxígeno como epóxidos (éteres cíclicos). [9] En 1885, el
químico holandés Johann Frederik Eijkman (1851-1915)
investigó el shikimol, el aceite esencial que se obtiene del anís
estrellado japonés, y descubrió que, tras la oxidación, el
shikimol formaba ácido piperonílico, [10] cuya estructura
básica había sido determinado en 1871 por el químico
alemán Wilhelm Rudolph Fittig (1835-1910) y su alumno, el
químico estadounidense Ira Remsen (1846-1927). [11] Así,
Eijkman dedujo la estructura básica correcta para el
shikimol. [12] También señaló que shikimol y safrol tenían la
misma fórmula empírica y tenían otras propiedades similares,
por lo que sugirió que probablemente eran idénticos. [13] En
1886, Poleck demostró que tras la oxidación, el safrol también
formaba ácido piperonílico, y por lo tanto el shikimol y el safrol
eran de hecho idénticos. [14] Quedaba por determinar si el
grupo CH de la molécula era un grupo propenilo (R-CH = CH-
CH) o un grupo alilo (R-CH-CH = CH). En 1888, el químico
alemán Julius Wilhelm Brühl (1850–1911) determinó que el
grupo CH era un grupo alilo. [15]
Ocurrencia natural
El safrol es el componente principal del aceite
de alcanfor marrón . Ocotea cymbarum aceite hecho
de Ocotea pretiosa , [3] una planta que crece en Brasil , y
aceite de sasafrás hecho de Sassafras albidum .
En los EE. UU., El aceite de sasafrás culinario disponible
comercialmente generalmente carece de safrol debido a una
regla aprobada por la FDA de EE. UU. En 1960.
El safrol se puede obtener
mediante extracción natural de Sassafras albidum y Ocotea
cymbarum . El aceite de sasafrás, por ejemplo, se obtiene
por destilación al vapor de la corteza de la raíz del árbol de
sasafrás. El producto destilado al vapor resultante contiene
aproximadamente 90% de safrol en peso. El aceite se seca
mezclándolo con una pequeña cantidad de cloruro de calcio
anhidro . Después de filtrar el cloruro de calcio, el aceite se
destila al vacío a 100 ° C bajo un vacío de 11 mmHg o se
congela para cristalizar el safrol. Esta técnica funciona con
otros aceites en los que también está presente el
safrol. [16] [17]
El safrol se extrae típicamente de la corteza de la raíz o del
fruto de Sassafras albidum [18] (nativo del este de América
del Norte) en forma de aceite de sasafrás, o de Ocotea
odorifera , [19] una especie brasileña. El safrol también está
presente en ciertos aceites esenciales y en el aceite de
alcanfor marrón , que está presente, en pequeñas cantidades,
en muchas plantas. El safrol se puede encontrar en el anís ,
la nuez moscada , la canela y la pimienta negra . El safrol
se puede detectar en bebidas líquidas no diluidas y
preparaciones farmacéuticas mediante cromatografía líquida
de alta resolución . [20]
Aplicaciones
El safrol es un miembro del grupo metilendioxibenceno, del cual
muchos compuestos se usan como sinergistas insecticidas; por
ejemplo, el safrol se usa como precursor en la síntesis del
insecticida butóxido de piperonilo . El safrol también se usa
como precursor en la síntesis del medicamento N-metil-3,4-
metilendioxianfetamina ( MDMA , éxtasis). Antes de que la
FDA prohibiera el safrol en 1960 para su uso en alimentos, se
usaba como saborizante de alimentos por su característico
aroma de "tienda de dulces". Fue utilizado como aditivo en
cerveza de raíz, chicle, pasta de dientes, jabones y ciertas
preparaciones farmacéuticas.
El safrol
exhibe funciones antibióticas [21] y antiangiogénicas [22] .
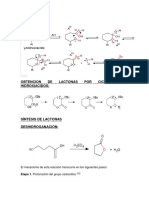
Síntesis
Se puede sintetizar a partir de catecol [23] primero mediante
conversión a metilendioxibenceno, que se broma y se combina
con bromuro de alilo . [24]
El safrol es un precursor versátil para muchos compuestos. Los
ejemplos son N-acilarylhydrazones, isosters, [25] derivados de
arilsulfonamida, [26] derivados de sulfonilhidrazona
ácidos, [27] derivados de benzotiazina. [28] y muchos más.
Isosafrol
El isosafrol se produce sintéticamente a partir de safrol. No se
encuentra en la naturaleza. El isosafrol viene en dos formas,
trans-isosafrol y cis-isosafrol. El isosafrol se usa como
precursor de la droga psicoactiva MDMA. Cuando el safrol se
metaboliza, se pueden identificar varios metabolitos. Se ha
demostrado que algunos de estos metabolitos exhiben efectos
toxicológicos, como 1'-hidroxisafrol y 3'-hidroxisafrol en
ratas. Otros metabolitos de safrol que se han encontrado en la
orina de ratas y humanos incluyen 1,2-dihidroxi-4-alilbenceno o
1 (2) -metoxi-2 (1) hidroxi-4-alilbenceno. [29]
Metabolismo
El safrol puede sufrir muchas formas de metabolismo. Las dos
rutas principales son la oxidación de la cadena lateral de alilo y
la oxidación del grupo metilendioxi. [30] La oxidación de la
cadena lateral de alilo está mediada por un complejo de
citocromo P450, que transformará el safrol en 1'-
hidroxisafrol. El 1'-hidroxisafrole recién formado se someterá a
una fase II de reacción del metabolismo del fármaco con
una enzima sulfotransferasa para crear 1'-sulfoxysafrole, que
puede causar aductos de ADN . [31]Una vía de oxidación
diferente de la cadena lateral de alilo puede formar epóxido de
safrol. Hasta ahora, esto solo se ha encontrado en ratas y
cobayas. El epóxido formado es un metabolito pequeño debido
a la lenta formación y al metabolismo adicional del
compuesto. Una enzima epóxido hidratasa actuará sobre el
epóxido para formar dihidrodiol, que puede secretarse en la
orina.
El metabolismo del safrol a través de la oxidación del
metilendioxi procede a través de la escisión del grupo
metilendioxi. Esto da como resultado dos metabolitos
principales: alilcatecol y su isómero, propenilcatecol. Eugenol
es un metabolito menor de safrol en humanos, ratones y
ratas. La cadena lateral de alilo intacta de alilcatecol puede
oxidarse para producir 2 ', 3'-epoxipropilcatecol. Esto puede
servir como sustrato para una enzima epóxido hidratasa e
hidratará el 2 ', 3'-epoxipropilcatecol a 2', 3'-
dihidroxipropilcatecol. Este nuevo compuesto puede oxidarse
para formar ácido propanoico (PPA), [30] que es una sustancia
relacionada con un aumento del estrés oxidativo y la actividad
de la glutatión S-transferasa . PPA también causa una
disminución de glutatión y glutatión
peroxidasaactividad. [32] El epóxido de alilcatecol también
puede generarse a partir de la escisión del grupo metilendioxi
del epóxido de safrol. La escisión del anillo metilendioxi y el
metabolismo del grupo alilo implican las oxidasas de función
mixta microsomales hepáticas. [30]
Toxicidad
Los estudios toxicológicos han demostrado que el safrol es
un hepatocarcinógeno débil a dosis más altas en ratas y
ratones. El safrol requiere activación metabólica antes de
exhibir efectos
toxicológicos. [30] La conversión metabólica del grupo alilo
en safrol es capaz de producir intermedios que son
directamente capaces de unirse covalentemente con el ADN y
las proteínas . El metabolismo del grupo metilendioxi a
un carbeno permite que la molécula forme complejos de
ligando con los citocromo P450 y P448. La formación de este
complejo conduce a menores cantidades de citocromo
P450 libre disponible.. El safrol también puede unirse
directamente al citocromo P450 , lo que lleva a una inhibición
competitiva . Estos dos mecanismos dan como resultado
una actividad de oxidasa de función mixta reducida .
Además, debido a las propiedades estructurales y funcionales
alteradas del citocromo P450 , puede producirse la pérdida
de ribosomas que están unidos al retículo endoplasmático
a través del citocromo P450 . [29] El grupo alilo contribuye
directamente a la mutagenicidad , mientras que el grupo
metilendioxi se asocia con cambios en el sistema citocromo
P450 y aspectos epigenéticos de carcinogenicidad. [29] En
ratas, el safrol y los compuestos relacionados produjeron
tumores benignos y malignos después de la ingesta por la
boca. Los cambios en el hígado también se observan a través
del agrandamiento de las células hepáticas y la muerte
celular .
Los estudios realizados en la década de 1960 sugirieron que el
safrol era carcinogénico y causaba daño hepático permanente
en animales. En consecuencia, la Administración de Drogas y
Alimentos de los Estados Unidos (FDA) prohibió el sasafrás y la
safrol para el consumo humano. [33]
La FDA todavía considera que Safrole es un carcinógeno débil
en las ratas. [34] [35] Sin embargo, según un estudio de 1977
sobre los metabolitos de safrol en ratas y humanos, no se
encontraron dos metabolitos cancerígenos de safrol en la orina
de ratas, 1'-hidroxisafrole y 3'-hidroxiisosafrol. orina
humana [36] La Comisión Europea de Salud y Protección del
Consumidor asume que el safrol es genotóxico y
cancerígeno. [37] Ocurre naturalmente en una variedad de
especias, como canela , nuez moscada y pimienta negra , y
hierbas como la albahaca. En ese papel, el safrol, como
muchos compuestos naturales, puede tener una capacidad
pequeña pero medible para inducir cáncer en roedores. A pesar
de esto, el Laboratorio Nacional Lawrence Berkeley estimó que
los efectos en humanos son similares a los riesgos que plantea
respirar aire interior o beber agua suministrada por el
municipio. [38] En los Estados Unidos , una vez fue
ampliamente utilizado como aditivo alimentario en la cerveza
de raíz , el té de sasafrás y otros productos comunes, pero fue
prohibido por la FDA después de que se descubrió su
carcinogenicidad en ratas. Hoy, la Asociación Internacional de
Fragancias también prohíbe el uso de safrol
en jabones y perfumes .
Efectos adversos
Además de ser un hepatocarcinógeno, el safrol presenta otros
efectos adversos, ya que inducirá la formación de
hidroperóxidos lipídicos hepáticos. [39] El safrol también
inhibe la función defensiva de los neutrófilos contra las
bacterias. Además de la inhibición de la función defensiva de
los neutrófilos, también se ha descubierto que el safrol
interfiere con la formación de superóxidos por los
neutrófilos. [21] Además, el óxido de safrol, un metabolito del
safrol, tiene un efecto negativo en el sistema nervioso
central. El óxido de safrol inhibe la expresión de integrina β4 /
SOD, lo que conduce a la apoptosis de las células
nerviosas. [40]
Uso en la fabricación de MDMA
Safrole figura como un precursor de la Tabla I en virtud de
la Convención de las Naciones Unidas contra el tráfico ilícito
de estupefacientes y sustancias psicotrópicas . [41] Debido a
su papel en la fabricación de MDMA , el safrol y el isosafrol ,
así como el piperonal , son precursores de la categoría I en
virtud del Reglamento nº 273/2004 de la Comunidad
Europea. [42] En los Estados Unidos, safrol es actualmente
un producto químico lista I .
La corteza de la raíz de sasafrás americano contiene un bajo
porcentaje de aceite volátil al vapor, que generalmente es un
75% de safrol. [43] Los intentos de refinar el safrol de la
corteza de sasafrás en cantidades masivas generalmente no
son económicamente viables debido al bajo rendimiento y al
gran esfuerzo. Sin embargo, se pueden extraer cantidades más
pequeñas fácilmente mediante destilación al
vapor (aproximadamente el 10% de la corteza de raíz de
sasafrás seca en masa, o aproximadamente el 2% de la corteza
fresca). [44] La demanda de safrol está causando una cosecha
rápida e ilícita del árbol Cinnamomum parthenoxylon en
el sudeste asiático , en particular las montañas de
cardamomo en Camboya . [45]Sin embargo, no está claro qué
proporción de safrol recolectado ilícitamente se destina a la
producción de MDMA, ya que más del 90% del suministro global
de safrol (alrededor de 2000 toneladas métricas por año) se
utiliza para fabricar pesticidas, fragancias y otros productos
químicos. [46] [47] La cosecha sostenible de safrol es posible
a partir de hojas y tallos de ciertas plantas. [46] [47]
Ver también
Sasafrás
Cerveza de raíz
Referencias
1. Índice Merck , 11ª edición, 8287
2. Kamdem, Donatien; Gage, Douglas (2007). "Composición
química del aceite esencial de la corteza de raíz de
Sassafras albidum". Planta Medica 61 (6): 574-
5. doi : 10.1055 / s-2006-959379 . PMID 8824955 .
3. Hickey, Michael J. (1948). "Investigación de los
componentes químicos del aceite de sasafrás
brasileño". Revista de Química Orgánica. 13 (3): 443–
6. doi : 10.1021 / jo01161a020 . PMID 18863852 .
4. Kamdem, Donatien; Gage, Douglas (2007). "Composición
química del aceite esencial de la corteza de raíz de
Sassafras albidum". Planta Medica 61 (6): 574-
5. doi : 10.1055 / s-2006-959379 . PMID 8824955 .
5. La historia de la investigación sobre safrol aparece
en: Semmler, FW (1907). Die Ätherischen Öle nach ihren
chemischen Bestandteilen unter Berücksichtigung der
geschichtlichen Entwicklung [Los aceites volátiles según
sus componentes químicos con respecto a su desarrollo
histórico] (en alemán). vol. 4. Leipzig, Alemania: Veit & Co.
págs. 139-144.
6. San Evre (1844). "Recherches sur l'huile essentielle de
sassafras" [Investigaciones del aceite esencial de
sasafrás]. Annales de Chimie et de Physique. 3ra serie (en
francés). 12 : 107-113. ; ver p. 108)
7. Grimaux, E; Ruotte, J. (1869). "Sur l'essence de
sassafras" [Sobre el aceite esencial de sasafrás]. Comptes
Rendus (en francés). 68 : 928–930. De p. 928: "Ils sont
constitués par une principe oxygéné, la safrol CHO ..." (Ellos
[es decir, las fracciones de aceite esencial que son safrol]
están compuestas de una sustancia oxigenada, safrol
CHO ...)
8. (Grimaux y Ruotte, 1869), pág. 929.
9. Poleck, Theodor (1884). "Ueber die chemische
Constitution des Safrols" [Sobre la composición química del
safrol]. Berichte der Deutschen Chemischen
Gesellschaft. 17 (2): 1940–1944. doi : 10.1002 /
cber.18840170278 . Ver fórmula estructural en la pág. 1941
10. Eijkman, JF (1885). "Sur les principes constituyentes de
l'Illicium religiosum (Sieb.) (Shikimi-no-ki en
japonais)" [Sobre las sustancias que componen Illicium
religiosum (Sieb.) (Shikimi-no-ki en japonés)]. Recueil des
Travaux Chimiques des Pays-Bas (en francés). 4 (2): 32–
54. doi : 10.1002 / recl.18850040202 . ; vea páginas 39–
40...?....!..?...!?? !?? !??. !.!.!?.?.!.!.?.!.?....!............... .mos. .P-
YFPQ -RFWFFD-1DT .PFD. ALCORGUSTEO: .REL .PASA..,
.REDRECERDOTA .PRODUCIRLO, HABITACION DE LOS
ANIMADORES. - PAGINA DE LA COMPAÑIA DE LA INFANCIA.,
ENTRE LAS 18 HORIZONTES, NOMBRA EN ESPAÑ..,
CONSULTE EL PEDIENTE MULTIMEDIO. (2) .D .Este es un
lugar donde se encuentran en las páginas 40., págs. 39-40.
¿Qué significan las páginas 39 a 40 de la misma página?
(págs. 39–40). Ver págs 39–40. ¡Fantásticos y más! ¡¡¡¡!!!!!!!!!!!!!
¡!! '¡!' '' '. `` Ver. págs. 41-40``. Ver.
11. Fittig, Rud .; Remsen, Ira (1871). "Untersuchungen über
die Constitution des Piperins und seiner Spaltungsproducte
Piperinsäure und Piperidin" [Investigaciones sobre la
composición de la piperina y sus productos de
escisión ácido piperico y piperidina ]. Annalen der Chemie
(en alemán). 159 (2): 129-158. doi : 10.1002 /
jlac.18711590202 . ; ver la fórmula estructural para
Piperonylsäure en p. 155 .
12. (Eijkman, 1885), págs. 40–41.
13. (Eijkman, 1885), págs. 41–42.
14. Poleck, Th. (1886). "Ueber die chemische Structur des
Safrols" [Sobre la estructura química del safrol]. Berichte
der Deutschen Chemischen Gesellschaft (en alemán). 19 :
1094-1098. doi : 10.1002 / cber.188601901243 .
15. Brühl, JW (1888). "Untersuchungen über die Terpene und
deren Abkömmlinge" [Investigaciones de los terpenos y sus
derivados]. Berichte der Deutschen Chemischen
Gesellschaft (en alemán). 21 : 457–477. doi : 10.1002 /
cber.18880210181 . ; véanse las págs. 474–477.
16. Ledgard, J. (2010). Kings Chem Guide Segunda edición.
17. Perkin, William Henry y Trikojus, Victor Martin
(1927). "CCXII.-Una síntesis de safrol y o-safrol". Revista de
la Sociedad Química. 0 : 1663–1666. doi : 10.1039 /
JR9270001663 .
18. Kamdem, Donatien; Gage, Douglas (1995-12-
01). "Composición química del aceite esencial de la corteza
de raíz de Sassafras albidum". Planta Medica 61 (6): 574-
575. doi : 10.1055 / s-2006-959379 . ISSN 0032-
0943 . PMID 8824955 .
19. Hickey, MJ (1948-05-01). "Investigación de los
componentes químicos del aceite de sasafrás brasileño". La
Revista de Química Orgánica. 13 (3): 443–
446. doi : 10.1021 / jo01161a020 . ISSN 0022-
3263 . PMID 18863852 .
20. Wisneski, Harris H .; Yates, Ronald L .; Davis, Henry M.
(1983). "Cromatográfico líquido de alto rendimiento:
determinación fluorométrica de safrol en perfume, colonia y
agua de tocador". Journal of Chromatography A. 255 : 455–
461. doi : 10.1016 / s0021-9673 (01) 88300-x .
21. Hung, Shan-Ling; Chen, Yu-Ling; Chen, Yen-Ting (01-04-
2003). "Efectos del safrol en las funciones defensivas de los
neutrófilos humanos". Revista de investigación
periodontal. 38 (2): 130-134. doi : 10.1034 / j.1600-
0765.2003.01652.x . ISSN 0022-3484 . PMID 12608906 .
22. Zhao, Jing; Miao, Junying; Zhao, Baoxiang; Zhang,
Shangli; Yin, Deling (2005-06-01). "El óxido de safrol inhibe
la angiogénesis induciendo apoptosis". Farmacología
Vascular. 43 (1): 69–74. doi : 10.1016 /
j.vph.2005.04.004 . ISSN 1537-1891 . PMID 15936989 .
23. Perkin, William Henry; Trikojus, Victor Martin (1927-01-
01). "CCXII.-Una síntesis de safrol y o-safrol". J.
Chem. Soc. 0 : 1663–1666. doi : 10.1039 /
jr9270001663 . ISSN 0368-1769 .
24. "Síntesis de Safrole -
[www.rhodium.ws]" . erowid.org . Consultado el 27 de
abril de 2017 .
25. Lima, PC; Lima, LM; da Silva, KC; Léda, PH; de Miranda,
AL; Fraga, CA; Barreiro, EJ (2000-02-01). "Síntesis y
actividad analgésica de nuevas N-acilarylhydrazones e
isosters, derivados de safrol natural". Revista Europea de
Química Medicinal. 35 (2): 187-203. doi : 10.1016 / s0223-
5234 (00) 00120-3 . ISSN 0223-5234 . PMID 10758281 .
26. Lages, AS; Silva, KC; Miranda, AL; Fraga, CA; Barreiro,
EJ (1998-01-20). "Síntesis y evaluación farmacológica de
nuevos análogos de flosulida, sintetizados a partir de safrol
natural". Cartas de química bioorgánica y medicinal. 8 (2):
183–188. doi : 10.1016 / s0960-894x (97) 10216-
5 . ISSN 0960-894X . PMID 9871651 .
27. Lima, LM; Amarante, EG; Miranda, ALP; Fraga,
CAM; Barreiro, EJ (1999). "Síntesis y perfil antinociceptivo
de nuevos derivados de sulfonilhidrazona ácida de safrol
natural". Farmacia y Farmacología Comunicaciones. 5 (12):
673–678. doi : 10.1211 / 146080899128734370 .
28. Fraga, Carlos AM; Barreiro, Eliezer J. (1992-10-01). "La
síntesis de un nuevo derivado de benzotiazina, relacionado
con oxicams, sintetizado a partir de safrol natural". Revista
de Química Heterocíclica. 29 (6): 1667–
1669. doi : 10.1002 / jhet.5570290652 . ISSN 1943-5193 .
29. Ioannides, C .; Delaforge, M .; Parke, DV (1981-10-
01). "Safrol: su metabolismo, carcinogenicidad e
interacciones con el citocromo P-450". Toxicología
alimentaria y cosmética. 19 (5): 657–666. doi : 10.1016 /
0015-6264 (81) 90518-6 . ISSN 0015-
6264 . PMID 7030889 .
30. Sekizawa, J .; Shibamoto, T. (1982-04-01). "Genotoxicidad
de productos químicos relacionados con safrol en sistemas
de prueba microbiana". Investigación de
mutaciones. 101 (2): 127–140. doi : 10.1016 / 0165-1218
(82) 90003-9 . ISSN 0027-5107 . PMID 6808388 .
31. Jeurissen, Suzanne MF; Bogaards, Jan JP; Awad, Hanem
M .; Boersma, Marelle G .; Brand, Walter; Fiamegos, Yiannis
C .; van Beek, Teris A .; Alink, Gerrit M .; Sudhölter, Ernst
JR (2004-09-01). "Especificidad de la enzima del citocromo
p450 humano para la bioactivación de safrol al carcinógeno
próximo 1'-hidroxisafrol". Investigación Química en
Toxicología. 17 (9): 1245-1250. doi : 10.1021 /
tx040001v . ISSN 0893-228X . PMID 15377158 .
32. MacFabe, Derrick F .; Caín, Donald P .; Rodríguez-Capote,
Karina; Franklin, Andrew E .; Hoffman, Jennifer E .; Boon,
Francis; Taylor, A. Roy; Kavaliers, Martin; Ossenkopp,
Klaus-Peter (10 de enero de 2007). "Efectos neurobiológicos
del ácido propiónico intraventricular en ratas: posible papel
de los ácidos grasos de cadena corta en la patogénesis y
características de los trastornos del espectro
autista". Behavioral Brain Research. Modelos animales para
el autismo. 176 (1): 149-169. doi : 10.1016 /
j.bbr.2006.07.025 . PMID 16950524 .
33. O'MATHUNA, DONAL. ¿Funciona? ¿Se puede utilizar el
sasafrás como tónico general ?, Irish Times , 10 de agosto
de 2010
34. Hagan, Ernest C .; Jenner, Paul M .; Jones,
Wm.I .; Fitzhugh, O.Garth; Long, Eleanor L .; Brouwer,
JG; Webb, Willis K. (1965). "Propiedades tóxicas de
compuestos relacionados con safrol". Toxicología y
farmacología aplicada. 7 (1): 18-24. doi : 10.1016 / 0041-
008x (65) 90069-4 .
35. Liu, TY; Chen, CC; Chen, CL; Chi, CW (1999). "Daño
oxidativo inducido por safrol en el hígado de ratas Sprague-
Dawley". Toxicología alimentaria y química . 37 (7): 697–
702. doi : 10.1016 / S0278-6915 (99) 00055-
1 . PMID 10496370 .
36. Benedetti, M; Malnoe, A; Broillet, A (1977). "Absorción,
metabolismo y excreción de safrol en la rata y el
hombre". Toxicología. 7 (1): 69–83. doi : 10.1016 / 0300-
483X (77) 90039-7 . PMID 14422 .
37. Opinión del Comité Científico de Alimentos sobre la
seguridad de la presencia de safrol (1-alil-3,4-
metilendioxibenceno) en aromatizantes y otros ingredientes
alimentarios con propiedades aromatizantes
38. "Clasificación de posibles riesgos de cáncer en el índice
HERP" (PDF) . Consultado el 22 de octubre de 2013 .
39. Liu, T. Y; Chen, C. C; Chen, C. L; Chi, C.W
(01/07/1999). "Daño oxidativo inducido por safrol en el
hígado de ratas Sprague-Dawley". Toxicología alimentaria y
química. 37 (7): 697–702. doi : 10.1016 / S0278-6915 (99)
00055-1 .
40. Su, Le; Zhao, BaoXiang; Lv, Xin; Wang, Nan; Zhao,
Jing; Zhang, ShangLi; Miao, JunYing (20/02/2007). "El óxido
de safrol induce la apoptosis neuronal a través de la
inhibición de la actividad de la integrina β4 / SOD y la
elevación de la actividad de oxidasa ROS / NADPH". Ciencias
de la vida. 80 (11): 999–1006. doi : 10.1016 /
j.lfs.2006.11.041 . PMID 17188719 .
41. Junta Internacional de Control de Narcóticos Archivado
el 27/02/2008 en la Wayback Machine
42. "Reglamento (CE) no 273/2004 del Parlamento Europeo y
del Consejo, de 11 de febrero de 2004, sobre precursores de
drogas" .
43. The Merck Index , 13a edición, Merck & Co, Inc,
Whitehorse Station, NJ, copyright 2001.
44. Ledgard, Jared (2010). Kings Chem Guide (2ª
ed.). UVKCHEM, Inc.
p. 206. ISBN 9780578058658 . Consultado el 6 de
septiembre de 2014 .
45. Campbell, Sam (30 de agosto de 2009). "Cosechados para
hacer éxtasis, los árboles de Camboya se talan uno por
uno" . GlobalPost . Consultado el 2 de septiembre
de 2009 .
46. Blickman, Tom (3 de febrero de 2009). "Cosecha de
árboles para hacer drogas éxtasis" . El Irrawaddy .
47. Rocha, Sergio FR; Ming, Lin Chau (1999). "Piper
hispidinervum: una fuente sostenible de safrol" . En Janick,
Jules (ed.). Perspectivas sobre nuevos cultivos y nuevos
usos. Alexandria, Virginia: ASHS Press. pp. 479-
81. ISBN 978-0-9615027-0-6.
enlaces externos
Estupefacientes y sustancias psicotrópicas de la UE:
aspectos internos
También podría gustarte
- Sintesis-De-metanfetaminaDocumento9 páginasSintesis-De-metanfetaminapl1066hp21680% (3)
- Anfetamina: historia, perfil farmacológico y acción terapéuticaDocumento5 páginasAnfetamina: historia, perfil farmacológico y acción terapéuticabraulio alvarez pinauid100% (1)
- Síntesis de Cloruro de AluminioDocumento1 páginaSíntesis de Cloruro de AluminioMoises Valdivia BaldomeroAún no hay calificaciones
- Reducciones Sintéticas MetDocumento16 páginasReducciones Sintéticas MetJorge Alberto Estrada TorresAún no hay calificaciones
- Equipos de Protección Personal para Trabajos ElectricosDocumento14 páginasEquipos de Protección Personal para Trabajos ElectricosAlvaroAún no hay calificaciones
- 2 CBDocumento9 páginas2 CBHoover Alberto Vargas LopezAún no hay calificaciones
- Notas Sobre La Síntesis de Precursores de MDMA A Partir de EugenolDocumento14 páginasNotas Sobre La Síntesis de Precursores de MDMA A Partir de EugenolJorge Alberto Estrada TorresAún no hay calificaciones
- La Historia Quimica PIHKAL PDFDocumento522 páginasLa Historia Quimica PIHKAL PDFBoesrAún no hay calificaciones
- Cómo convertir phenylacetone en metanfetamina en o menosDocumento99 páginasCómo convertir phenylacetone en metanfetamina en o menosSteven D. GarciaAún no hay calificaciones
- Metanfetamina A Través de La Aminación ReductoraDocumento3 páginasMetanfetamina A Través de La Aminación ReductoraJorge Alberto Estrada TorresAún no hay calificaciones
- TucibiDocumento2 páginasTucibiKevinAún no hay calificaciones
- MDP2P de PiperonalDocumento2 páginasMDP2P de PiperonalJorge Alberto Estrada TorresAún no hay calificaciones
- Quién Necesita Metilamina de Todos ModosDocumento3 páginasQuién Necesita Metilamina de Todos ModosJorge Alberto Estrada TorresAún no hay calificaciones
- Aminación Reductora de MDP2P Con AlDocumento9 páginasAminación Reductora de MDP2P Con AlJorge Alberto Estrada TorresAún no hay calificaciones
- Piperonal y Safrol de Vainillina y EugenolDocumento8 páginasPiperonal y Safrol de Vainillina y EugenolJorge Alberto Estrada TorresAún no hay calificaciones
- p2p BVC VBDocumento20 páginasp2p BVC VBMoises Valdivia Baldomero100% (2)
- p2p BVC VBDocumento20 páginasp2p BVC VBMoises Valdivia Baldomero100% (2)
- Libro Sobre La MetanfetaminaDocumento202 páginasLibro Sobre La MetanfetaminaAlejandro RVAún no hay calificaciones
- Sintesis Anestesicos GeneralesDocumento9 páginasSintesis Anestesicos GeneralesfernnAún no hay calificaciones
- Cocaina NegraDocumento11 páginasCocaina NegraFlamel Nicholas100% (1)
- MT SythDocumento2 páginasMT SythHernan LorenzoAún no hay calificaciones
- Extraccion de Alcaloides 1Documento9 páginasExtraccion de Alcaloides 1Martin MachucaAún no hay calificaciones
- AnfetaminasDocumento8 páginasAnfetaminasSofíaAún no hay calificaciones
- Nuevas drogas de abuso en SabadellDocumento16 páginasNuevas drogas de abuso en SabadellCarlosPerez-galvezGetaAún no hay calificaciones
- LACTONIZACIONDocumento4 páginasLACTONIZACIONcami bakovicAún no hay calificaciones
- SpeedDocumento2 páginasSpeedJose Garcia LopezAún no hay calificaciones
- Extraccion de MescalinaDocumento5 páginasExtraccion de MescalinaDavid MedinaAún no hay calificaciones
- AdhesivosDocumento21 páginasAdhesivosLuz ValdezAún no hay calificaciones
- Capítulo 5Documento13 páginasCapítulo 5Jorge Alberto Estrada TorresAún no hay calificaciones
- A Complete MDMA Synthesis For The First Time Chemist - TraDocumento9 páginasA Complete MDMA Synthesis For The First Time Chemist - Trafarruko21Aún no hay calificaciones
- IsosafrolDocumento3 páginasIsosafrolosgamAún no hay calificaciones
- MetilendioximetanfetaminaDocumento21 páginasMetilendioximetanfetaminaAnthony MacbrayanAún no hay calificaciones
- Apuntes Mecánica de Fluidos AvanzadaDocumento314 páginasApuntes Mecánica de Fluidos AvanzadaIsrael Aguirre VillaAún no hay calificaciones
- Síntesis MescalinaDocumento2 páginasSíntesis MescalinaDaniela GiraudinAún no hay calificaciones
- 2 CBDocumento15 páginas2 CBVannesa ArjonaAún no hay calificaciones
- Quimica Práctica 4 - Ley de La Conservación de La Materia (2020)Documento8 páginasQuimica Práctica 4 - Ley de La Conservación de La Materia (2020)Oscar alfredo Flores MaresAún no hay calificaciones
- 2CB, 2-CB, NEXUS (Droga) Folleto Informativo. Energy ControlDocumento2 páginas2CB, 2-CB, NEXUS (Droga) Folleto Informativo. Energy ControlPablo Aguilar MuñozAún no hay calificaciones
- SafrolDocumento2 páginasSafrolosgamAún no hay calificaciones
- P2P A Partir de Ácido Fenilacético y Acetato de CalcioDocumento2 páginasP2P A Partir de Ácido Fenilacético y Acetato de CalcioJorge Alberto Estrada TorresAún no hay calificaciones
- Síntesis de piperonal mediante oxidación selectiva de alcoholDocumento8 páginasSíntesis de piperonal mediante oxidación selectiva de alcoholJuan100% (1)
- Bencilo y Cloruro de BenzalDocumento40 páginasBencilo y Cloruro de BenzalMoises Valdivia BaldomeroAún no hay calificaciones
- Síntesis Práctica de P2P A Partir de Cianuro de Bencilo A Través de FenilacetoacetonitriloDocumento1 páginaSíntesis Práctica de P2P A Partir de Cianuro de Bencilo A Través de FenilacetoacetonitriloMoises Valdivia BaldomeroAún no hay calificaciones
- Síntesis y extracción de cocaínaDocumento6 páginasSíntesis y extracción de cocaínaisvero100% (1)
- AnfetaminasDocumento5 páginasAnfetaminasKelly Avendaño GelvizAún no hay calificaciones
- Marcha Analítica en ElDocumento8 páginasMarcha Analítica en ElPedro AlemanAún no hay calificaciones
- Sintesis Resumen en Un Solo RecipienteDocumento2 páginasSintesis Resumen en Un Solo RecipienteMoises Valdivia BaldomeroAún no hay calificaciones
- Oxidación de Propenilbenceno A P2P Usando Ácido PeracéticoDocumento6 páginasOxidación de Propenilbenceno A P2P Usando Ácido PeracéticoJorge Alberto Estrada TorresAún no hay calificaciones
- Aislamiento de Trimiristina y Miristicina de Nuez Moscada. Grupo 3.Documento4 páginasAislamiento de Trimiristina y Miristicina de Nuez Moscada. Grupo 3.AndreaAún no hay calificaciones
- Marcha Analítica en ElDocumento8 páginasMarcha Analítica en ElPedro AlemanAún no hay calificaciones
- Introduccion A Los AlcaloidesDocumento41 páginasIntroduccion A Los AlcaloidescarlosAún no hay calificaciones
- Meta 2Documento37 páginasMeta 2jerrry jimmy100% (1)
- Al Calo IdesDocumento208 páginasAl Calo IdesJose SandovalAún no hay calificaciones
- Anfetaminas y AlcaloidesDocumento12 páginasAnfetaminas y AlcaloidesLois RangelAún no hay calificaciones
- La Oxidación Propenylbenzene para P2P Ácido Peracético Usando !!!Documento6 páginasLa Oxidación Propenylbenzene para P2P Ácido Peracético Usando !!!Lubomirio PetroboAún no hay calificaciones
- Clasificacion de AlcaloidesDocumento16 páginasClasificacion de AlcaloidesyuditAún no hay calificaciones
- Introducción de CedronDocumento4 páginasIntroducción de CedronJulia Yasmina Guzmán Poma100% (1)
- Desarrolle El Proceso de Extracion Del Beta Caroteno Los Equipos Involigrados en e Porceso y AplicacionesDocumento4 páginasDesarrolle El Proceso de Extracion Del Beta Caroteno Los Equipos Involigrados en e Porceso y Aplicacionesjorge11daAún no hay calificaciones
- INDUSTRIA DEL CENTENO Y SUS DERIVADOSDocumento9 páginasINDUSTRIA DEL CENTENO Y SUS DERIVADOSKaTiita SerQn100% (1)
- Quinonas y Cumarinas-OtherDocumento13 páginasQuinonas y Cumarinas-OtherJorge David Rojas CardenasAún no hay calificaciones
- BoldinaDocumento6 páginasBoldinaErnesto CuchimbaAún no hay calificaciones
- Determinación de Saponina Total en QuinuaDocumento9 páginasDeterminación de Saponina Total en QuinuaDanielaGuardia100% (1)
- SesquiterpenlactonasDocumento8 páginasSesquiterpenlactonasJoga SixxAún no hay calificaciones
- Charla de Ac. ShikimicoDocumento9 páginasCharla de Ac. ShikimicoLizbethAún no hay calificaciones
- Acido ShikimicoDocumento89 páginasAcido Shikimicolorena guzmanAún no hay calificaciones
- AlcaloidesDocumento54 páginasAlcaloidesCarlos GuerreroAún no hay calificaciones
- Fenilpropanos y HeterosidosDocumento82 páginasFenilpropanos y Heterosidosgeovanny0097100% (1)
- Cloro BVDocumento8 páginasCloro BVMoises Valdivia BaldomeroAún no hay calificaciones
- Metoxi BenceDocumento1 páginaMetoxi BenceMoises Valdivia BaldomeroAún no hay calificaciones
- Dicarbonato de DiDocumento2 páginasDicarbonato de DiMoises Valdivia BaldomeroAún no hay calificaciones
- Clorhidrato de MetildopatoDocumento2 páginasClorhidrato de MetildopatoMoises Valdivia BaldomeroAún no hay calificaciones
- Productos Derivados de Los Hidrocarburos AromáticosDocumento9 páginasProductos Derivados de Los Hidrocarburos AromáticosDavid Hernandez CarlosAún no hay calificaciones
- Proceso para La Producción de Compuesto de MandelonitriloDocumento20 páginasProceso para La Producción de Compuesto de MandelonitriloMoises Valdivia BaldomeroAún no hay calificaciones
- Bencilo y Cloruro de BenzalDocumento40 páginasBencilo y Cloruro de BenzalMoises Valdivia BaldomeroAún no hay calificaciones
- Preparación de Bromuro de Bencilo NbsDocumento1 páginaPreparación de Bromuro de Bencilo NbsMoises Valdivia BaldomeroAún no hay calificaciones
- Preparación de MandelonitriloDocumento1 páginaPreparación de MandelonitriloMoises Valdivia BaldomeroAún no hay calificaciones
- Benzoin BenjuíDocumento4 páginasBenzoin BenjuíMoises Valdivia BaldomeroAún no hay calificaciones
- Preparación de Ácido HidroyódicoDocumento2 páginasPreparación de Ácido HidroyódicoMoises Valdivia BaldomeroAún no hay calificaciones
- El Ion H3ODocumento1 páginaEl Ion H3OMoises Valdivia BaldomeroAún no hay calificaciones
- Productos de Interés Industrial EtilenoDocumento13 páginasProductos de Interés Industrial EtilenoMoises Valdivia BaldomeroAún no hay calificaciones
- BenzonitriloDocumento3 páginasBenzonitriloMoises Valdivia BaldomeroAún no hay calificaciones
- Ácido Aspártico y TestosteronaDocumento2 páginasÁcido Aspártico y TestosteronaMoises Valdivia BaldomeroAún no hay calificaciones
- Síntesis Práctica de P2P A Partir de Cianuro de Bencilo A Través de FenilacetoacetonitriloDocumento1 páginaSíntesis Práctica de P2P A Partir de Cianuro de Bencilo A Través de FenilacetoacetonitriloMoises Valdivia BaldomeroAún no hay calificaciones
- Compuestos Vinílicos Halogenados y Oxigenados de Interés InfudtrialDocumento8 páginasCompuestos Vinílicos Halogenados y Oxigenados de Interés InfudtrialMoises Valdivia BaldomeroAún no hay calificaciones
- Estil BencenoDocumento9 páginasEstil BencenoMoises Valdivia BaldomeroAún no hay calificaciones
- Benzaldehído DDDocumento8 páginasBenzaldehído DDMoises Valdivia BaldomeroAún no hay calificaciones
- Benz AmidaDocumento6 páginasBenz AmidaMoises Valdivia BaldomeroAún no hay calificaciones
- Acetaldehído BBDocumento5 páginasAcetaldehído BBMoises Valdivia BaldomeroAún no hay calificaciones
- El Acido FfolicoDocumento3 páginasEl Acido FfolicoMoises Valdivia BaldomeroAún no hay calificaciones
- Clorhidrato de MetildopatoDocumento2 páginasClorhidrato de MetildopatoMoises Valdivia BaldomeroAún no hay calificaciones
- Compuestos Vinílicos Halogenados y Oxigenados de Interés InfudtrialDocumento8 páginasCompuestos Vinílicos Halogenados y Oxigenados de Interés InfudtrialMoises Valdivia BaldomeroAún no hay calificaciones
- Benzoin BenjuíDocumento4 páginasBenzoin BenjuíMoises Valdivia BaldomeroAún no hay calificaciones
- Benzaldehído DDDocumento8 páginasBenzaldehído DDMoises Valdivia BaldomeroAún no hay calificaciones
- Benz AmidaDocumento6 páginasBenz AmidaMoises Valdivia BaldomeroAún no hay calificaciones
- Ácido AspárticoDocumento2 páginasÁcido AspárticoMoises Valdivia BaldomeroAún no hay calificaciones
- Técnica de La Reducción Selectiva No Catalítica (SNCR)Documento15 páginasTécnica de La Reducción Selectiva No Catalítica (SNCR)Alejandra CuzcoAún no hay calificaciones
- Ejercicos de Tarbuck Cap 5Documento3 páginasEjercicos de Tarbuck Cap 5Wilmer Andres GarridoAún no hay calificaciones
- MasterSet R 111 CEDocumento7 páginasMasterSet R 111 CEMiguelAngelContrerasOrtizAún no hay calificaciones
- La Importancia Del AguaDocumento5 páginasLa Importancia Del AguaJenny Bucarey Gonzalez100% (1)
- Guia 5 Biologia NutricionDocumento8 páginasGuia 5 Biologia NutricionJuan FlorezAún no hay calificaciones
- Informe Duraznos en AlmibarDocumento13 páginasInforme Duraznos en AlmibarwendyAún no hay calificaciones
- Reacciones Quimicas 2bguDocumento15 páginasReacciones Quimicas 2bguJ.J R. GAún no hay calificaciones
- Morteros Premezclados HúmedosDocumento5 páginasMorteros Premezclados HúmedosAna HerreraAún no hay calificaciones
- Tesis Camaron CubaDocumento79 páginasTesis Camaron CubaaavadiAún no hay calificaciones
- Efecto de Las Radiaciones A Nivel SubcelularDocumento16 páginasEfecto de Las Radiaciones A Nivel SubcelularItalo Viso AlvanAún no hay calificaciones
- Explotación MármolDocumento12 páginasExplotación MármolrafaelAún no hay calificaciones
- Fórmula Empírica y Molecular: Ejercicios ResueltosDocumento5 páginasFórmula Empírica y Molecular: Ejercicios ResueltosCristina RojasAún no hay calificaciones
- Empaques Semana 6 FinalDocumento24 páginasEmpaques Semana 6 FinalRichard Vásquez Chávez0% (1)
- Planta de Etileno y Polietileno FINALDocumento27 páginasPlanta de Etileno y Polietileno FINALanon_111141063Aún no hay calificaciones
- Tarea de Quimica 2Documento32 páginasTarea de Quimica 2jazminAún no hay calificaciones
- Practica 7 Fundamentos de EspectofometriDocumento10 páginasPractica 7 Fundamentos de EspectofometriSaid RodríguezAún no hay calificaciones
- 1 Parcial - Procesos IndustrialesDocumento12 páginas1 Parcial - Procesos IndustrialesNicolas GonzalezAún no hay calificaciones
- Acido Citrico y Acido LacticoDocumento26 páginasAcido Citrico y Acido LacticoADRIANA MAGDALENA ROMERO DE LA CRUZAún no hay calificaciones
- Cristalizacion de SalmuerasDocumento5 páginasCristalizacion de SalmuerasYulissa AmpueroAún no hay calificaciones
- Paracetamol 250mg SupDocumento4 páginasParacetamol 250mg SupRONALDAún no hay calificaciones
- Diabetic Ketoacidosis and Hyperosmolar Hyperglycemic State in Adults - Clinical Features, Evaluation, and Diagnosis - UpToDateDocumento18 páginasDiabetic Ketoacidosis and Hyperosmolar Hyperglycemic State in Adults - Clinical Features, Evaluation, and Diagnosis - UpToDateEddie Mondragon Gomez100% (1)
- Marmolde TrasadoDocumento5 páginasMarmolde TrasadoLuis Miguel Angel Carire AndradeAún no hay calificaciones
- Conocimientos Básicos de La Mecánica AutomotrizDocumento9 páginasConocimientos Básicos de La Mecánica AutomotrizedelramosAún no hay calificaciones
- Ejercicos de Torres ConvencionalesDocumento5 páginasEjercicos de Torres ConvencionalesDanielAún no hay calificaciones
- Bodies Guia Docentes Ed SecundariaDocumento16 páginasBodies Guia Docentes Ed SecundariaJhimy Quilca Guerrero0% (1)