Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Química
Cargado por
diane camarena lobato0 calificaciones0% encontró este documento útil (0 votos)
4 vistas2 páginasReacciones
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoReacciones
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
4 vistas2 páginasQuímica
Cargado por
diane camarena lobatoReacciones
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
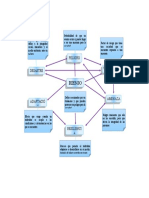
Las reacciones de precipitación forman compuestos poco solubles, producidas por
mezclar dos disoluciones dif.---La técnica de precipitación fraccionada se da en los
laboratorios y en la industria.--- la solubilidad es la máxima cantidad de soluto que se
puede disolver en el agua.--- el ph(POTENCIAL DE HIDRÓGENO) mide la acidez y
basicidad de un líquido.---el PH BÁSICO tiene mas OH, su equilibrio se desplaza hacia
la izq y tiene menor solubilidad.--- el PH ÁCIDO tiene más H, su equilibrio se desplaza
hacia la der y tiene mayor solubilidad.--- al aumentar la T la solubilidad de una
sustancia sólida aumenta, mientras que en un gas la solubilidad disminuye.--- la
Presión solo influye en la solubilidad de los gases.---la ley de henry dice que a una T
Constante, la cantidad de gas disuelto en un líquido es directamente proporcional a
su presión.--- el efecto salino es el efecto que se produce al agregar un ion no común
con un ion de una sal, produciendo el aumento de la solubilidad.---la Kps es la
constante de equilibrio que se establece entre un sólido y sus iones en una disolución
saturada.--- el efecto ion común es cuando dos solutos contienen el mismo ion(catión
o un anión).---el principio de Le Chatelier establece que si una reacción en equilibrio
es perturbada, el sistema contrarrestar dicha perturbación.---origen de los iones H
fuentes naturales: precipitacion atmosferica.---fuentes de hidróxidos fotólisis del H2O
en la atmósfera y la fotosíntesis.--- el ion H es un agente reductor y cede electrones.--
- el ion OH es un agente oxidante y capta electrones.---la fuerza iónica es la interacción
del ion-ion y ion-solvente en una sustancia electrolítica.---fuerza iónica menor la
concentración de cargas es menor y las partículas tienen mayor libertad de
movimiento.---fuerza iónica mayor la contracción de cargas es mayor y sus partículas
tienen menor libertad de movimiento.---la ley límite de debye hückel idealiza el
comportamiento de los iones, suponiendo que los iones se comportan como masas
puntuales, no deformables y sin tamaño.--- la ley ampliada de debye hückel toma en
cuenta el tamaño de la masa, considerando la hidratación y la modificación que sufre
la constante dieléctrica del agua.--- reacción ácido-base es una reacción de doble
desplazamiento y produce una sal y agua.---Arrhenius(ácido-base) es cuando el ácido
se disocia en una disolución y forma cationes H y las bases aniones OH.---
Lowry(ácido-base) formación de un ácido conjugado y una base conjugada.---
Lewis(ácido-base) donación de un par electrónico del OH al H por medio de un enlace
covalente y produciendo agua.---arrhenius un ácido es una sustancia que en solución
acuosa genera iones hidrógeno y una base es una sustancia que en solución acuosa
genera iones hidróxido.---lowry un ácido es un ion que cede protones y una base es
un ion que acepta protones.---Lewis un ácido es una sustancia que acepta electrones
y una base es una sustancia que cede electrones.---reacción Redox es una reaccion
de oxido-reducción, se debe a la transferencia de electrones desde un agente reductor
a un agente oxidante.---oxidación pérdida de H y aumenta el # de oxidación.---
reducción ganancia de H y disminuye el # de oxidación.--- ácido y base fuerte se
disocian completamente en agua.--- ácido y base débil no se disocian por completo
en el agua.---gravimetría determina la cantidad de masa de un elemento.---volumetría
determina el volumen de una sustancia.---factor gravimétrico es el peso de una
sustancia deseada.---gravimetría directa separación completa y rápida de la
sustancia.--- g. Por precipitación la sustancia se precipita mediante un reactivo dando
lugar a un producto poco soluble.---g. Por volatilización el analito en descomposición
se volatiliza a una temperatura adecuada y separa los componentes por medio de
calor.g. de partículas dependerá del tamaño de la partícula.---método volumétrico de
análisis se basa en la determinación de una sustancia mediante la medida de un
volumen de disolución de concentración conocida.---Valoración se determina por
diferencia entre las lecturas finales e inicial.---punto de equivalencia cantidad añadida
de disolución equivalente a la del analito de la muestra.---punto final se estima
observando el cambio físico.---valoración ácido-base se efectúa en una reacción de
neutralización.---valoración redox transferencia de electrones entre el analito y el
agente valorante.--- valoración de precipitación reacciones que forman compuestos
de baja solubilidad
También podría gustarte
- MineralesDocumento11 páginasMineralesdiane camarena lobatoAún no hay calificaciones
- Geologia Del Cuaternario Tarea Uno DatacionesDocumento2 páginasGeologia Del Cuaternario Tarea Uno Datacionesdiane camarena lobatoAún no hay calificaciones
- Ciencias TierraDocumento34 páginasCiencias Tierradiane camarena lobatoAún no hay calificaciones
- Mapa PoliticasDocumento1 páginaMapa Politicasdiane camarena lobatoAún no hay calificaciones
- Clasificación de SuelosDocumento3 páginasClasificación de Suelosdiane camarena lobatoAún no hay calificaciones
- Geoformas KársticasDocumento4 páginasGeoformas Kársticasdiane camarena lobatoAún no hay calificaciones
- Geoformas FluvialesDocumento12 páginasGeoformas Fluvialesdiane camarena lobatoAún no hay calificaciones
- Tri Anguli ToDocumento2 páginasTri Anguli Todiane camarena lobatoAún no hay calificaciones
- ¿Por Qué Soy Así y No de Otra Manera?: Yuli Elizabeth Camarena Lobato Grupo: 302Documento1 página¿Por Qué Soy Así y No de Otra Manera?: Yuli Elizabeth Camarena Lobato Grupo: 302diane camarena lobatoAún no hay calificaciones
- Tarea 10Documento12 páginasTarea 10diane camarena lobatoAún no hay calificaciones
- 1er EnsayoDocumento5 páginas1er Ensayodiane camarena lobatoAún no hay calificaciones
- Geoformas KársticasDocumento4 páginasGeoformas Kársticasdiane camarena lobatoAún no hay calificaciones
- Proyecto COVID-19Documento8 páginasProyecto COVID-19diane camarena lobatoAún no hay calificaciones
- Clasificación de SuelosDocumento3 páginasClasificación de Suelosdiane camarena lobatoAún no hay calificaciones
- Estructuras sedimentarias y sus orígenesDocumento5 páginasEstructuras sedimentarias y sus orígenesdiane camarena lobatoAún no hay calificaciones
- Métodos de integración elementalDocumento54 páginasMétodos de integración elementalLiderZambranoAún no hay calificaciones
- Características de Los SedimentosDocumento8 páginasCaracterísticas de Los Sedimentosdiane camarena lobatoAún no hay calificaciones
- GeoformasDocumento5 páginasGeoformasdiane camarena lobatoAún no hay calificaciones
- Los Textos y Las Conexiones Del LectorDocumento8 páginasLos Textos y Las Conexiones Del Lectordiane camarena lobatoAún no hay calificaciones
- Cadenas de PeligroDocumento17 páginasCadenas de Peligrodiane camarena lobatoAún no hay calificaciones
- Proyecto COVID-19Documento8 páginasProyecto COVID-19diane camarena lobatoAún no hay calificaciones
- Perfil TopográficoDocumento4 páginasPerfil Topográficodiane camarena lobatoAún no hay calificaciones
- Ejercicios de Química Orgánica 1aDocumento2 páginasEjercicios de Química Orgánica 1adiane camarena lobatoAún no hay calificaciones
- Fuerzas IntermolecularesDocumento17 páginasFuerzas Intermolecularesdiane camarena lobatoAún no hay calificaciones
- Compendio de MineralogiaDocumento179 páginasCompendio de MineralogiaJack Escolar100% (6)
- TermodinamicaDocumento14 páginasTermodinamicadiane camarena lobatoAún no hay calificaciones
- Glosario RSNDocumento34 páginasGlosario RSNChinox LokooAún no hay calificaciones
- Apuntes Aire HumedoDocumento15 páginasApuntes Aire HumedoGonzalo Alonso QuintanaAún no hay calificaciones
- Guía de Estudio para El Segundo Examen de Biología GeneralDocumento1 páginaGuía de Estudio para El Segundo Examen de Biología Generaldiane camarena lobatoAún no hay calificaciones
- Monografía EmprendimientoDocumento20 páginasMonografía EmprendimientoChristian Vicente Arzapalo IncheAún no hay calificaciones
- H15-1795 Manual Preview V20190809 PDFDocumento8 páginasH15-1795 Manual Preview V20190809 PDFGladys Vargas100% (1)
- 5 Sellos Dragon Fuego SPADocumento4 páginas5 Sellos Dragon Fuego SPAAdrian ManjarrezAún no hay calificaciones
- Segunda Practica de Laboratorio FISICADocumento10 páginasSegunda Practica de Laboratorio FISICAGustavo Hernandez FragosoAún no hay calificaciones
- Propuesta de Informe PericialDocumento12 páginasPropuesta de Informe PericialAngie RojasAún no hay calificaciones
- Función lineal: características, gráfica, pendiente y ecuaciónDocumento1 páginaFunción lineal: características, gráfica, pendiente y ecuaciónDarian Vindas AlfaroAún no hay calificaciones
- Contrato de Locación Inmobiliaria (Casa o Departamento en P.H.) Amoblada para TurismoDocumento5 páginasContrato de Locación Inmobiliaria (Casa o Departamento en P.H.) Amoblada para TurismoJuanGearAún no hay calificaciones
- Tarea 1 Campo ComunitariaDocumento3 páginasTarea 1 Campo ComunitariaYesid Fabian Vazquez HermosilloAún no hay calificaciones
- Caretta CarettaDocumento4 páginasCaretta CarettaYajaira GuerreroAún no hay calificaciones
- Manejo Manual de CargaDocumento38 páginasManejo Manual de CargaJean LatorreAún no hay calificaciones
- Ejercicios S8 FisicaDocumento9 páginasEjercicios S8 FisicaBrauly Herrera50% (6)
- Animales y Plantas en Peligro de Extinción de GuatemalaDocumento5 páginasAnimales y Plantas en Peligro de Extinción de GuatemalaNESTOR0% (1)
- Guia1movimientoarmnicosimple 140424160352 Phpapp01Documento2 páginasGuia1movimientoarmnicosimple 140424160352 Phpapp01Nory VergaraAún no hay calificaciones
- Investigación 1 Máquinas y Equipos Térmicos IIDocumento26 páginasInvestigación 1 Máquinas y Equipos Térmicos IICarlos Martinez VazquezAún no hay calificaciones
- Il Parcial de Costos I 2do Trimestre. 2021Documento5 páginasIl Parcial de Costos I 2do Trimestre. 2021Valentina MoyaAún no hay calificaciones
- Ensayo Sección 3 Variable Compleja (Autoguardado)Documento2 páginasEnsayo Sección 3 Variable Compleja (Autoguardado)Wilmer HaylockAún no hay calificaciones
- El Misterio de Los Siglos PDFDocumento316 páginasEl Misterio de Los Siglos PDFFredy CaceresAún no hay calificaciones
- TítuloDocumento3 páginasTítuloAlexander JhoelAún no hay calificaciones
- Evaluacion de La Inducción GeneralDocumento2 páginasEvaluacion de La Inducción GeneraldonaxtaAún no hay calificaciones
- T 5 CircuitosDocumento5 páginasT 5 CircuitosVentura Dionisio RomeoAún no hay calificaciones
- Guia de Laboratorio #01Documento5 páginasGuia de Laboratorio #01James AnthonyAún no hay calificaciones
- Psicopatología - Tercer ParcialDocumento228 páginasPsicopatología - Tercer ParcialMaría FsfAún no hay calificaciones
- Quemados - Manejo Del Paciente PediátricoDocumento28 páginasQuemados - Manejo Del Paciente PediátricoDr. Francisco ZapataAún no hay calificaciones
- Unidad 5 Mantenimiento A Turbinas de VaporDocumento39 páginasUnidad 5 Mantenimiento A Turbinas de VaporDeygler Alor Santiago100% (2)
- Lubricación de Vehiculos Livianos 2022Documento25 páginasLubricación de Vehiculos Livianos 2022jeanalessandrolozadaAún no hay calificaciones
- ANDRAGOGIADocumento13 páginasANDRAGOGIAJosé Ponce TataAún no hay calificaciones
- Trabajo Fina Seminario IiiDocumento33 páginasTrabajo Fina Seminario IiiVictor FlorezAún no hay calificaciones
- Aguirrefabian, Gestor - A de La Revista, 73-104-1-CEDocumento5 páginasAguirrefabian, Gestor - A de La Revista, 73-104-1-CEMARIA GOMEZAún no hay calificaciones
- 1 2019 Manual de Notificación y Publicación de DiferenciasDocumento30 páginas1 2019 Manual de Notificación y Publicación de DiferenciasRicardo ChavezAún no hay calificaciones
- Diseño Curricular de Filosofía Ciclo Orientado Nes.Documento8 páginasDiseño Curricular de Filosofía Ciclo Orientado Nes.Eduardo Andrés NavarroAún no hay calificaciones