Documentos de Académico
Documentos de Profesional
Documentos de Cultura
2016 - Modelo Prueba Nº1 Lab QM ULS
Cargado por
stephanie leivaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
2016 - Modelo Prueba Nº1 Lab QM ULS
Cargado por
stephanie leivaCopyright:
Formatos disponibles
UNIVERSIDAD DE LA SERENA
FACULTAD DE CIENCIAS
DEPARTAMENTO DE QUIMICA
Prof. Juan Carlos Hidalgo M.
Química Metalúrgica
MODELO DE PRUEBA DE LABORATORIO
SELECCIÓN MÚLTIPLE
• Se reconoce una sustancia ácida con fenolftaleína porque la solución se torna
A) amarilla. D) fucsia.
B) anaranjada. E) incolora.
C) azul.
• ¿Cuál de las siguientes propiedades no corresponde a un patrón primario de titulación?
A) De fácil disolución
B) Es higroscópico
C) Tiene alta pureza
D) Tiene un peso equivalente alto
E) No reacciona con el CO2 atmosférico
• Para recuperar el cloruro de potasio desde una disolución concentrada se debe aplicar
A) evaporación.
B) filtración.
C) decantación.
D) sublimación.
E) destilación fraccionada.
• El agua pura no conduce la corriente eléctrica porque
A) su pH es neutro.
B) es una sustancia covalente apolar.
C) su constante de autoionización es 1 ∙ 10-14
D) tiene una densidad bastante elevada.
E) sus moléculas su unen a través de puentes de hidrógeno.
• ¿Cuál(es) de los siguientes materiales de laboratorio no se ocupa(n) al preparar ¼ L de
disolución de NaNO3 0,5 M?
I. Probeta
II. Matraz de aforo
III. Pipeta total
IV. Vaso de precipitados
Es (son) correcta(s)
A) sólo I. D) sólo I y III.
B) sólo III. E) sólo III y IV.
C) sólo I y IV.
• 20 mL de HNO3 0,04 M se neutralizaron con una disolución de Ca(OH) 2 0,05 M. ¿Qué
volumen de base se necesitó para neutralizar todo el HNO 3?
A) 8 mL D) 16 mL
B) 10 mL E) 25 mL
C) 12 mL
• El hidróxido de sodio no es un patrón primario de titulación porque es
A) una sal.
B) un hidrato.
C) delicuescente.
D) una sal cáustica.
E) una base hidroxilada.
• Se quiere recuperar sulfato de magnesio desde una muestra de agua de mar y arena.
Siguiendo un orden secuencial, ¿qué técnicas habrá que aplicar?
A) Destilación y tamizado
B) Decantación y evaporación
C) Cristalización y destilación
D) Evaporación y tamizado
E) Precipitación y decantación
• El matraz de erlenmeyer se utiliza para
A) evaporar líquidos.
B) realizar ensayos o pruebas.
C) preparar soluciones molares
D) medir volúmenes de líquidos.
E) calentar y contener líquidos.
PROBLEMAS
➢ Sólo aproxime el resultado final y no los valores intermedios.
➢ En cada ejercicio planteado se evalúa el procedimiento y el resultado.
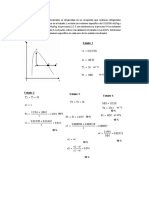
1. ¿Cuántos gramos de FeCl3 · 6 H2O y de agua se necesitan para preparar 400 g de disolución
de FeCl3 al 10 % m/m? Expresar resultado con 2 decimales. Masas atómicas: H=1; O=16;
Fe=55,8: Cl=35,5
2. Una solución acuosa de ácido sulfúrico, H2SO4, al 92 % m/m tiene una densidad de 1,82
g/mL. ¿Cuántos mL de esta disolución habrá que diluir para preparar 500 mL de H2SO4
0,150 M? Masas atómicas: H=1; O=16; S=32,1
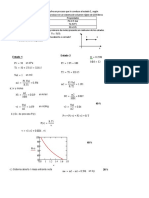
3. 0,230 g de Na2CO3 patrón, se disolvieron en agua destilada y se titularon con una
solución de HCl, obteniéndose un gasto de 24,7 mL. Masas atómicas: C=12 O=16
Na=23 g/mol
a) Escriba la ecuación química balanceada de la reacción descrita. (1 puntos)
b) Calcule el número de mol de HCl neutralizados. (2 puntos)
c) Calcule la molaridad del HCl con 4 decimales. (1 punto)
Materiales de laboratorio
• Escriba el nombre de cada material de laboratorio.
1 2 3 4 5
1. 2. 3.
4. 5.
También podría gustarte
- TP8 Volumetria Redox 2023Documento3 páginasTP8 Volumetria Redox 2023Santiago GowlandAún no hay calificaciones
- Parcial # 1 de Lab. de Química IDocumento5 páginasParcial # 1 de Lab. de Química IEliGaby MoralesAún no hay calificaciones
- Prueba Formativa de Laboratorio Química MetalúrgicaCuestionarioDocumento3 páginasPrueba Formativa de Laboratorio Química MetalúrgicaCuestionarioSimón RojasAún no hay calificaciones
- Problemario 2Documento5 páginasProblemario 2Chico Pedroza Ingrid AbigailAún no hay calificaciones
- 8-Métodos Normalizados CLORURO Seccion 4500-CL p4-76Documento10 páginas8-Métodos Normalizados CLORURO Seccion 4500-CL p4-76Marina Saavedra CamachoAún no hay calificaciones
- Examen Practico QuímicaDocumento3 páginasExamen Practico QuímicaOrlandojalal LopezAún no hay calificaciones
- Clase 9Documento3 páginasClase 9Melba KaisenAún no hay calificaciones
- Psu IvDocumento7 páginasPsu IvNicol Wachtendorff ChandíaAún no hay calificaciones
- Volume TriaDocumento17 páginasVolume TriaDaniel SantillánAún no hay calificaciones
- Parcial de Química Analítica, Ingeniería Química UCDocumento1 páginaParcial de Química Analítica, Ingeniería Química UCLuis Alberto Lopez AmpiezAún no hay calificaciones
- Extracción líquido-líquido y sus aplicacionesDocumento37 páginasExtracción líquido-líquido y sus aplicacionesTonyFontanaAún no hay calificaciones
- PROBLEMARIO VolumetríaDocumento5 páginasPROBLEMARIO VolumetríaVerónica LópezAún no hay calificaciones
- Informe N4Documento4 páginasInforme N4sofia umpireAún no hay calificaciones
- Practica 3Documento5 páginasPractica 3Vinke Gop SalazarAún no hay calificaciones
- Documento de LiliumDocumento1 páginaDocumento de LiliumExlibris Lilium0% (1)
- Práctico 5Documento2 páginasPráctico 5Julieta HuaycaAún no hay calificaciones
- Taller FundamentosDocumento5 páginasTaller FundamentosYulieth Garcia100% (1)
- Problemas Quimica 20.21lDocumento2 páginasProblemas Quimica 20.21lEustaquioAún no hay calificaciones
- SOLUCIONESDocumento4 páginasSOLUCIONESNashiaAún no hay calificaciones
- FQ AnaliticaDocumento3 páginasFQ AnaliticaNancy Belträn RdzAún no hay calificaciones
- Preparación y valoración HCl 0,1000 N con bóraxDocumento3 páginasPreparación y valoración HCl 0,1000 N con bóraxRenzhito YupankiAún no hay calificaciones
- Solubilidad y valoraciones de precipitaciónDocumento2 páginasSolubilidad y valoraciones de precipitaciónHender Rubiano GuzmanAún no hay calificaciones
- Activida1 LAB LECC 6Documento3 páginasActivida1 LAB LECC 6said gonzalezAún no hay calificaciones
- Talleres 3 y 4Documento5 páginasTalleres 3 y 4Jeffersson Andres Alvarez CarreñoAún no hay calificaciones
- Actividad Acidos y BasesDocumento5 páginasActividad Acidos y BasesAlexis Chapoñan ValderaAún no hay calificaciones
- Flores - Yadira Milagro - 3parcial - A1Documento11 páginasFlores - Yadira Milagro - 3parcial - A1Milagro FloresAún no hay calificaciones
- Practica N 2-ANALISIS QUIMICO CUANTITATIVODocumento8 páginasPractica N 2-ANALISIS QUIMICO CUANTITATIVOValentina LunaAún no hay calificaciones
- Guía de soluciones químicas y análisis gravimétrico y volumétricoDocumento2 páginasGuía de soluciones químicas y análisis gravimétrico y volumétricomelissa romanAún no hay calificaciones
- Universidad de Sonora: Laboratorio de Análisis Químico AplicadoDocumento5 páginasUniversidad de Sonora: Laboratorio de Análisis Químico AplicadoEqualAirplane18Aún no hay calificaciones
- Examen 1 Evaluacion Continua 2021 ADocumento2 páginasExamen 1 Evaluacion Continua 2021 ADARWIN ALEJANDRO VASQUEZ MOLLEAPAZAAún no hay calificaciones
- Problemario Quiica AnaliticaDocumento3 páginasProblemario Quiica AnaliticaPablo CarreónAún no hay calificaciones
- Enunciados Deber Soluciones - 21-21Documento2 páginasEnunciados Deber Soluciones - 21-21Nicolay Portalanza100% (1)
- EXAMENDocumento6 páginasEXAMENAlonso Lopez MendozaAún no hay calificaciones
- IMPRESO Práctica 3 - Sal de Mohr PDFDocumento4 páginasIMPRESO Práctica 3 - Sal de Mohr PDFSOFIA MELENDEZ RODRIGUEZAún no hay calificaciones
- Quimica9 PrimaveraDocumento3 páginasQuimica9 PrimaveraCesar Giancarlo Jimenez TellezAún no hay calificaciones
- EJERCICIOS DE SELECTIVIDAD. Acido y BaseDocumento4 páginasEJERCICIOS DE SELECTIVIDAD. Acido y BasequimicasafaAún no hay calificaciones
- 0 Examen TP 1 Soluc PDocumento3 páginas0 Examen TP 1 Soluc Pfmartineznavarro7343Aún no hay calificaciones
- ABAUQuim Jun 18 EsDocumento10 páginasABAUQuim Jun 18 EsAcademicScientistsAún no hay calificaciones
- Taller 2-Libro Guía2Documento3 páginasTaller 2-Libro Guía2isaAún no hay calificaciones
- LAB-QUIAN 01 Problemas Sobre DisolucionesDocumento1 páginaLAB-QUIAN 01 Problemas Sobre DisolucionesManuelAún no hay calificaciones
- Guia de Problemas 5 - Volumetría Ácido BaseDocumento5 páginasGuia de Problemas 5 - Volumetría Ácido BaseSol PolitanoAún no hay calificaciones
- pH y teorías ácido-baseDocumento3 páginaspH y teorías ácido-baseFrancisco AlexisAún no hay calificaciones
- Ejercicios de Volumetria Por NeutralizacionDocumento2 páginasEjercicios de Volumetria Por NeutralizacionKatty Rojas DiazAún no hay calificaciones
- Guia 2 - TITULACION ACIDO BASE PDFDocumento5 páginasGuia 2 - TITULACION ACIDO BASE PDFJoseph ChitanAún no hay calificaciones
- Reporte de La Practica No 1Documento5 páginasReporte de La Practica No 1DavidRomanAún no hay calificaciones
- Taller Soluciones ActualizadoDocumento2 páginasTaller Soluciones ActualizadoOSMIN DURAN VILLEDAAún no hay calificaciones
- Informe de Práctica Química AmbientalDocumento53 páginasInforme de Práctica Química AmbientalLeidicitha Madrigal CAún no hay calificaciones
- Guia Q-Iii DisolucionesDocumento4 páginasGuia Q-Iii DisolucionesFabrizio2402 HernándezAún no hay calificaciones
- Informe 6 QuímicaDocumento13 páginasInforme 6 QuímicaCarbajal JavierAún no hay calificaciones
- Taller4-Reacciones en Disolucion AcuosaDocumento6 páginasTaller4-Reacciones en Disolucion AcuosaBREINER ANDREY VEGA HERNANDEZAún no hay calificaciones
- Informe de LaboratorioDocumento9 páginasInforme de LaboratorioDiego LeivaAún no hay calificaciones
- Hoja 45 Equilibrio Químico IónicoDocumento4 páginasHoja 45 Equilibrio Químico IónicoCiro Rodriguez RuizAún no hay calificaciones
- Practica 2-Det Caracter Quim AguaDocumento8 páginasPractica 2-Det Caracter Quim AguaR RodríguezAún no hay calificaciones
- 1 Bloque de Ejercicios 2020-2Documento4 páginas1 Bloque de Ejercicios 2020-2Isabella Vargas Marin0% (1)
- Ejercicios propuestos por grupo para trabajar semana 15Documento7 páginasEjercicios propuestos por grupo para trabajar semana 15Steiner AguirreAún no hay calificaciones
- Propiedades de Compuestos OrgánicosDocumento7 páginasPropiedades de Compuestos OrgánicosRenata Quintero SuárezAún no hay calificaciones
- Evidencia 4. Volumetría Ácido BaseDocumento2 páginasEvidencia 4. Volumetría Ácido BaseGeovanni Ruiz RomeroAún no hay calificaciones
- Química General: Taller de Disoluciones y ReaccionesDocumento3 páginasQuímica General: Taller de Disoluciones y ReaccionesMauricio AcevedoAún no hay calificaciones
- Prob 1 P1sem1term2013Documento1 páginaProb 1 P1sem1term2013stephanie leivaAún no hay calificaciones
- Documento 2Documento21 páginasDocumento 2stephanie leivaAún no hay calificaciones
- Operaciones UnitariasDocumento20 páginasOperaciones Unitariasstephanie leivaAún no hay calificaciones
- Ayudantia N°4 y 5Documento4 páginasAyudantia N°4 y 5stephanie leivaAún no hay calificaciones
- 14a - Cadenas de Markov (Problema)Documento5 páginas14a - Cadenas de Markov (Problema)Anonymous xn4xmZ7m100% (3)
- 6th Central Pay Commission Salary CalculatorDocumento15 páginas6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- InventarioDocumento16 páginasInventariostephanie leivaAún no hay calificaciones
- Gases de Efecto Invernadero y El Cambio Climatico PDFDocumento102 páginasGases de Efecto Invernadero y El Cambio Climatico PDFJose Manuel Tejera GonzalvezAún no hay calificaciones
- Flujo No Permanente en CanalesDocumento20 páginasFlujo No Permanente en Canalesstephanie leivaAún no hay calificaciones
- 01 - Definición Del Problema EconómicoDocumento22 páginas01 - Definición Del Problema EconómicoFelipe Alonso Rojas VeraAún no hay calificaciones
- Procesos Estocásticos 2019 PDFDocumento56 páginasProcesos Estocásticos 2019 PDFstephanie leivaAún no hay calificaciones
- Electroquímica Celdas-Ecuación de Nerst-Leyes de FaradayDocumento11 páginasElectroquímica Celdas-Ecuación de Nerst-Leyes de FaradayDaniel Thano100% (1)
- EjercicioDocumento3 páginasEjerciciostephanie leivaAún no hay calificaciones
- AEBO Autoestima basada en la OrganizaciónDocumento19 páginasAEBO Autoestima basada en la Organizaciónstephanie leivaAún no hay calificaciones
- 4 1 Cadenas de MarkovDocumento122 páginas4 1 Cadenas de Markovstephanie leivaAún no hay calificaciones
- Curso EceiDocumento39 páginasCurso EceiFrancisco Solano Reyes EspinozaAún no hay calificaciones
- Prob 2Documento1 páginaProb 2stephanie leivaAún no hay calificaciones
- GeologiaquimicaDocumento6 páginasGeologiaquimicastephanie leivaAún no hay calificaciones
- Falla San Ramon-1 PDFDocumento3 páginasFalla San Ramon-1 PDFstephanie leivaAún no hay calificaciones
- Solucion Prueba 2 s1 2016 - B - E2 - E3 PDFDocumento2 páginasSolucion Prueba 2 s1 2016 - B - E2 - E3 PDFstephanie leivaAún no hay calificaciones
- Prueba 1 m2 - s1 - 2018 - 1Documento3 páginasPrueba 1 m2 - s1 - 2018 - 1stephanie leivaAún no hay calificaciones
- C4 Magmas, Rocas Igneas, YacimientosDocumento20 páginasC4 Magmas, Rocas Igneas, Yacimientosstephanie leivaAún no hay calificaciones
- Prob 1Documento1 páginaProb 1stephanie leivaAún no hay calificaciones
- Curva de TitulaciónDocumento4 páginasCurva de TitulaciónAnyi LampreaAún no hay calificaciones
- Material EsDocumento2 páginasMaterial EsSelene Aguilar CamposAún no hay calificaciones
- Informe ColorimetriaDocumento8 páginasInforme ColorimetriaCatherin VargasAún no hay calificaciones
- Operaciones Unitarias 2 - Método de McCabe-ThieleDocumento39 páginasOperaciones Unitarias 2 - Método de McCabe-ThielepatobohrAún no hay calificaciones
- Calculos y Resultados de La Extraccion LiquidaDocumento10 páginasCalculos y Resultados de La Extraccion LiquidaZT ArnaldoAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualRodrigo Cruz PlazaAún no hay calificaciones
- Intercambio IonicoDocumento9 páginasIntercambio IonicoAnnette FernandezAún no hay calificaciones
- Practica3 - Solucion AmortiguadoraDocumento6 páginasPractica3 - Solucion AmortiguadoraNicolHernandezNarvaez100% (2)
- Asignacion #2 CMIDocumento7 páginasAsignacion #2 CMIKadir MuñozAún no hay calificaciones
- 3ro Ácidos OxácidosDocumento3 páginas3ro Ácidos OxácidosDaniel Freddy Quispe MamaniAún no hay calificaciones
- Equilibrio I Ejercicios ResueltosDocumento16 páginasEquilibrio I Ejercicios ResueltosCamila ContrerasAún no hay calificaciones
- Factores solubilidad sales compuestosDocumento15 páginasFactores solubilidad sales compuestosMarcos Mendoza MejiaAún no hay calificaciones
- Preguntas de Química-15-Mayo-SaludDocumento8 páginasPreguntas de Química-15-Mayo-SaludJose Ignacio Lopez GarciaAún no hay calificaciones
- PH y Acidez TitulableDocumento21 páginasPH y Acidez TitulableMaria Celina Moyano CarreteroAún no hay calificaciones
- QUÍMICA ANALÍTICA UNIDAD 1 Parte 1Documento43 páginasQUÍMICA ANALÍTICA UNIDAD 1 Parte 1Luis SRAún no hay calificaciones
- Q.An. e Inst - Clase 7 - Volumetria 2Documento33 páginasQ.An. e Inst - Clase 7 - Volumetria 2JONATHAN JUNIOR PARRALES BRINGASAún no hay calificaciones
- Resolución de problemas de químicaDocumento9 páginasResolución de problemas de químicaRossy IP0% (1)
- PROBLEMASDocumento6 páginasPROBLEMASJuan Carlos Castillo ZamoraAún no hay calificaciones
- Determinacion de PH y Acidez Lab QuispDocumento15 páginasDeterminacion de PH y Acidez Lab QuispCarlos Alexis Carmen CordovaAún no hay calificaciones
- Acidez y pH de alimentosDocumento8 páginasAcidez y pH de alimentosFiorelaGasparSaenzAún no hay calificaciones
- Deber 1 Simulador VirtualDocumento3 páginasDeber 1 Simulador VirtualAlejandro ÁlavaAún no hay calificaciones
- 1ejercicio de MolaridadDocumento1 página1ejercicio de MolaridadJorge MéndezAún no hay calificaciones
- Pia FQ - Equipo 3Documento4 páginasPia FQ - Equipo 3Priscila MejiaAún no hay calificaciones
- DestilaciónDocumento20 páginasDestilaciónArturo Ayala cachoAún no hay calificaciones
- Investigación CienciasDocumento17 páginasInvestigación CienciasAnne McKyntireAún no hay calificaciones
- Espectrometría de Masas ESI-MSMSDocumento5 páginasEspectrometría de Masas ESI-MSMSJuan CamiloAún no hay calificaciones
- Soluciones 11-15Documento3 páginasSoluciones 11-15Melissa CruzAún no hay calificaciones
- Clase IVDocumento45 páginasClase IVanaAún no hay calificaciones
- Practica 5. Preparación de Soluciones BufferDocumento29 páginasPractica 5. Preparación de Soluciones BufferXiomara SanchezAún no hay calificaciones
- Metodo de Ponchon SavaritDocumento19 páginasMetodo de Ponchon SavaritVanessa RuizAún no hay calificaciones